H1 亚型猪流感病毒微滴数字RT-PCR定量检测方法的建立
2019-11-04谭建锡禹思宇唐连飞胡忆文侯义宏
谭建锡,禹思宇,唐连飞,胡忆文,白 雪,侯义宏
(1.长沙海关技术中心,湖南长沙 410004;2.岳阳海关,湖南岳阳 414000;3.常德海关,湖南常德 415000)
猪流感(swine influenza,SI)是一种严重的呼吸道传染病,由猪流感病毒(swine influenza virus,SIV)引起,具有急性、高度接触性、群发性等特点,临床主要表现为咳嗽、呼吸困难、发热,不同年龄、性别和品种的猪均能感染,是普遍存在于规模化养猪场中的群发性疾病[1]。猪体内混合有禽流感病毒和人流感病毒的受体,较易产生新型的重配病毒。SIV 在猪群中以H1 和H3 为主要流行亚型,因此如何快速有效检测H1亚型SIV 越来越受到关注。目前,流感病毒的快速检测主要利用基于分子技术的普通RT-PCR 和实时荧光RT-PCR 等方法[2]。荧光定量RT-PCR法具有较高特异性和灵敏度,应用较为广泛,但其定量测定需要用标准品建立标准曲线,因而操作耗时费力。
微滴数字PCR(droplet digital PCR,ddPCR)作为一种新兴起的核酸绝对定量技术,可从溶液中直接获得样本拷贝数,而不需要依赖于标准品和标准曲线。其原理是通过极度稀释,在一定数目的微滴中分布1 个或0 个拷贝,进行PCR 单分子扩增后,读取样本荧光信号,再通过泊松(poisson)分布和统计学方法来计算核酸拷贝数。由于不依赖建立标准曲线,且对低浓度核酸样品也可进行高灵敏度的绝对定量,使得ddPCR 技术在核酸绝对定量领域有极大的应用前景[4]。已有文献[6]报道,将该技术应用于伪狂犬病病毒[5]和H7N9 流感病毒的定量研究,但未对ddPCR 退火温度进行优化,也未见将ddPCR 技术应用于H1 亚型SIV 绝对定量检测的相关报道。
本研究将ddPCR 技术应用于H1 亚型SIV 检测,并对其最佳退火温度、检出限以及检测准确度等方面进行研究,建立了H1 亚型SIV ddRT-PCR绝对定量检测方法,为我国H1 亚型SIV 的实时监控提供了技术支持。
1 材料与方法
1.1 试验材料
H1、H3、H5、H7 亚型SIV,以及猪繁殖与呼吸综合症病毒(PRRSV)、猪瘟病毒(CSFV)均为灭活病毒,由长沙海关技术中心动物检疫实验室保存。
1.2 试剂和仪器
One-step RT-ddPCR Advanced Kit for Probes、ddPCR droplet generation oil for Probes、Droplet Reader Oil:购自美国伯乐公司;QIAamp Viral RNA Mini Kit:购自QIAGEN 公司;一步法qRTPCR 试剂(EvoScript RNA Probes Master):购自瑞士罗氏公司;PX1 热封仪、微滴式数字PCR 仪:QX200伯乐;梯度PCR扩增仪:LabCycler 96,德国;荧光PCR 仪:LC480 罗氏。
1.3 引物设计
将GenBank 数据库中的H1 亚型SIV HA 基因序列进行生物学信息分析,选出高度保守且特异的区域(1 536~1 692 bp),利用Oligo 及Primer Premier 软件,设计并合成特异性引物和TaqMan荧光探针。试验中用到的引物及探针序列见表1,所有引物及探针均由Invitrogen 公司合成。

表1 H1 亚型SIV ddRT-PCR 引物和探针序列
1.4 RNA 提取
按照QIAamp Viral RNA Mini Kit 试剂盒说明书,提取H1、H3、H5 和H7 亚型流感病毒以及PRRSV、CSFV 等病毒的基因组RNA,并将提取好的RNA 保存于-80 ℃冰箱中备用。
1.5 ddPCR 反应方法构建
反应体系(20 μL):4×Supermix 5 μL,上、下游引物终浓度均为900 nmol/L,探针终浓度为250 nmol/L,以及300 nmol/L DTT 1 μL、RNA 模板2 μL,用ddH2O 补足至20 μL。
微滴生成:将20 μL 反应液和70 μL 微滴生成油,分别加入到微滴生成卡DG8 的中间和最后一排的各孔中,用专用胶垫覆盖后,放置于微滴生成仪上,自动生成微滴于第1 排;吸取40 μL 油滴加入96 孔板内。
封膜及扩增:将96 孔板放置于PX1 热封仪上,设置程序180 ℃ 10 s 进行封膜;之后,将封好膜的96 孔板放入梯度PCR 扩增仪上进行扩增。反应条件:95 ℃ 10 min;95 ℃15 s,最佳退火温度1 min,40 个循环。
数据读取及分析:将96 孔板放入QX200 微滴式数字PCR 仪中读取信号,获得试验数据并分析。阴性对照中的模板用水代替。
1.6 退火温度条件优化
在PCR 仪上设置扩增温度梯度,退火梯度范围为55~61 ℃,温度间隔1 ℃,共7 个温度梯度。按照1.5 中的操作,对应设置PCR 扩增温度后进行反应,并进行数据分析;用RNA 核酸标准品进行试验,重复3 次,求平均值,确定最佳退火温度。
1.7 灵敏性及重复性试验
将H1 亚型SIV 核酸进行10 倍梯度稀释,并以此为模板,取2 μL 用已建立的ddRT-PCR 方法,测定最低检出限,并绘制线性标准曲线。反应体系和反应条件按照1.5 和1.6 筛选出的最佳条件设置。试验操作重复3 次,计算变异系数,进行重复性评估。
1.8 特异性试验
以H1、H3、H5 和H7 亚型SIV,以及PRRSV、CSFV 核酸为模板进行特异性检测。
1.9 临床应用
将从湖南省规模化猪场收集到的30 份猪鼻拭子样品提取核酸后,分别用本试验建立的ddRTPCR 方法和qRT-PCR 方法进行检测,对比检测结果的一致性。
2 结果与分析
2.1 ddRT-PCR 方法建立
根据已发表文献和试验指南,制备ddPCR 反应体系,对体系退火温度进行了优化,建立了H1亚型SIV ddRT-PCR 检测方法。结果(图1)显示,退火温度55~61 ℃范围内均有荧光信号被检出,阴阳性微滴有明显分界,且在57~58 ℃时出现最大扩增振幅;当温度为55 ℃时,阴阳性微滴中间略微存在弥散;当退火温度为56~61℃时,阴阳性微滴中间弥散较少,可能因温度太低引起的扩增特异性略有降低。综合考虑,选择58 ℃作为反应最佳退火温度。

图1 H1 亚型SIV ddPCR 退火温度优化结果
随着样本核酸浓度依次降低,由左到右(A03—H03),反应体系中阳性微滴数量(蓝色点)逐渐减少;相对应的,同体系中阴性反应的微滴数目(黑色点)则逐渐增加,颜色不断变深(图2)。直方图(图3)显示,阳性微滴峰的荧光强度普遍较高,而阴性微滴峰的荧光强度较低,且两者之间存在明显区分,无杂峰。以上结果说明,建立的H1 亚型SIV ddRT-PCR 方法有较高的可靠性。

图2 不同浓度下的H1 亚型SIV ddRT-PCR 散点图

图3 不同浓度下的H1 亚型SIV ddRT-PCR 直方图
2.2 标准曲线和最低检测限
分别用核酸稀释度和阳性拷贝数的对数值绘制标准曲线(图4),发现线性方程为y=-1.068 2x+5.855 6,线性关系R2值为0.994,最低检测限为4.7 copies/μL,表明此方法具有较好的线性关系。
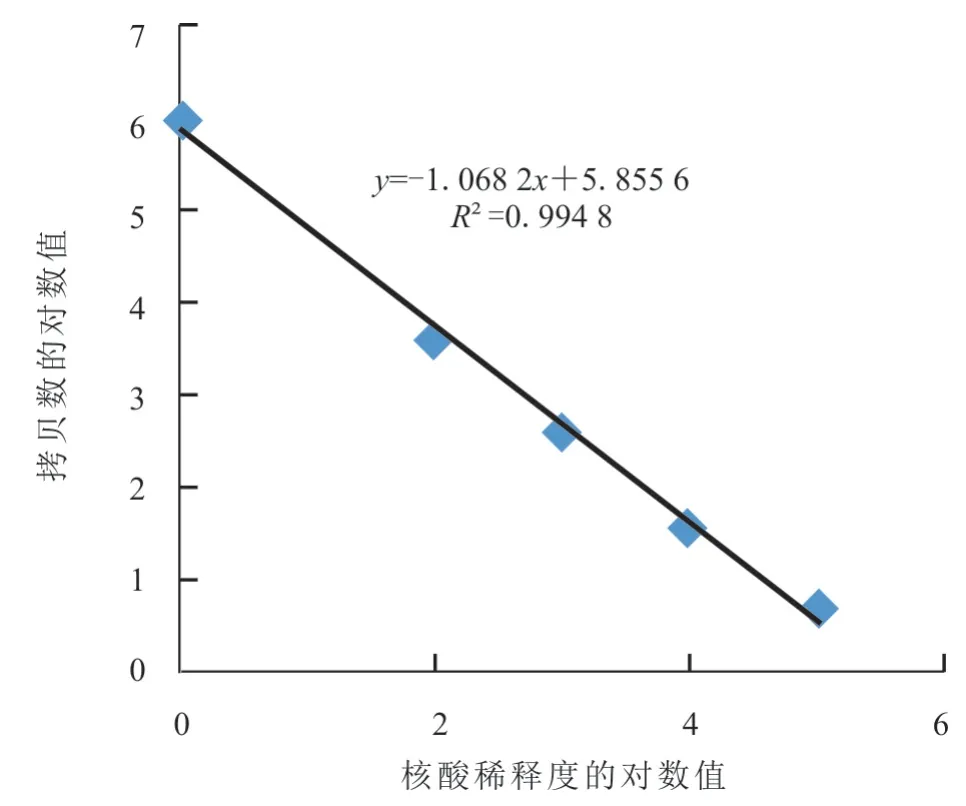
图4 H1 亚型SIV ddRT-PCR 标准曲线
2.3 ddPCR 重复性分析
利用建立的ddPCR 方法,对同一核酸模板进行3 次重复试验,发现变异系数均〈5%,证明所建立的ddPCR 检测方法重复性良好,检测结果稳定、可靠(表2)。

表2 微滴式ddRT-PCR 重复性试验结果
2.4 ddPCR 特异性试验
以H1、H3、H5 和H7 亚型SIV 以及PRRSV和CSFV 的基因组RNA 为模板进行ddRT-PCR 扩增,发现各孔微滴的生成量比较均衡,能够满足试验成立条件。由图5 可知,仅H1 亚型SIV 检测孔出现阳性微滴,H3、H5、H7 亚型SIV,以及PRRSV、CSFV 和阴性对照孔中,均未检测到阳性微滴信号,即与其他病毒均无交叉反应,表明该方法检测H1 亚型SIV 核酸具有良好的特异性。

图5 H1 亚型SIV ddPCR 特异性试验结果
2.5 临床样品验证
将30 份猪鼻拭子样品提取RNA 后,分别用本试验建立的ddRT-PCR 方法以及qRT-PCR 方法进行检测,发现2 份样品均检测为阳性,其余28份样品均检测为阴性,表明两种方法检测结果一致,符合率为100%。
3 讨论
H1 亚型动物流感一直威胁着畜禽业的发展,同时也威胁着人类健康[7]。传统的荧光RT-PCR 方法被广泛用于流感病毒的定性检测,但其定量检测需要依赖外标对样品初始拷贝数定量后再进行测定,操作过程耗时费力[8]。随着新技术的发展,也有其他新方法被用于流感病毒的定量检测。王潇等[9]利用重组酶聚合酶扩增技术(RT-RPA)对H1 亚型动物流感进行检测,最低可检测到的病毒核酸浓度为0.96×10-2g/mL。刘文俊等[10]建立动物H1 亚型流感病毒(IV)的重组酶聚合酶扩增-侧流层析试纸条(RPA-LFD)检测方法,可检测到最低浓度为10 copies/μL 的重组质粒标准品。ddPCR 的最高检测拷贝数约为2×104copies/μL,初始浓度过高时,不符合泊松分布,无法实现对阳性微滴数的检测[5]。
数字微滴PCR 技术具有对反应条件要求较低、抑制剂对反应影响较小[11]、可检测到单个拷贝、不需要建立标准曲线等优点,使其在病毒定量检测中得到了广泛应用。本研究通过ddPCR 技术,建立了H1 亚型SIV 绝对定量方法,确定了最佳退火温度、核酸浓度范围及最低检出限,实现了直接得出样品中病毒核酸拷贝数的绝对定量和高灵敏度检测,为病毒的定量检测提供了一种新思路。ddRTPCR 也有其不足之处,目前微流控微滴芯片单次生成量较低,大量样品需多次操作,大多数仪器仅配置1~2 重荧光信号通道,因此多重荧光检测方面还需加强。随着未来技术的进步,高通量微流控微滴生成芯片的研制及高重荧光信号通道的出现,会大大提高ddPCR 技术的检测效率,将会推动其在更大领域的广泛应用。
