非小细胞肺癌患者血清术前白蛋白/球蛋白比值与患者术后生存率的相关性分析
2019-11-01范金斌李军朱丹
范金斌,李军,朱丹
(1.宿迁市中医院检验科,江苏 宿迁223800;2.宿迁市儿童医院,江苏 宿迁 223800)
在全球范围内,非小细胞肺癌(NSCLC)是最常见的癌症之一[1]。近年来,随着诊断和治疗技术的进步,NSCLC患者的5年总生存率已上升至28.0%~44.3%[2],但预后仍然不佳。肿瘤分化、淋巴结转移、TNM分期被公认为是NSCLC最重要的预后指标。然而,它们只能部分预测NSCLC患者的预后[3]。因此,临床上需要简单和有效的生物学标志物,确保综合评估和准确预测患者的预后。
以往的研究发现,营养不良和炎症是恶性肿瘤常见的并发症,并且与恶性肿瘤的短期和长期临床结局相关[4]。血清白蛋白和球蛋白水平很重要,临床上通常用于评估患者术前的营养状况和炎症反应[5]。由肿瘤产生的促炎症细胞因子可以刺激急性期反应蛋白的产生,作为血清球蛋白的一部分,同时会抑制白蛋白的合成[6]。此外,白蛋白在抗癌药物的分布和活性中起重要作用[7]。最近的研究发现,低血清白蛋白和高血清球蛋白是多种癌症的两个独立的预后因素[4,5,8]。 因此,本文假设血清白蛋白和球蛋白比值(AGR)是一种潜在的评估NSCLC患者预后的术前生物学标志物。以往的几项研究都有证实了术前AGR与癌症的长期生存率之间的相关性[9-15],但关于NSCLC的研究尚未报道。本文旨在探讨NSCLC患者血清术前AGR与患者术后生存率的相关性。
1 研究对象与方法
1.1 研究对象 本文回顾性分析了2012年1月至2018年6月在我院胸外科接受手术的NSCLC患者269例GC例。纳入标准:(1)病理学确诊为原发性NSCLC,无远处器官转移;(2)未接受新辅助化疗;(3)肝肾功能正常;(4)无慢性病史、炎症性疾病或免疫抑制治疗史。排除标准:(1)肝肾功能不全;(2)合并有慢性疾病,包括冠心病、高血压、糖尿病等;(3)合并有急性或慢性感染性疾病。根据AGR将患者分为低AGR组和高AGR组。
1.2 评估指标 所有的临床和实验室数据都是医院数据库中收集。具体信息包括性别、年龄、并发症、术前实验室数据和肿瘤的病理学特点。此外,还收集了术后接受化疗的病例资料。NSCLC的分期按照第7版《美国癌症联合会肿瘤分期手册》的标准[3]。所有患者均被随访至死亡或2018年12月。
采用公式AGR=血清白蛋白值/血清球蛋白值计算AGR的具体数值,并采用受试者工作特征曲线(ROC曲线)计算AGR的诊断界值(cut-off值)。ROC曲线下面积为0.657,诊断界值为1.36。因此,患者被分为低(<1.36)或高(≥1.36)AGR 组。
1.3 统计学分析 采用SPSS 21.0统计学软件分析数据,计量资料以均数±标准差()表示,两组间比较用t检验;计数资料用比例表示,两组间比较用χ2检验。采用二元Logistic回归分析确定与术前低AGR值有关的临床特征。采用Kaplan-Meier和log-rank进行生存率的分析。对所有变量进行单变量Logistic回归分析,被证实具有统计学意义的变量再通过多变量Cox回归模型进行进一步分析。P<0.05为差异具有统计学意义。
2 结果
2.1 2组患者的一般临床特征比较 按术前AGR的诊断界值分组;114名患者属于低AGR组(<1.36),155名患者属于高 AGR 组(≥1.36)。2组患者的年龄、性别、肿瘤大小、T分期和术前血红蛋白水平存在显著差异(P<0.05),提示低AGR组患者年龄较大,女性较多,肿瘤体积较大,T分期较晚,术前血红蛋白水平较低。见表1。

表1 2组患者的一般临床特征比较
2.2.低AGR值的相关危险因素分析 二元Logistic回归分析结果显示,女性、高龄、肿瘤体积较大、术前血红蛋白水平较低是低AGR的独立危险因素。见表2。
2.3 生存率影响因素的单变量和多变量Logistic回归分析 中位随访时间为40个月 (范围1~108个月)。在截止日期前有130例患者生存和139例患者死亡。低AGR组和高AGR组的中位生存时间分别为13个月 (95%CI,10.9~15.1)和 17个月(95%CI,13.8~20.2)(P=0.014)。 Kaplan-Meier曲线显示,与高AGR组相比,低AGR组的生存率显著降低。单变量Logistic分析结果显示年龄、肿瘤体积、分化程度、T分期、N分期、TNM分期、术前AGR和血红蛋白水平是预后的影响因素。将上述因素纳入多变量Logistic分析后显示,年龄较大(≥70),N分期较晚,术前AGR较低被确认为生存率差的独立危险因素,见图1、表3。
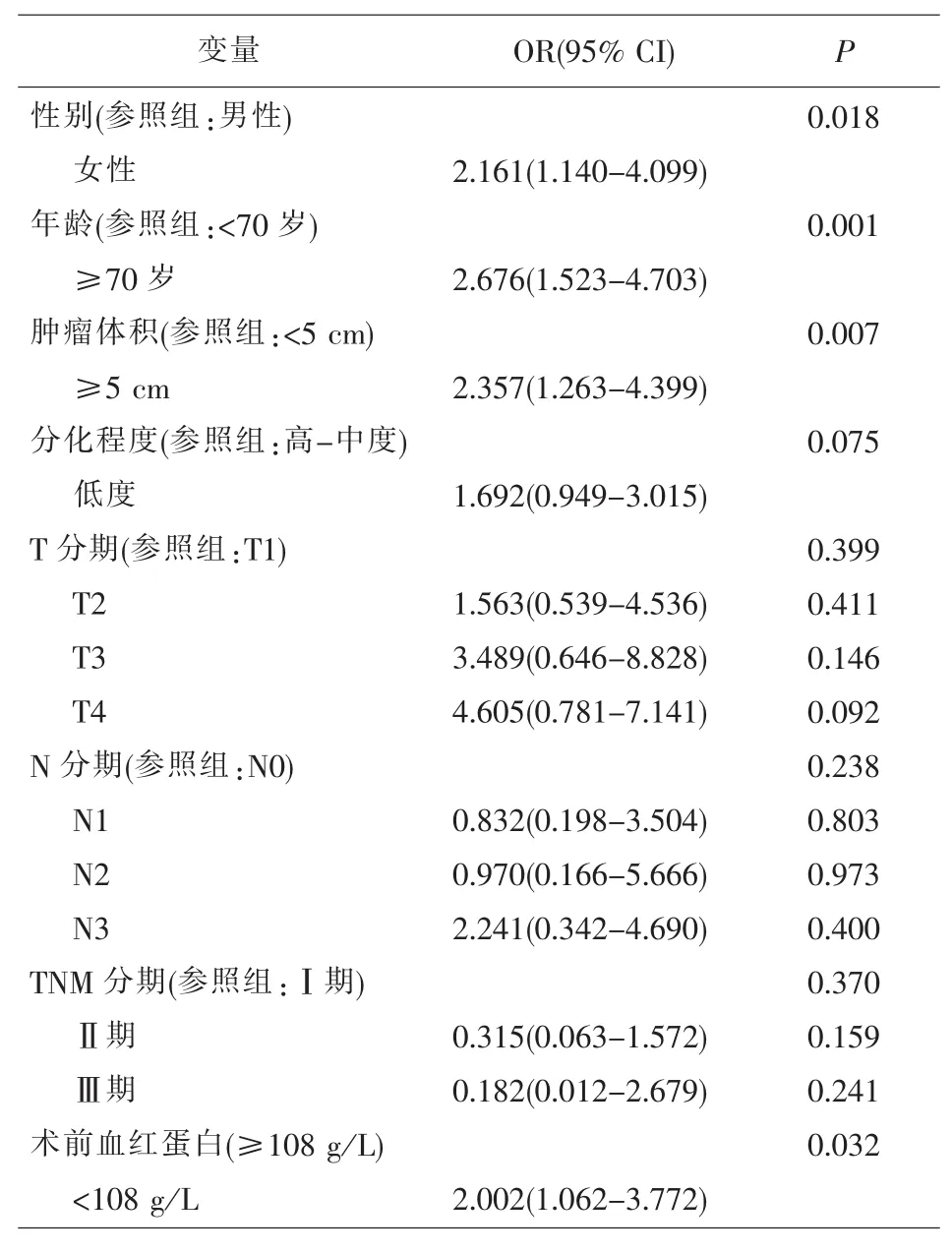
表2 低AGR相关危险因素的二元Logistic回归分析
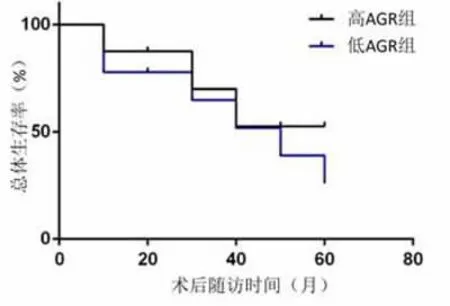
图1 NSCLC患者术后的Kaplan-Meier曲线 (AGR<1.36 vs≥1.36,P=0.014)

表3 生存率影响因素的单变量和多变量Logistic回归分析
3 讨论
以往的很多研究发现,术前AGR是各种癌症的预后的预测因子[9-14],但目前没有研究讨论术前AGR对于NSCLC患者预后的预测价值。因此,需要更多的研究来讨论术前AGR对于NSCLC患者预后的预测价值。
目前临床上普遍采用白蛋白和球蛋白的比值计算AGR。因为它们不仅是血清蛋白的两种主要成分,对于维持血浆渗透压具有重要的意义,而且它们也会受到营养状况和全身性炎症的影响。研究发现,血清白蛋白与肿瘤之间存在密切的相互作用。因此,血清白蛋白水平可以为预测癌症的预后提供重要的信息[5]。首先,因为食欲不佳和吸收不良,恶性肿瘤患者与其他疾病的患者相比较具有更高的低蛋白血症的风险[16]。其次,恶性肿瘤可以诱发全身性炎症,刺激肿瘤细胞和免疫细胞产生细胞因子,如白细胞介素(IL)-1β、IL-6 和肿瘤坏死因子。这些细胞因子具有抑制白蛋白的合成和增加毛细血管的通透性的作用,可以促进白蛋白的损失[5]。第三,白蛋白具有抗氧化功能,可防止脂质、核酸和其他蛋白质的破环[17]。因此,血清白蛋白在稳定DNA复制和抑制癌变中发挥了重要的作用[18]。最后,白蛋白是一种血浆中的多功能蛋白质,可以影响抗癌药物治疗的疗效。最近的研究已经证明,作为一种转运蛋白,白蛋白对人体内有抗癌药物的分布和药理活性具有重要的影响[7]。Gupta等[5]纳入了53篇关于血清白蛋白水平与不同癌症的预后相关性的研究。其中大部分研究的结论是较低的白蛋白水平预示着较差的生存率。
血清球蛋白包含有复杂的成分,包括急性期蛋白、免疫球蛋白、白细胞介素和肿瘤标志物等[19]。以往的研究报道,这些炎症标志物在肿瘤的发生、发展、转移和复发中发挥了重要作用[20]。Chen等[8]的研究结果显示,治疗前低血清球蛋白的胃癌患者预后较好。此外,一些促炎症蛋白质,如C-反应蛋白、α和γ球蛋白、补体C3和IgA具有对各种癌症患者的生存具有负面影响[21-23]。
因此,术前白蛋白和球蛋白水平都可以用于预测恶性肿瘤预后的生物学指标。本文采用了白蛋白与球蛋白的比值作为研究指标是由于以下的优点。首先,AGR包括了2个已确定的预测因子,比单独采用1个预测因子更有说服力。其次,采用AGR作为指标可以避免血液稀释或血液浓缩的影响[14]。但是,采用AGR作为指标仍然无法消除在分析中不需要的球蛋白成分对于结果的干扰。此外,血清白蛋白具有相对稳定的特性,因为它的半衰期约为20d,而血清球蛋白的半衰期各不相同,从几小时到几天。同时测量血清白蛋白和血清球蛋白水平,可能反映无法准确反映不同时期的AGR[24]。
本文结果显示,术前AGR水平受性别、年龄、术前血红蛋白水平和肿瘤大小的影响,提示术前AGR可以对身体状况和肿瘤状态进行全面的评估。这是与Alkan等[16]的研究结果基本一致的。他们的研究结果显示,AGR受到多种因素的影响,提示术前AGR可能不是最精确的预后指标,但它是一种简单而有效的预后的生物学标志物。此外,本结果显示,术前AGR较低是NSCLC患者生存率差的独立危险因素。这是与Suh等[25]的研究结果一致的。他们的研究纳入了26,974例肝癌和恶性血液病患者,结果显示,低AGR患者的预后更差,生存率更低。
综上所述,术前AGR与NSCLC患者的预后密切相关。因此,术前AGR是预测NSCLC患者预后的简单但有效的血清生物标志物。
