ST段抬高型心肌梗死患者PLR和NLR与梗死相关冠状动脉血流通畅状况的关系
2019-11-01刘勇姜东伟
刘勇,姜东伟
(确山县人民医院心血管内科,河南 确山)
ST段抬高型心肌梗死 (ST-segment elevation myocardial infarction,STEMI)由粥样硬化斑块破裂所致的血栓形成和冠状动脉梗塞引起,炎症与血栓形成参与了STEMI发生的病理生理过程[1-3]。以往的研究表明,梗死相关动脉 (infarction-related artery,IRA)血流通畅状况是直接经皮冠状动脉介入(primary percutaneous coronary intervention,pPCI)手术治疗成功与否、心肌梗死患者院内死亡率以及心室功能的重要决定因素[4]。最近的研究提示,血小板淋巴细胞比率(platelet to lymphocyte ratio,PLR)是一种新的炎症指标[5],与包括STEMI在内的许多心血管疾病的预后相关[6-9]。但是,目前国内对PLR与STEMI患者IRA血流状况的关系研究的较少。李少辉等人报道STEMI患者中PLR能够预测pPCI术后IRA无复流现象[10]。在本项研究中,我们的主要目的是分析STEMI患者中PLR是否能够预测pPCR术前IRA的血流状况。
1 研究对象和方法
1.1 研究对象及分组 选取2013年1月至2016年8月河南省确山县人民医院心内科收治的STEMI患者214例,其中男性166例,女性48例,平均年龄57.5±11.8岁。所有患者均符合《急性ST段抬高型心肌梗死诊断和治疗指南》[11]中STEMI的诊断标准。患者排除标准为:1)有陈旧性心肌梗死者;2)合并严重的瓣膜疾病或心肌病等其他心血管疾病者;3)合并恶性肿瘤、急性/慢性感染性疾病、自身免疫病或血液系统疾病者;4)肝肾功能不全者;5)合并慢性阻塞性肺疾病者。根据冠脉造影心肌梗死溶栓治疗 (thrombolysis in myocardial infarction,TIMI)血流分级(0级~3级)将患者分为梗阻组(0级~2级)(138例)和畅通组(3级)(76例)。本回顾性研究经院伦理委员会审核批准。
1.2 研究方法 所有患者入院后立即采集肘前静脉血送检,测定血常规、生化及心肌肌钙蛋白I(cT-nI)等实验室检查指标。采用Judkins法行急诊或择期冠脉造影,由两名共同判定造影结果。次日行超声心动图检查。收集所有患者的基本临床病历资料。统计学分析比较IRA梗阻组和通畅组患者临床资料及医技检查和实验室检查等资料间的差异。
1.3 统计学分析 使用SPSS 13.0统计软件进行统计学分析。Kolmogorov-Smirnov法检验数据正态性。计量资料数据表示为均数±标准差(χ±s),两组间比较采用Student t检验,计数资料间比较采用卡方(χ2)检验。Kendall’s tau-b 法分析 PLR 与 TIMI血流分级之间的相关性;Pearson法分析PLR与cTnI水平之间的相关性。受试者工作特征曲线(receiver-operating characteristics curve,ROC)分析PLR预测IRA梗阻的截断值(cutoff值)。单因素分析具有显著性的参数纳入逐步后退法进行的多因素逻辑回归分析,进而分析IRA梗阻的独立预测因子。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料 IRA梗阻组和通畅组患者之间性别、年龄、高血压、糖尿病、吸烟以及药物的使用等参数差异无统计学意义(P>0.05),两组之间梗死相关动脉的分布差异无统计学意义(P>0.05)。见表1。
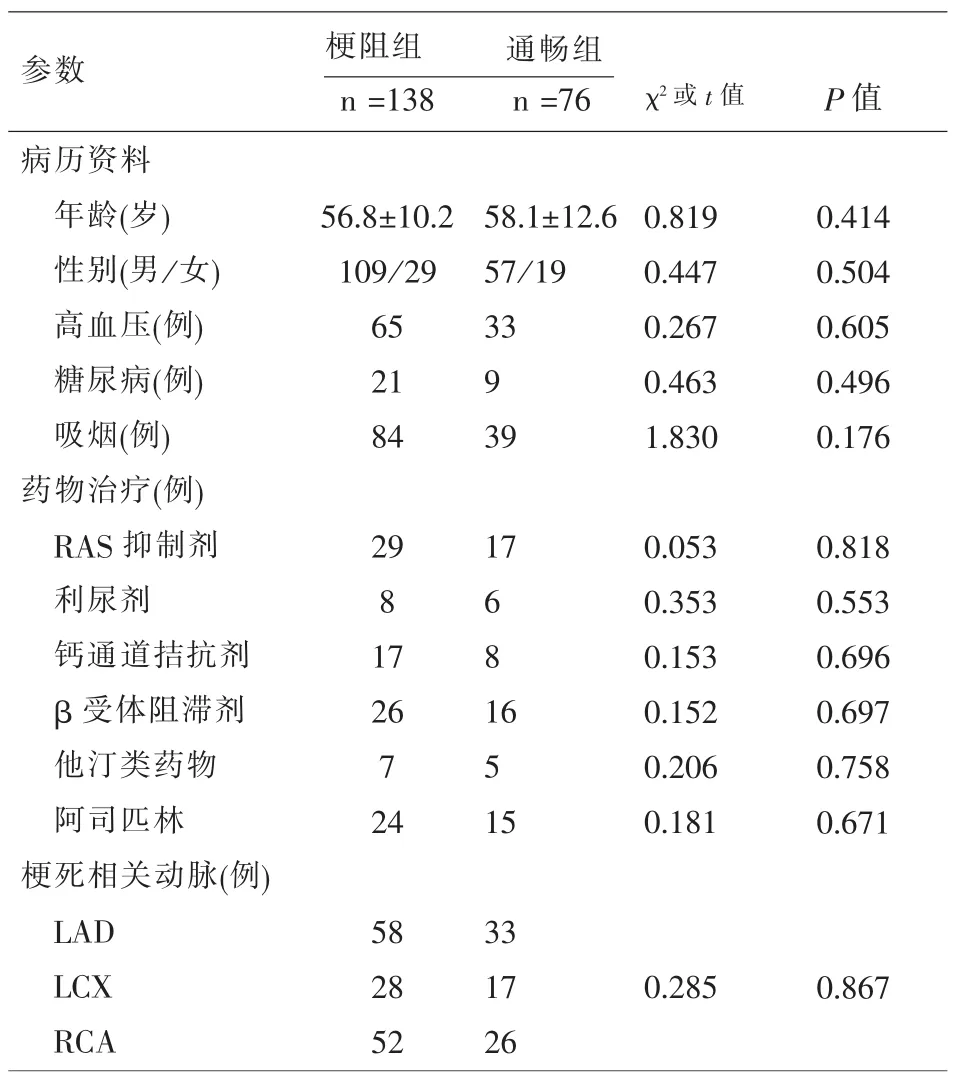
表1 患者基本临床资料
2.2 临床参数比较 患者实验室检查结果,与IRA通畅组患者相比,IRA梗阻组患者血糖及cTnI水平、中性粒细胞计数、中性粒细胞淋巴细胞比率(neutrophil to lymphocyte ratio,NLR)和PLR均较高(P<0.05),而淋巴细胞计数较低(P<0.05)。Kendall’s tau-b相关性分析显示PLR与TIMI血流分级之间呈负相关 (r=-0.364,P<0.001), 见图 1;Pearson相关性分析显示PLR与入院cTnI水平之间呈正相关(r=0.227, P<0.001)。 见表 2。

表2 患者实验室检查数据

图1 血小板淋巴细胞比率与TIMI血流分级的相关性
2.3 预测因子分析 多因素逻辑回归分析显示PLR[Odds Ratio(OR):0.977,95%confidence interval(95%CI):0.955~1.012,P=0.007]和 NLR(OR: 0.906,95%CI: 0.879~0.983, P=0.027)是梗死相关动脉(IRA)血流梗阻的独立预测因子,见表3。ROC分析显示,当PLR>80.5时,PLR预测IRA梗阻的敏感性为76.1%,特异性为61.8%,曲线下面积为0.729(95%CI: 0.656~0.803, P<0.001),见图 2。
3 讨论
冠状动脉血流状况是STEMI患者预后的独立影响因素[12],Stone等人的研究显示,与TIMI 0级至2级的患者相比,TIMI 3级的患者6个月时的预后更好[13]。STEMI患者尽早恢复冠脉TIMI3级血流可以显著降低患者死亡率,改善患者预后[14]。本研究主要分析血小板淋巴细胞比率(PLR)与STEMI患者pPCI术前IRA血流状况的关系,研究结果表明PLR是IRA梗阻状态的独立预测因子。

表3 多因素逻辑回归分析梗死相关动脉通畅状况的独立预测因子

图2 血小板淋巴细胞比率预测梗死相关动脉梗阻的受试者工作曲线
STEMI的起因是冠状动脉粥样硬化斑块破裂,进而导致冠状动脉血栓形成及冠脉阻塞,心肌供血被阻断,引起心肌损伤梗死。引起这种病理生理过程的始发病因机制尚不完全明确。研究表明,炎症参与动脉粥样硬化发生的起始和进展过程[15]。在动脉粥样硬化性血栓形成中炎症也发挥了作用[2]。血小板、白细胞和内皮细胞是参与动脉粥样硬化发生能够中的主要细胞,三者之间相互作用激活自分泌和旁分泌,进而介导白细胞向血管壁迁移。血小板计数、血小板平均体积以及活化血小板释放的可溶性因子也与动脉粥样硬化发生有关。血小板表面分子能介导内皮细胞、白细胞和细胞外基质之间的相互作用,进而影响动脉粥样硬化[16]。例如,CXCL4与CCL5协同作用,抑制中性粒细胞和单核细胞凋亡,调控T细胞和巨噬细胞分化,发挥促进动脉粥样硬化的作用。血小板数量增加能刺激巨核细胞扩增,与纤维蛋白形成复合物,进而促进心肌梗死的发生[17,18]。动脉粥样硬化过程中血小板源衍生物参与血栓的形成与进展[19]。血液中血小板数量在STEMI患者IRA动脉粥样硬化性梗阻中具有重要作用[20],与心肌梗死患者死亡率显著相关[21,22]。淋巴细胞计数减少提示免疫功能下降,与许多心血管疾病的不良预后相关[23,24]。近来的研究表明,高血小板计数及淋巴细胞减少与许多心血管疾病的不良临床结局有关[25,26]。Azab等人研究表明,血小板淋巴细胞比率(PLR)是非STEMI患者长期死亡率的一个独立预测因素[27]。Ugur等人报道高PLR可增加血小板单核细胞聚集形成[28]。Akkaya等人发现高PLR与STEMI患者PCI术后院内不良临床结局和6个月全因死亡率显著相关[29]。此外,Gary等人报道肢体缺血的患者中PLR与炎症指标如C反应蛋白和纤维蛋白原显著相关[30]。
由上述研究可知,(1)STEMI起始于炎症反应和血栓形成的相互作用;(2)血小板和淋巴细胞参与了这一过程;(3)PLR能够预测心血管不良结局。由于冠状动脉血流状况是STEMI患者预后的独立影响因素[12],因此本研究主要评价了STEMI患者pPCI术前IRA血流状况与PLR之间的关系。结果表明pPCI术前IRA梗阻的STEMI患者中PLR显著高于IRA通畅的STEMI患者,因此,高PLR预试STEMI患者IRA血流处于梗阻状态。除此之外,本研究还提示另一个炎症指标中性粒细胞淋巴细胞比率(NLR)也是IRA血流状态的独立预测因素,与以前的研究结论类似[31,32]。
本研究为回顾性单中心研究,样本量小,未能动态监测PLR变化,结果和结论存在一些局限,需要更大样本多中心的前瞻性研究中进一步验证。
