我实验室卫生部临检中心室间质评结果分析
2019-11-01方建华张燕吕永磊
方建华,张燕,吕永磊
(河南省红十字血液中心,河南 郑州 450012)
卫生部临检中心的室间质评是每个血液中心或中心血站必须参加的一项活动,因为参加的实验室之多和样本浓度的多样性而受到全国用户的好评。2017年共计437家实验室参与该室间质评活动,卫生部临检中心对所有室间质评样本均给出了详细的结果,便于我们对比分析,找出问题并及时解决。本实验室多年来一直积极参与卫生部临检中心的室间质评样本的评价活动,酶免参加的项目包括:HBsAg、抗-HCV、抗-HIV、抗-TP。 通过参加室间质评活动,可以更加清楚地认识实验室的血液检测方法的性能及血筛试剂的客观评价[1]。本文就2017年参加卫生部临检中心酶免四项的室间质评结果进行回顾性分析,评价实验室检测系统的性能。
1 资料与方法
1.1 室间质评项目 检测项目包括乙型肝炎表面抗原(HBs Ag)、丙型肝炎抗体(抗-HCV)、梅毒抗体和人类免疫缺陷病毒抗体(抗-HIV)4项传染病免疫学指标。
1.2 标本来源 2017年我实验室共收到三次卫生部临检中心发放的质控样品,均按要求进行保存,实验室完全融化平衡至室温,若有絮状物离心后混匀取上清液进行加样。卫生部临检中心2017年全年共计发放三次室间质评样本,每次5个样本,共计15个样本。标本序号分别为1751~1755、1761~1765、1771~1775。
1.3 试剂、仪器与质控品 乙肝表面抗体检测试剂盒(WT、LZ),丙肝抗体检测试剂盒(WT、KH),人类免疫缺陷病毒抗体检测试剂盒(WT),人类免疫缺陷病毒抗原 /抗体检测试剂盒(BIO-RAD),梅毒抗体检测试剂盒(WT、LZ)。Microlab STAR全自动样本处理系统(瑞士哈美顿),Microlab FAME全自动酶免分析仪(瑞士哈美顿),Sunrise酶标仪(瑞士帝肯),质控品为北京康彻思坦生物技术有限公司提供的酶免四项混合质控品。实验中涉及到的五种厂家的试剂均由汉语拼音缩写字母标示。
1.4 评价方法 验证试验(PT):合格项目数/总项目数×100%=PT得分,PT得分≥80%为合格,PT得分<80%为不合格。对于室间质评的样本,同本实验室的待检标本同时检测,严格按照实验室标准操作规程进行操作,检测结果由检测者填写,最后由专人上报。酶免项目进行两遍检测,分为初检和复检。在收到NCCL的反馈结果后进行分析。
2 结果
2.1 HBV结果 2017年三次室间质评样本中共计有4个阳性样本,其中三个为弱阳性样本,一个为中等强度的阳性标本。三个弱阳性样本有两个已被实验室所用两种酶免试剂检出,但1764号样本两种酶免试剂均显示阴性结果,卫生部临检中心给出1764的浓度为0.05IU/ml,在874份实验结果中仅有11家将此弱阳性标本检出。这提示我们所使用的试剂有一定的漏检风险。见表1。
2.2 HCV结果 2017年三次室间质评样本中共有5个抗-HCV阳性样本,这与本实验室两种酶免试剂的结果一致。但是两种酶免试剂的S/Co与均值存在一定的差异,其中WT试剂的S/Co比均值稍低,而KH试剂的S/Co稍高。见表2。
2.3 HIV的结果 2017年三次室间质评样本中共有4个抗-HIV阳性样本,这与本实验室两种酶免试剂给我的结果一致。但是两种酶免试剂的S/Co与均值相比,均稍低。见表3。

表1 2017年卫生部临检中心HBV反应性标本对比结果
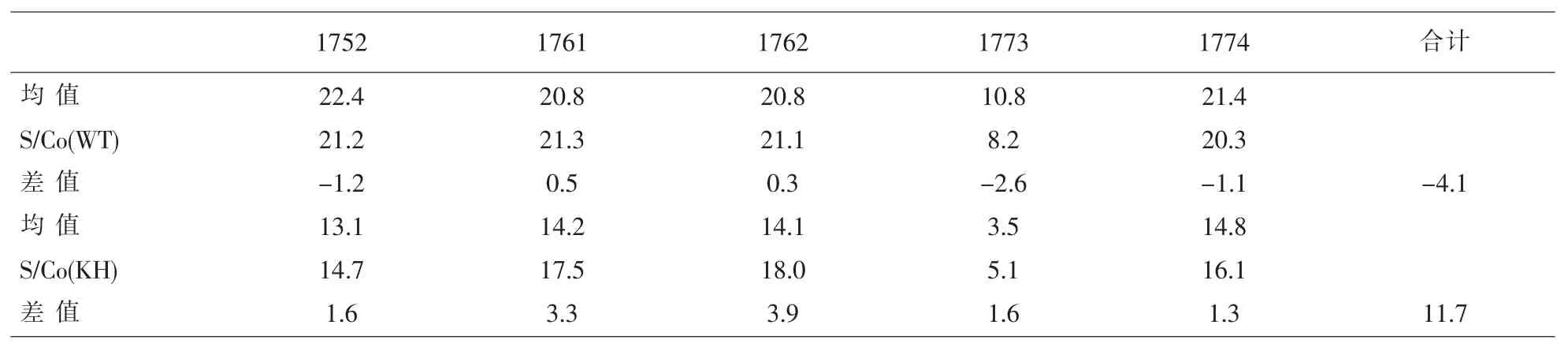
表2 2017年卫生部临检中心HCV反应性标本对比结果

表3 2017年卫生部临检中心HIV反应性标本对比结果
2.4 TP的结果 2017年三次室间质评样本中共有6个抗-TP阳性样本,这与本实验室两种酶免试剂测得的结果一致。这6个阳性样本的S/Co均低于均值。见表4。
在抗-TP的样本中存在一个特殊样本1751,正确检测结果为阴性,本实验所用的两种试剂检出了不同的结果,其中WT试剂检出的为阴性,LZ试剂检出的为阳性,169家使用LZ试剂检出的均值为1.1,我们实验室的S/Co为2.0,这与均值结果一致,由此可见,LZ试剂对于这份标本给出的是生物学假阳性结果。
3 讨论
2013版室间质量评价结果应用指南中规定,能力验证是指多个标本周期性地发送到实验室进行分析和(或)鉴定,将每一实验室的结果与同组的其他实验室的结果或指定值进行比较,并将比较的结果报告给参与的实验室[2]。此指南指出,在每次室间质量评价活动中,实验室应评估评分分布情况。如果所有结果均在可接受结果范围平均值的上方或下方,则可能是校准问题。实验室应评估每个结果与平均值之间的差距。EQA的目的在于评价实验室的检测结果的准确性,确认实验室之间的差异并持续改进检验质量,也是考核实验室间所出具结果是否具有可比性的重要工具之一[3]。

表4 2017年卫生部临检中心TP反应性标本对比结果
2017年我们在参与卫生部临检中心的室间质评活动中,发现了我们实验室存在的两个问题,第一个为个性问题,1764号HBsAg的弱阳性标本,其浓度为0.05IU/ml,由于试剂灵敏度达不到导致漏检,这就提示我们所用的酶免乙肝试剂存在一定的漏检风险,但后经核酸实验室检测,检测结果为HBV DNA阳性,Ct值为24,这就说明核酸检测对弱阳性标本的检出可以和酶免试剂形成互补;第二个问题是共性问题,观察表1至表4,除了丙肝KH试剂,其余7种酶免试剂所做的S/Co值均不同程度的低于均值,这就提示我们实验室存在一定的系统误差。对此,我们专门从实验的关键控制点入手,逐步寻找原因,并请教经验的仪器工程师协助我们调查原因。最终通过观察一年来的室内质控图,特别分析了2017年三次室间质评当天的室内质控图,发现有持续走低的趋势,这就提示我们会有漏检的风险,自2017年底我们调整了酶免试剂室内质控的浓度,使其达到了2015版血站技术操作规程的要求。具体调整效果还有待于分析2018年室间质评的反馈结果。
对于梅毒的LZ试剂显示1751号样本的假反应性结果,这是试剂本身的原因。所谓的生物学假反应性是指针对某一个特定的样品,排除实验室操作原因,使用某种试剂反复检测认为反应性,但该样品经证实为阴性。任何试剂都不可能避免会对某些样品产生生物学假反应性。EQA中,生物学假反应性的特点是在试剂分组中大部分参评实验室都出现假生物反应性情况。几乎每次EQA中均会有生物学假反应性样品,说明日常血液筛查中生物学假反应性的频率比较高。
杨丽华等对7种HBsAg ELISA检测试剂的EQA数据进行分析,发现对于0.5、0.3、0.2IU/ml三个低浓度样本的检测符合率无明显差异,但对于0.1IU/ml的样本的检测表现有明显差异,其中进口检测试剂的符合率明显优于其他试剂[4]。内蒙古血液中心对2015年室间质评样本进行分析,针对同一样本而两种试剂结果不一致的情况,对于出现的偏差,实验室从人员、机器、物料、方法、环境等方面查找原因,进行逐步分析,最终判定为两种试剂的灵敏度不同所致结果不一致[5]。
关于如何做好室间质评样本的评价活动,我认为对样本的处理和结果的分析至关重要,对此,江苏血液中心专门探索了血站病毒核酸检测质评样本混样检测的最佳工作模式,为室间质评样本的评价更加真实可靠提供了一种思路[6]。对于室间质评的低值阳性标本天津市血液中心的王全慧专门进行了调查分析,其中2011年的1175号质评样本国产酶免试剂HBsAg报告为阴性,与全国采供血机构实验室使用此国产试剂报告结果相反,对此他们从人员、机器、物料、方法、环境等各个环节进行了全面分析并逐一排除,最后分析原因可能为人为操作误差[7]。
实验室做室间质评的样品和普通的检测样品一样,从接收开始对样品的状态就有规范详细的记录,样品的前处理非常重要直接影响检测结果的准确性,在检测过程中实验室的温湿度环境控制,仪器的状态,试剂的质量,是否在效期内,室内质控品浓度的选择等因素决定检测结果的准确性,检测后对结果的处理,标本的保存,仪器的维护保养同样重要[8]。
室间质量评价活动的意义,在于有没有分析其用意并对实验室的质量控制提供一些改进[9-10],从而使实验室的能力得到提升。实验室应该参加多种不同的室间质评活动,才能获得更全面的信息,从而掌握整体实验的发展趋势,为提高检测质量,改进检测方法做好准备[11]。
