环介导等温扩增技术在快速病原菌检测中的价值
2019-11-01陈艳玲
陈艳玲
作者单位:253200 山东德州,夏津县人民医院检验科
下呼吸道感染为临床常见感染性疾病,现已成为导致人类死亡的四大原因之一。世界卫生组织(World Health Organization,WHO)2013 年统计报告显示,世界病死率最高的十大疾病死因中,下呼吸道感染位列冠心病和中风之后的第3 位(5.9%),而位于第4 位的慢性阻塞性肺疾病(5.4%)死亡也与感染有一定相关性,呼吸道致病菌感染居各类致病菌感染之首[1-2]。传统细菌培养和细菌学检验技术不能为临床提供快速准确的诊断结果,导致下呼吸道感染患者未得到及时准确的治疗,病死率常年居高不下,而此时继聚合酶链反应(polymerase chain reaction,PCR)技术发展之后的环介导等温扩增技术(loop mediated isothermal amplification,LAMP)在一定程度上弥补了传统细菌培养的不足,其中晶芯呼吸道病原菌核酸检测试剂盒采用LAMP 技术,可定性检测痰液标本中13 种临床常见下呼吸道病原菌。截至目前,LAMP 技术已广泛应用于诸多领域,成为许多地区临床检测的常用方法[3]。本研究对下呼吸道感染患者的痰液标本进行LAMP 检测和传统细菌培养,检测呼吸道致病菌菌种,比较两种方法的差异,分析评价LAMP 检测下呼吸道病原菌的效果。
1 材料与方法
1.1 标本来源 收集本院2017 年2 月—2018 年10 月366 例下呼吸道感染患者的痰液标本。
1.2 仪器与试剂 采用晶芯呼吸道病原菌核酸检测试剂盒(LAMP 技术)和RtisochipTM-A 等温扩增微流控芯片核酸分析仪(博奥生物集团有限公司);采用VITEK 2 Compact 细菌鉴定仪、血平板、麦康凯平板(法国生物梅里埃公司)和加万古霉素的巧克力平板(安图生物公司);革兰染色试剂(珠海贝索生物技术有限公司)。
1.3 检测方法
1.3.1 合格痰标本初筛 用无菌接种钩挑取送检痰液黏液、脓性部分,革兰染色后低倍镜视野(low power lens,LP)下镜检,多形核白细胞>25/LP、鳞状上皮细胞<10/LP 的合格痰液标本纳入研究。
1.3.2 痰培养 选适量脓性或无血部位合格痰标本接种于血平板、加万古霉素巧克力平板和麦康凯平板,5%~10%二氧化碳(CO2)培养箱35 ℃培养24 h或48 h,观察培养情况,筛选可疑致病菌进行鉴定。
1.3.3 LAMP 病原菌检测 利用晶芯呼吸道病原菌核酸检测试剂盒检测,采用LAMP 技术在微流控蝶式芯片上进行反应,DNA 在一定温度下(60 ℃~65 ℃)处于动态平衡状态,利用DNA 聚合酶的链置换功能,使DNA 在等温下不断复制扩增,完成模板DNA 的合成、循环扩增、伸长和再循环,根据扩增曲线判读结果。
1.3.4 结果判定 呼吸道病原菌核酸检测完成后,软件采用最大二阶导数法结合其他算法找出“S 型”扩增曲线进入快速扩增期的第1 个拐点,将拐点对应时刻与原点时刻的差值作为时刻差值(Tp 值),本试剂盒采用ROC 法计算得到每种病原菌的阳性判断值,根据Tp 值并结合阳性判断值进行结果判读。当病原菌Tp 值≤阳性判断值时结果判定为阳性,当病原菌Tp 值>阳性判断值时结果判定为阴性。归一化曲线在“荧光曲线区域”显示,质控结果和各指标检测结果在“检测结果区域”显示。
1.3.5 统计学方法 应用SPSS 17.0 统计软件进行数据分析,计数资料以率或构成比表示,两两比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 痰培养结果 366 份痰液标本中,痰培养检出阳性标本72 份(阳性率为19.7%)。共检出108 株致病菌株,其中革兰阴性(G-)杆菌为86 株(占79.6%),革兰阳性(G+)球菌22 株(占20.4%),未检出嗜麦芽窄食单胞菌和肺炎支原体。见表1。

表1 72 份痰培养阳性标本的病原菌检出情况
2.2 LAMP 检测结果 366 份痰液标本中,LAMP 检出阳性标本175 份(阳性率为47.8%),其中单一致病菌感染149 份,2 种及以上致病菌混合感染26 份。共检出236 株致病菌株,其中G-杆菌168 株(占71.2%),G+球菌68 株(占28.8%),未检出嗜麦芽窄食单胞菌和肺炎支原体。见表2。
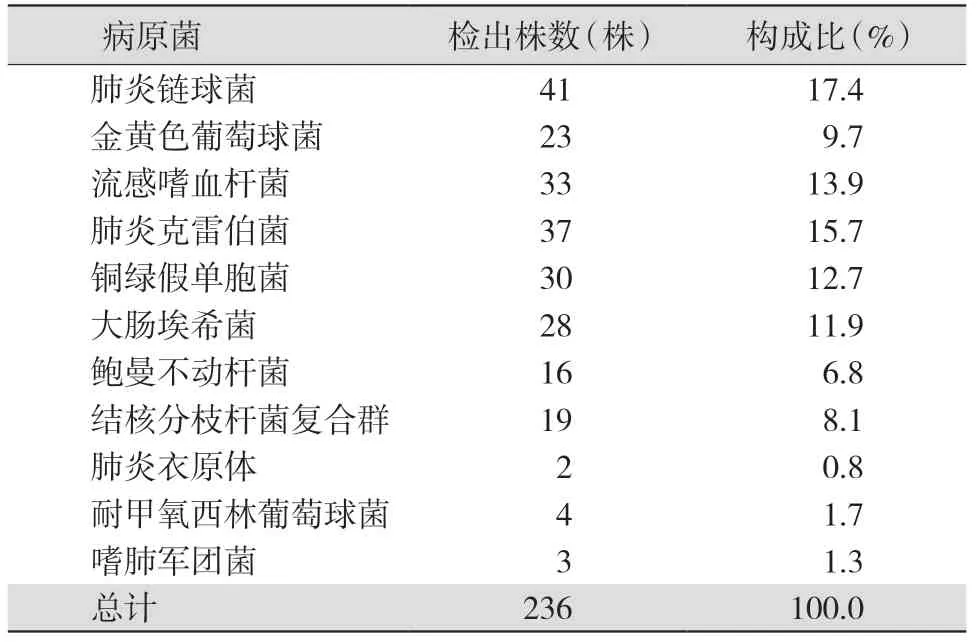
表2 175 份LAMP 阳性标本的病原菌检出情况
2.3 两种方法结果比较 LAMP 阳性检出率明显高于痰培养(47.8%比19.7%;χ2=64.826,P<0.01)。
3 讨论
WHO 2013 年统计报告显示,各种感染性疾病仍严重危害人类健康,占全球死亡人数的1/3,其中呼吸道感染居各类感染性疾病之首。下呼吸道感染主要包括社区获得性肺炎(community acquired pneumonia,CAP)、慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease aecopd,AECOPD)、支气管扩张合并感染等[4]。由于抗菌药物在临床的使用频率越来越高,菌株耐药性也逐渐增加,导致院内感染情况愈加严重,尤以铜绿假单胞菌、肠球菌和不动杆菌感染为甚[5]。传统细菌培养在检测敏感性和检测周期等方面难以满足下呼吸道感染的治疗要求。本研究采用等温扩增芯片法,基于LAMP 原理检测常见下呼吸道病原体(包括肺炎链球菌、金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、耐甲氧西林葡萄球菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、流感嗜血杆菌、大肠埃希菌、嗜肺军团菌、结核分枝杆菌复合群、肺炎支原体和肺炎衣原体)。LAMP 从痰液标本的最初处理至报告发放全程仅需2~3 h,检测时间较传统痰培养明显缩短。吴晓睛等[6]研究显示,LAMP 技术具有较高的灵敏度,检测结果与痰培养有较高的一致性。
结核病是结核分枝杆菌侵入人体后引起的消耗性疾病,有强烈传染性,主要经空气-呼吸道、食物和垂直传染,目前以肺结核最为多见,90%肺结核通过呼吸道传染。近几年结核病的发病率有所增长,据WHO 报道,每年约有800 万新病例产生,至少有300 万人死于结核病。本研究显示,LAMP 共检出结核分枝杆菌19 株,检测时间仅需2~3 h,众所周知,传统结核分枝杆菌培养需2~3 周,二者相比,前者从很大程度上缩短了检测时间,本研究未涉及痰结核分枝杆菌的培养。但郗志华[7]研究表明,LAMP 对结核分枝杆菌检测有重要的临床价值,LAMP 阳性率(77.8%)较涂片抗酸染色法(52.78%)明显升高(P<0.05),其中涂阳培养的LAMP 阳性率为99.73%,涂阴培养的LAMP 阳性率为58.82%。刘毅等[8]研究显示,LAMP 检测结核分枝杆菌的敏感性和特异性较高,操作简便易行,结果快速准确,且不需要昂贵的检验设备,值得基层医院推广应用。
本研究未检出肺炎支原体和嗜麦芽窄食单胞菌,林牧等[9]研究显示,LAMP 具有特异性强、稳定性高、检测快速的特点,能快速准确地检出肺炎支原体,具有较好的推广应用前景。郭旭光等[10]研究显示,采用实时荧光LAMP 检测嗜麦芽窄食单胞菌的稳定性高、特异性强、反应速度快,临床应用价值较高。根据呼吸道感染病原菌检测结果指导临床合理应用抗菌药物,可准确及时地治疗呼吸道感染患者[11-12]。本研究痰培养共检出2株肠球菌,林牧等[9]痰培养共检出7 例阴沟肠杆菌,而LAMP 由于试剂盒的局限性不能检出上述两种细菌。但LAMP 对肺炎衣原体、结核分枝杆菌及嗜肺军团菌的检出率较高,这是痰培养无法比拟的,与文献[12]一致。
综上所述,LAMP 会进一步向更快速、简便、特异、可现场检测、检出病原菌种类更多的方向发展,不仅能快速准确地检出传统呼吸道病原菌,还能检出肺炎支原体、肺炎衣原体和嗜肺军团菌等细菌培养难以检出的病原菌,可广泛应用于基层医院。当然,由于试剂盒的局限性,LAMP 还无法检出某些不常见的下呼吸道感染病原菌。两种检测方法联合应用能为临床提供准确、可靠、及时的诊断依据。
