玛咖水溶性成分的抗疲劳活性研究
2019-10-31孙清瑞张连富
李 婧,孙清瑞,张连富*,2
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 国家功能食品工程技术研究中心,江苏 无锡 214122)
体力疲劳可以定义为运动导致的无法完成原来所从事的正常活动或工作能力[1]。高强度的体力运动会扰乱身体体内平衡、引起肌肉损伤、影响生理功能,从而使身体产生疲劳。长期疲劳属于一种亚健康状态,若不及时缓解疲劳,则会产生生理上或者心理上的疾病。所以借助补充具有抗疲劳功效的保健品和药品来缓解疲劳状态显得格外重要。由于化学性药品具有一定的副作用,故对具有抗疲劳作用的天然食物和中药进行研究尤为重要。近年来,苦荞麦蛋白、绿茶多糖、姜黄素、人参皂苷-Rb1等物质的抗疲劳活性得到了证实[1-4]。玛咖(Lepidium meyeniiWalp.)为十字花科(Brassicaceae)独行菜属(Lepidium)一年或两年生草本植物,原产于秘鲁海拔3 500 m以上的安第斯山脉[5]。早在1653年,玛咖的药用功能就有所记载[6]。传统上,玛咖就被用于增强体力、提高生育力以及改善性功能[7]。自2002年引种到中国以来,玛咖已经在云南和新疆地区成功种植。传统上,玛咖就被用于增强体力和缓解疲劳。近年来的科学研究也证实了玛咖具有抗疲劳功效。已有报道发现玛咖脂提物可以增强运动耐力归功于其中的玛咖酰胺[8-9]。苄基芥子油苷(BG)是玛咖中的一种标志性成分,约占玛咖总芥子油苷的80%~90%[10]。虽然玛咖水提物的主要成分玛咖多糖(MPS)和苄基芥子油苷(BG)的抗疲劳功效已有报道[11-12],但是对于MPS、BG和玛咖水提物之间的抗疲劳功效关系以及可能的作用机制的研究仍是空白。作者旨在研究玛咖水溶性成分MPS和BG的抗疲劳功效,以及对其可能的作用机制进行探讨。
1 材料与方法
1.1 主要材料与试剂
玛咖干片:新鲜黄玛咖(云南丽江产)经蒸汽灭酶、切片、60℃烘干处理后得到。
甲醇、苯酚、浓硫酸、Na2HPO4、NaH2PO4、三氯甲烷、正丁醇、无水乙醇、NaCl、TFA均为分析纯,购于国药集团化学试剂有限公司。
用于液相色谱的甲醇为色谱纯,购于国药集团化学试剂有限公司。
BLA、BUN、MDA、SOD、LDH 和 LG 测定试剂盒均购于南京建成生物工程研究所。
红景天提取物由宝鸡方晟生物开发有限公司提供,红景天苷含量大于6%。
1.2 主要仪器与设备
Waters 1525型液相色谱,美国Waters公司;Waters2998二极管阵列检测器,美国Waters公司;HFU-586超低温冰箱,美国热电公司;M5酶标仪,美国Molecular Devices公司;UV-2802紫外分光光度计,尤尼柯(上海)仪器有限公;DF-101S集热式磁力加热搅拌器,常州迈科仪器有限公司;GZXGF101-3-BS-II电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;ZKXFB-1真空干燥箱,金坛市华龙实验仪器厂;TGL-16D冷冻高速离心机,金坛市华龙实验仪器厂;FE20 pH计,梅特勒-托利多仪器(上海)有限公司;RV06ML1-B旋转蒸发仪,广州仪科实验室技术有限公司;SHB-III循环水式多用真空泵,郑州长城科工贸易有限公司;Alpha 1-2 LD plus冷冻干燥机,德国CHRIST公司。
1.3 灌胃样品准备
玛咖水提物:灭酶玛咖干片磨成粉后,用1∶40(m∶V)的去离子水在80℃下提取2 h。提取液过滤、离心除去滤渣后,冷冻干燥得到黄色固体。水提物中的BG含量按照本实验室建立的方法[13]测定为11 g/kg,多糖质量分数根据苯酚-硫酸法测定为253 g/kg。
苄基芥子油苷:将新鲜玛咖经灭酶、干燥、磨粉后通过70%甲醇提取、酸性氧化铝柱层析、制备液相分离后得到了BG,经LC-MS和NMR确定其纯度为98.3%。
玛咖多糖:将玛咖干粉用蒸馏水提取、中温淀粉酶和糖化酶酶解、Sevag法除蛋白、醇沉、DEAE-52纤维素柱层析、透析、冷冻干燥后得到白色固体,测定其多糖质量分数大于95%。
1.4 试验动物和分组
160只4周龄昆明小鼠饲养于EVC鼠笼中(每笼5只),提供充足的水和饲料,饲养环境控制在温度(22±1)℃、湿度 50%~60%、12 h光照/黑暗。 动物试验设计和操作流程均已通过试验动物伦理审核和江南大学实验动物中心批准。
经过1个星期的适应期,称量小鼠体重,160只小鼠随机分成8组(每组20只)。第1组:空白对照(生理盐水);第2组:MPS高剂量组(剂量100 mg/kg·d);第 3 组:MPS 低剂量组(剂量 20 mg/kg·d);第 4 组:BG 高剂量组(剂量 5 mg/kg·d);第 5 组:BG低剂量组(剂量1 mg/kg·d);第6组:玛咖水提物组(剂量 100 mg/kg·d); 第 7 组:MPS+BG (剂量 25.3 mg/kg·d MPS+1.1 mg/kg·d BG);第 8 组:阳性对照组(红景天提取物500 mg/kg·d)。灌胃时间为每天15:00,连续灌胃30 d。每周对小鼠进行不负重游泳训练一次,每次10 min,观察其是否有异常现象。
1.5 负重游泳试验
灌胃30 d后,每组各取10只小鼠,称量每只小鼠体重后进行负重游泳试验。每只小鼠尾部绑上质量为其体重的7%的铁丝后,将其放入自制游泳箱中(深度 35 cm,(25±1) ℃)负重游泳,当小鼠力竭时记录此时的时间,力竭的判定标准是小鼠头部沉入水面7 s不能上浮。
1.6 小鼠待测组织的采集与制备
将每组剩余的10只小鼠放入游泳箱,让其不负重游泳90 min,结束后立即将小鼠用乙醚麻醉后,摘眼球取血,脱颈椎处死,解剖后取出肝脏,将肝脏立即放置于-80℃冰箱中待用。待全血凝固后4℃、8 000 r/min离心5 min,取血清储藏于4℃下待用。
1.7 生化指标检测
BLA、BUN、MDA、SOD、LDH 和 LG 按照试剂盒说明书的方法测定。
1.8 数据的统计学分析
所有结果按照平均值±标准差表示,数据经SPSS 16.0软件进行单重比较和Duncan检验方法,以P<0.05为显著。用a、b、c等不同的字母表示其存在显著性差异。
2 结果
2.1 小鼠体重
灌胃前后各小组小鼠的平均质量见图1。
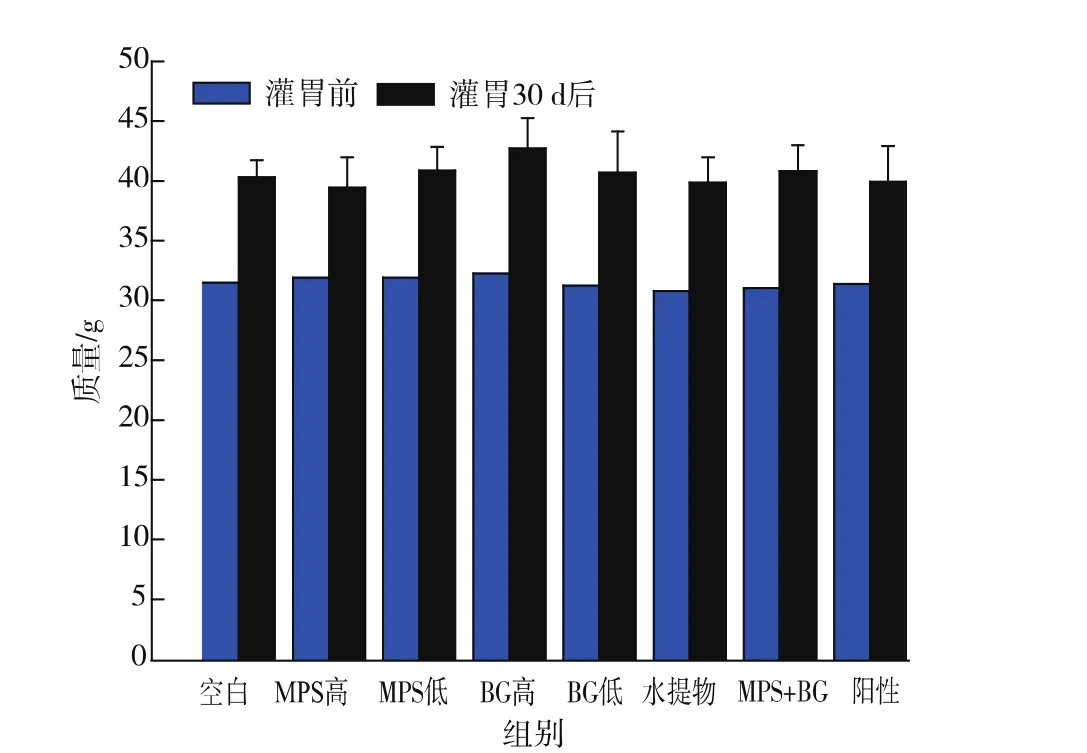
图1 灌胃前后各组小鼠的平均质量Fig.1 Body weight of the mice on the 0th and 30th day of the period of gavage
2.2 负重游泳
运动耐力是评价抗疲劳功能的直观指标,通常利用负重游泳动物模型对其进行评估,小鼠和大鼠均为常用的动物模型。本试验采用负重游泳小鼠模型,测定其负重游泳力竭时间。如图2所示,各试验组和阳性对照组的小鼠负重游泳力竭时间均显著高于空白组。MPS高剂量组、MPS低剂量组、BG高剂量组、BG低剂量组的力竭时间比空白组分别增加了140%、63%、121%和62%。MPS高剂量组的力竭时间显著高于MPS低剂量组,这说明MPS对小鼠负重游泳力竭时间有显著的剂量效应,同样地,BG也有明显的剂量效应。各试验组的游泳时间与阳性对照组相比,MPS高剂量组与阳性对照组相比无显著性差异,其余组均显著低于阳性对照组。水提物组和MPS+BG组的游泳时间没有显著性差异。结果表明:各试验组均能增强负重游泳小鼠的运动耐力,其中MPS高剂量组效果最好,与阳性对照组效果相当。

图2 各灌胃剂量对小鼠负重游泳力竭时间的影响Fig.2 Effects of different supplementation on forced swimming test in mice
2.3 生化指标
体力疲劳主要是由有害代谢产物的生成和累积、能量供应不足、氧化-抗氧化系统的平衡紊乱等因素造成的[3]。基于导致疲劳的因素,本节选择了BLA、LDH、MDA、SOD、BUN 和 LG 这几项有关疲劳的代表性指标进行了测定。
2.3.1 血乳酸(BLA) 有害代谢产物的累积是造成疲劳的重要因素之一。BLA是碳水化合物在体内酸性条件下的糖酵解产物,是导致疲劳的代谢产物之一,也是评价疲劳水平的重要指标[14]。乳酸或其对应的pH值在快肌纤维上的变化是导致肌肉损伤的重要因素[15]。过度的乳酸堆积会侵害体内组织,产生疲劳。所以若一种物质可以抑制乳酸堆积和加速乳酸清除率,则可以判定其有抗疲劳功效。如图3所示,与空白组相比MPS和BG都能显著降低小鼠的BLA水平,并具有一定的剂量效应。其中BG高剂量组在试验组中效果最好,其中的BLA含量比空白组降低了34%,跟阳性对照组的效果相比无显著性差异。水提物组和MPS+BG组的BLA含量无显著性差异。
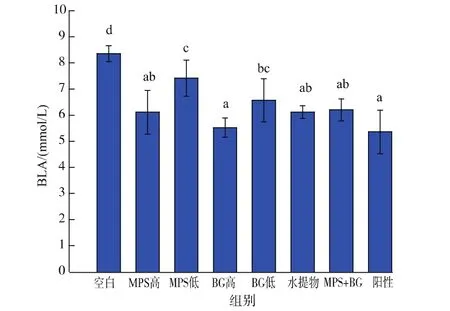
图3 各灌胃剂量对负重游泳小鼠BLA的影响Fig.3 Effects of different supplementation on BLA in mice
2.3.2 乳酸脱氢酶活力 (LDH) LDH可以反映出肌肉的活力,LDH活力影响着乳酸的形成以及乳酸在不同肌肉纤维之间的传递[15]。血清中LDH活力的升高表明肌肉已经受损或者正在受损[16],而这些损伤就会降低负重游泳小鼠的运动耐力,直观体现就在于力竭游泳时间。如图4所示,各试验组的LDH活力均显著低于空白组,其中MPS高剂量组和BG高剂量组相对较低,比空白组分别降低了37%和33%,与阳性对照组基本相当。由此可知,MPS和BG对减小负重游泳小鼠的肌肉损伤都有显著效果且存在显著的剂量效应。水提物组和MPS+BG组的LDH活力没有显著性差异。
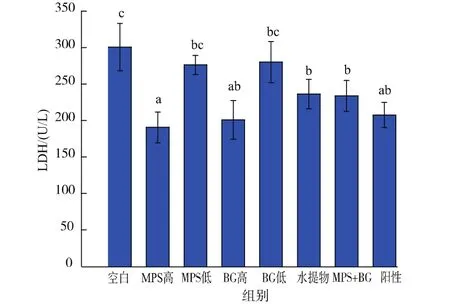
图4 各灌胃剂量对负重游泳小鼠LDH活力的影响Fig.4 Effects of different supplementation on LDH activity in mice
2.3.3 丙二醛(MDA) MDA是油脂氧化的一种终极产物,当机体产生疲劳时,它的含量就会升高[17]。从图5可以看出,各试验组的MDA含量与空白组相比均无著性差异,且均显著高于阳性对照组。结果表明:MPS和BG对负重游泳小鼠体内的MDA水平无显著影响。

图5 各灌胃剂量对负重游泳小鼠MDA的影响Fig.5 Effects of different supplementation on MDA in mice
2.3.4 超氧化物歧化酶活力(SOD) 前人研究表明高强度的运动会扰乱体内的抗氧化系统,而脂质的过氧化会影响细胞膜的流动性从而阻碍蛋白质等营养物质的传输,影响肌肉细胞的正常运作,导致疲劳产生[4,18]。而SOD活力反映了体内的抗氧化水平,所以通过测定SOD活力可以判定疲劳程度。从图6可以看出,各实验组的SOD活力与空白组相比都没有显著性差异,且均显著低于阳性对照组。结果表明:MPS和BG对负重游泳小鼠体内的SOD活力无显著影响。
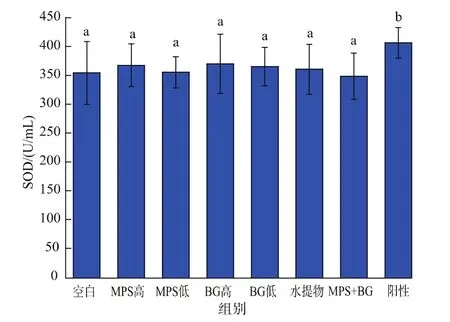
图6 各灌胃剂量对负重游泳小鼠SOD活力的影响Fig.6 Effects of different supplementation on SOD activity in mice
2.3.5 血尿素氮 (BUN) BUN是蛋白质和氨基酸的代谢产物,如果体内缺乏能量,蛋白质才会分解,从而导致体内BUN含量增加[19]。BUN也是疲劳的重要指标,当剧烈运动过后,BUN水平越高说明疲劳程度越大。如图7所示,与空白组相比各试验组的BUN含量都有显著性降低,其中MPS高剂量组的效果最好,其含量比阳性对照组还要低19%,其余试验组均略微高于阳性对照组。MPS的剂量效应显著,而BG的剂量效应不显著。水提物组和MPS+BG组的BUN含量没有显著性差异。

图7 各灌胃剂量对负重游泳小鼠BUN的影响Fig.7 Effects of different supplementation on BUN in mice
2.3.5 肝糖原(LG) 众所周知,在运动过程中能量供应不足会导致体力疲劳,若供能不足运动耐受力就会下降。运动所需的能量首先由肌糖原分解供给,当肌糖原消耗完毕之后由肝糖原补给能量[20]。换而言之,高LG储备可以延缓疲劳。所以,LG含量也是跟疲劳相关的一项重要指标。从图8可知,MPS高剂量组的LG含量组相比空白组显著提高了65%,比阳性对照组提高了25%,而其他试验组中小鼠的LG含量均略高于空白组且低于阳性对照组。在增加小鼠LG储备方面,MPS具有显著的剂量效应,BG的剂量效应不显著。与之前的指标相似,水提物组和MPS+BG组的LG含量也无显著性差异。BUN和LG作为与能量代谢相关的两个重要指标,对比其测定结果可以看出,较高的LG含量对应的BUN含量较低。MPS在BUN和LG两个指标的作用效果均显著优于BG和红景天阳性对照物,由此可以推断MPS是玛咖水溶物提高能量储备的主要作用物质。
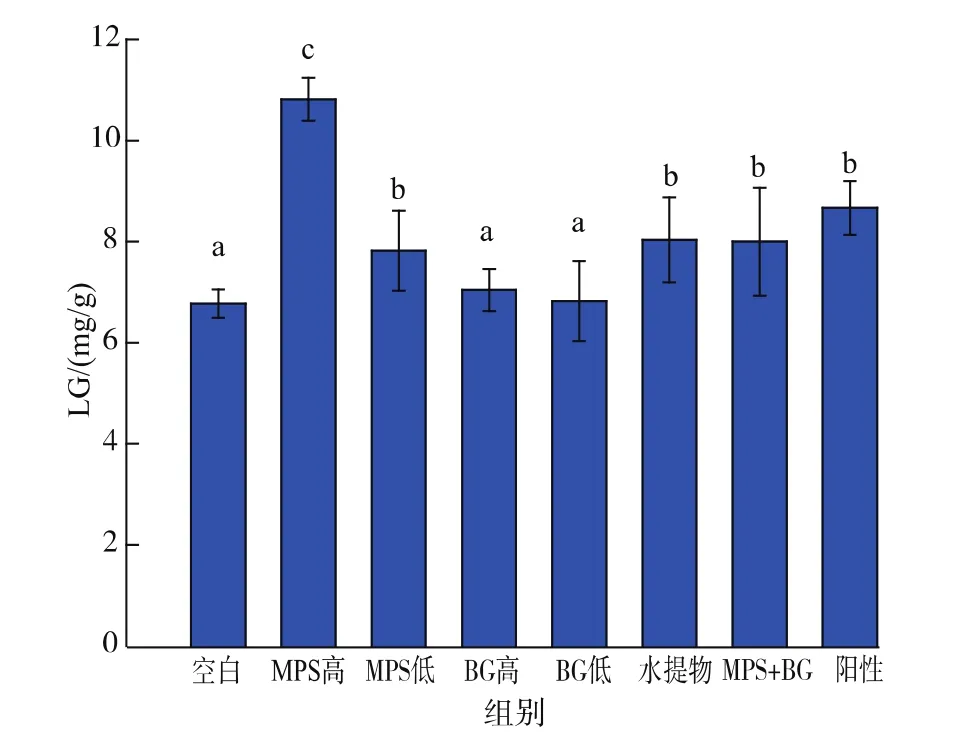
图8 各灌胃剂量对负重游泳小鼠LG的影响Fig.8 Effects of different supplementation on LG in mice
3 讨论
抗疲劳物质的作用机制主要有加速致疲劳代谢产物的清除速率、增强机体对自由基的清除能力和抗氧化能力、提高LG储备等。Mayumi等[12]研究发现BG可以通过提高脂肪酸作为能量的利用率,从而增强负重游泳小鼠的运动耐受力。而本研究还发现:MPS和BG均可以降低致疲劳代谢产物BLA的堆积,并有一定的剂量效应;MPS对储备能量LG的积累有显著的效果。沈维治等[21]通过给小鼠灌胃玛咖粉(3 种剂量:1.0、0.3、0.03 mg/kg·d)证实了玛咖的抗疲劳功效,并提出了MPS可能通过提高机体SOD活力、降低MDA含量、减少自由基的堆积、加速体内脂质过氧化物从而达到抗疲劳的效果的猜测。而本试验结果显示各组的该两种指标均无显著性差异,表明MPS和BG不能通过提高体内抗氧化活力而达到抗疲劳效果。玛咖水提物组和MPS+BG组的各指标均没有显著性差异,玛咖水提物组的剂量为 100 mg/kg·d,MPS+BG组的剂量为 25.3 mg/kg·d MPS+1.1 mg/kg·d BG, 此剂量设置基于本试验所用的玛咖水提物中MPS和BG的含量分别为25.3%和1.1%,由此能够确定玛咖水提物中的主要作用成分为MPS和BG。
结合抗疲劳活性物质的作用机制和本试验结果可知:玛咖的抗疲劳作用主要是通过减少乳酸堆积和增加肝糖原储备来实现的,BG和MPS都具有减少乳酸堆积的作用,MPS在提高负重游泳小鼠的肝糖原储备的作用显著优于BG,MPS是玛咖水溶物提高肝糖原储备的主要作用物质。本文虽然对BG和MPS的抗疲劳活性进行了研究,但是有关分子层面的抗疲劳机理仍需进一步探讨。
