2-甲氧基雌二醇对骨肉瘤MG63细胞增殖和凋亡的影响及其机制研究
2019-10-31陶海汤小燕陶凤华赵迎春金林蔡林
陶海 汤小燕 陶凤华 赵迎春 金林 蔡林
骨肉瘤是儿童和青少年中最常见的恶性原发性骨肿瘤,在过去的几十年里,尽管增加了化疗药物的剂量、改变药物使用时间及使用多药物联合化疗,但骨肉瘤患者的生存率并没有得到实质性的提高[1]。2-甲氧基雌二醇(2-ME)是雌二醇在人体内的正常代谢产物,对肿瘤细胞有一定的选择性杀伤作用,而对正常细胞则无毒副作用[2]。2-ME 抗肿瘤作用得到了国内外学者的广泛研究,被认为是一种前景广阔的抗癌药物[3]。但2-ME 对骨肉瘤的抗肿瘤效应研究非常少见,不够深入。本研究通过对骨肉瘤MG63 细胞增殖和凋亡的影响及其机制研究,为2-ME 在临床抗骨肉瘤的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
人骨肉瘤细胞系MG63 从武汉大学人民医院中心实验室获得。2-ME 和FITC-Annexin V/PI 试剂盒由美国Sigma公司生产,鼠抗人Bcl-2、VEGF、Caspase-3 单克隆抗体由美国Gibco 公司生产,PCR 试剂盒及引物由美国Invitrogen公司生产,MTT 试剂由北京华美生物工程有限公司生产。
1.2 实验方法
1.2.1 细胞培养
用含有10%胎牛血清、50 mg/mL 链霉素、50 IU 的RPMI1640 培养基中培养骨肉瘤MG63 细胞,在条件为37℃、5%CO2的培养箱中进行培养。定期更换细胞培养液,细胞传代。
1.2.2 实验分组及给药
将对数生长期的骨肉瘤MG63 细胞随机分为4 组,分别为对照组(DMSO,0.5%)、10 mol/L 2-ME、20 2-ME、40 mol/L 2-ME。
1.2.3 细胞形态学观察
将对数生长期的骨肉瘤MG63 细胞接种于培养瓶,分别加入10 mol/L、20 mol/L、40 mol/L 的2-ME,分别处理24 h、36 h、48 h 后,在倒置光学显微镜下对细胞的形态进行观察,并挑选随机视野拍照。
1.2.4 MTT 实验
取对数生长期骨肉瘤MG63 细胞,以5×105个/mL 的终浓度接种于24 孔培养板,分别加入0、10、20、40 mol/L的2-ME,培养24 h 后加入MTT 液(5 mg/mL),加入二甲基亚砜(DMSO)200 L,用自动酶标仪于波长492 nm 测光密度(A)值,按公式计算细胞生长抑制率,实验数据为6 次独立实验结果的平均值。
抑制率(%)=(1-实验组A 值/对照组A 值)×100%。
再取MG63 细胞接种于24 孔培养板,20 mol/L 的浓度的2-ME 作用后,培养时间分别为24 h、36 h、48 h,检测方法同上,设置6 个重复孔。
1.2.5 细胞周期检测
用对数生长期细胞含量为106个细胞/mL 细胞悬液,加入到96 孔培养板的每个孔中,将以上细胞悬液随机分为4个小组:0、10、20、40 mol/L,培养基中加入2-ME,放置2 d 后,通过加入胰蛋白酶至每个样品,静置1 d。收集细胞样品并加入RNase A 30 min,用流式细胞仪检测细胞周期。
1.2.6 细胞凋亡检测
将骨肉瘤MG63 细胞接种在96 孔板上,细胞数为3×105个细胞/孔,添加不同浓度的2-ME(0、10、20、40 mol/L),在药物作用24 h 后,用胰蛋白酶消化细胞,加入凋亡试剂盒缓冲液,膜联蛋白V-FITC 单染色,根据说明调试仪器进行PI 单染色。Annexin V-FITC 5 L 加入到Annexin V-FITC单染色所有对照组和试验组,静置15 min 即可上流式细胞仪检测细胞凋亡。
1.2.7 Western Blot 实验
用2-ME(0、10、20、40 mol/L)处理对数生长期的MG63 细胞,在含有蛋白酶抑制剂的裂解缓冲液中裂解细胞来制备细胞提取物。使用BCA 蛋白质试剂盒检测,加载等量的蛋白质,利用SDS-PAGE 分离蛋白,然后转移到PVDF膜上。在室温下封闭1 h 后,将膜与一抗孵育,4℃孵育过夜,用含0.1%的磷酸盐缓冲液洗膜3 次,然后与辣根过氧化物酶偶联的二抗孵育。使用增强的化学发光底物使蛋白质水平可视化。通过密度测定法测定靶蛋白的表达水平,并将其标准化为-actin 的表达水平。所有样品重复3 次试验。
1.2.8 qRT-PCR 实验
根据TRIzol 制造商的说明书,使用TRIzol 试剂提取总RNA。用紫外分光光度计在260 nm 处分析总RNA 的量和纯度。该试剂盒反应体系包括:Taq 酶,dNTP mix,上样染料,DNA 模板,ddH2O,逆转录反应产物,上、下游引物等。反应条件:93℃预变性3 min,95℃反应5 min;93℃反应40 s,72℃反应60 s,进行38 个循环。实验引物由美国Invitrogen 公司生产。使用SuperScript Ⅲ试剂盒从总RNA逆转录cDNA。使用ABI PRISM 7000 荧光定量PCR 系统,以-actin 作为内参进行定量实时PCR。引物序列如表1 所示。所有样品重复3 次试验。

表1 qRT-PCR 引物序列
1.3 统计学方法
实验结束后,收集实验数据,计算各组数据的均数±标准差,使用SPSS 22.0 软件进行统计学分析,本实验均数比较采用方差分析(ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 2-ME 对骨肉瘤MG63 细胞形态的影响
通过光学显微镜观察2-ME对骨肉瘤MG63 细胞形态的影响,结果发现:对照组的MG63 细胞大小均一,细胞壁光滑,呈上皮样贴壁生长;实验组随着2-ME 浓度的增加,细胞数量逐渐减少,细胞形态变化显著,细胞密度明显减少,细胞逐渐变圆、皱缩,呈浓度依赖性(见图1)。
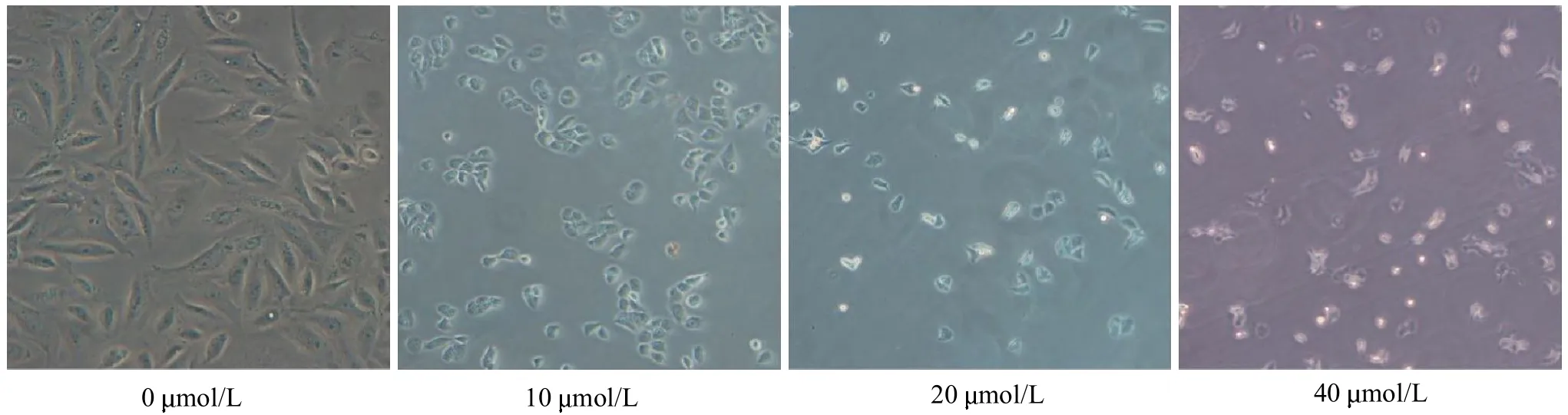
图1 不同浓度2-ME 作用48 h 后对骨肉瘤细胞形态学的影响(×200)
2.2 2-ME 对骨肉瘤MG63 细胞增殖的影响
通过MTT 实验检测2-ME 对骨肉瘤MG63 细胞增殖抑制作用,结果显示,随2-ME 浓度增加,2-ME 对MG63 细胞增殖抑制作用越明显,呈剂量依赖性;随作用时间的延长,2-ME 对MG63 细胞的抑制率也逐渐升高,呈时间依赖性。可见2-ME 对骨肉瘤MG63 细胞的增殖抑制作用呈剂量-时间依赖性(见图2)。

图2 A.不同浓度2-ME 对骨肉瘤细胞的增殖抑制情况;B.20 mol/L的2-ME 随培养时间的不同对骨肉瘤细胞的增殖抑制情况;*与对照组比较P<0.05
2.3 2-ME 对骨肉瘤MG63 细胞周期的影响
应用流式细胞仪检测不同浓度2-ME对骨肉瘤MG63 细胞周期的影响。与对照组相比,随着2-ME 浓度的升高,骨肉瘤MG63 细胞的细胞周期停留在G0/G1期比例显著性提高,而S 期和G2/M 期的细胞比例则显著性下降,差异均有统计学意义(*,P<0.05)(见图3)。由此可见,2-ME 能作用骨肉瘤MG63 细胞的细胞周期,使大多数骨肉瘤MG63 细胞的阻滞于G0/G1期,使S 期和G2/M 期的细胞明显减少,进而抑制骨肉瘤MG63 细胞的增殖能力。

图3 不同浓度2-ME 对骨肉瘤细胞周期的影响(*与对照组比较,P<0.05)
2.4 2-ME 对骨肉瘤MG63 细胞凋亡水平的影响
通过FITC-AnnexinV/PI 双染色法联合流式细胞术检测2-ME 对MG63 细胞凋亡水平的影响。未加药物作用MG63细胞中只有少量细胞处于早期凋亡(3.6±1.86)及中晚期凋亡状态(4.2±2.59);10 mol/L 的2-ME 就能将MG63 细胞的凋亡水平增加1 倍多,中晚期凋亡细胞比例(10.0±2.91)增加明显而早期凋亡细胞比例没有变化,而20 mol/L 与40 mol/L 2-ME 进一步加强了中晚期凋亡的促进作用,也提高了早期凋亡的比例,差异均有统计学意义(*,P<0.05)(见图4)。

图4 不同浓度2-ME 对骨肉瘤细胞凋亡的影响(*与对照组比较,P<0.05)
2.5 2-ME 对骨肉瘤MG63 细胞Bcl-2、VEGF、Caspase-3 蛋白表达的影响
本研究采用Western Blot 法检测上述各组细胞中Bcl-2、VEGF、Caspase-3 蛋白表达情况。经统计学分析,药物作用组细胞中Bcl-2、VEGF 蛋白的表达均明显低于对照组,差异均有统计学意义(*P<0.05);药物作用组细胞中Caspase-3蛋白的表达均明显高于对照组,差异均有统计学意义(*,P<0.05)。从实验数据中可以看出,随着2-ME 药物作用浓度的升高,Bcl-2、VEGF 蛋白的表达量逐渐降低,Caspase-3 蛋白的表达量则逐渐升高(见图5)。经统计学分析,差异均有统计学意义(*,P<0.05)。
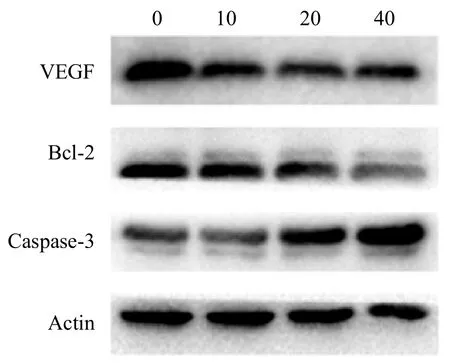
图5 不同浓度2-ME 对骨肉瘤细胞相关分子蛋白表达的影响
2.6 2-ME 对骨肉瘤MG63 细胞Bcl-2、VEGF、Caspase-3 mRNA 表达的影响
本研究用RT-PCR法检测上述各组细胞中Bcl-2、VEGF、Caspase-3 mRNA 的表达情况。经统计学分析,药物作用组细胞中Bcl-2、VEGF mRNA 的表达均明显低于对照组,差异均有统计学意义(*P<0.05);药物作用组细胞中Caspase-3 mRNA 的表达均明显高于对照组,差异均有统计学意义(*,P<0.05)。使用Graphpad Prism 软件做直方图后观察各组mRNA 变化趋势,可见随着2-ME 药物作用浓度的升高,Bcl-2、VEGF mRNA 的表达量逐渐降低,Caspase-3 mRNA的表达量也逐渐升高(见图6)。
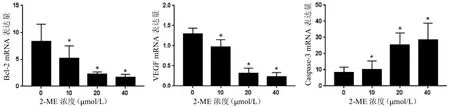
图6 不同浓度2-ME 对骨肉瘤细胞相关分子mRNA 表达的影响(*与对照组比较P<0.05)
3 讨论
2-甲氧基雌二醇(2-ME)是雌二醇在人体正常的代谢产物,化学名为17 -2-甲氧基雌-1,3,5 (10) -三烯-3,17-二醇,大量存在于人体的血液和尿液中[4]。经大量的细胞实验、动物实验验证,2-ME 具有很强的抗肿瘤效果,并且对许多不同种类的肿瘤均有效[5]。文献报道,2-ME 对肺癌、血管肉瘤、前列腺癌、结肠癌、黑色素瘤、乳腺癌等都具有抗肿瘤作用[6-9]。研究发现,2-ME 发挥抗肿瘤作用是通过诱导肿瘤细胞凋亡、使肿瘤细胞周期停滞、抑制肿瘤血管生成来实现的[10]。大量研究表明,2-ME 具有多方面的作用机制,但2-ME 对骨肉瘤的抗肿瘤效应研究非常少见,不够深入。
本研究通过细胞形态学观察显示,随着2-ME 浓度的增加,骨肉瘤MG63 细胞数量逐渐减少,细胞逐渐皱缩、变圆,呈浓度依赖性。MTT 检测表明,2-ME 具有抑制骨肉瘤MG63 细胞增殖的作用,且呈时间及剂量依赖性。应用流式细胞术分析细胞周期结果显示,2-ME 可使骨肉瘤MG63 细胞的细胞周期更多停留在G0/G1期,进而抑制骨肉瘤MG63细胞的增殖。
2-ME 诱导凋亡内源性途径通常由Bcl-2 蛋白家族控制,Bcl-2 是一种重要的细胞凋亡基因及调节蛋白,调节线粒体外膜的透化作用,这是细胞凋亡的关键步骤,它们在胞质溶胶和线粒体中的复杂相互作用决定了细胞的命运[11-12]。Bcl-2 蛋白在细胞中主要作用于凋亡途径的下游通道,通过抑制化疗、氧自由基、放射线等诱导肿瘤细胞凋亡。Bcl-2 在肿瘤中作为一种抑制因子,协助肿瘤细胞对化疗药物产生抵抗。Caspase-3是半胱天冬酶家族中最重要的成员,在凋亡的执行过程中具有重要功能,被认为是凋亡过程中最关键的内切酶,绝大多数细胞凋亡都要经过Caspase-3 介导的信号传导途径。Caspase-3 的表达显示凋亡启动和发生,是凋亡的重要标志[13]。
应用流式细胞术分析细胞凋亡率结果显示,2-ME 能剂量依赖性诱导骨肉瘤细胞发生凋亡。Western Blot 和qRTPCR 实验结果表明,随着2-ME 浓度的升高,肿瘤细胞内Caspase-3 蛋白和mRNA 表达水平则逐渐升高,Bcl-2 蛋白和mRNA 表达水平则逐渐降低。2-ME 能诱导肿瘤细胞发生凋亡,其凋亡机制可能与Bcl-2、Caspase-3 相关。
血管内皮生长因子(VEGF)通过促进内皮细胞的增殖和迁移,在肿瘤血管生成中起重要作用,可特异性调节肿瘤血管生成,与肿瘤侵袭和转移密切相关[14]。抑制体内VEGF的表达可减少肿瘤血管新生,减少肿瘤的血液供给,可对肿瘤的生长、浸润及迁移活动进行有效抑制。Western Blot 和qRT-PCR 实验结果表明,随着2-ME 浓度的升高,VEGF 蛋白和mRNA 表达水平则逐渐降低,提示2-ME 对骨肉瘤具有抗血管生成作用,其机制可能与VEGF 相关。
综上所述,2-ME 能抑制骨肉瘤MG63 细胞增殖、诱导凋亡,其作用机制可能与Bcl-2、VEGF、Caspase-3 相关,2-ME的人工产物或其衍生物有望成为治疗骨肉瘤的新型化疗药物。
