发酵过程多尺度解析与调控的研究进展
2019-10-31刘延峰李雪良张晓龙徐显皓刘龙堵国成
刘延峰,李雪良,张晓龙,徐显皓,刘龙,堵国成
发酵过程多尺度解析与调控的研究进展
刘延峰1,2,李雪良2,张晓龙1,2,徐显皓1,2,刘龙1,2,堵国成1,2
1 江南大学 糖化学与生物技术教育部重点实验室,无锡 214122 2 江南大学 工业生物技术教育部重点实验室,无锡 214122
工业发酵科学致力于实现高产量、高转化率和高生产强度的相对统一。通过从分子、细胞和反应器进行发酵过程多尺度解析与调控,实施全局与动态的优化与控制能够确保发酵过程高效、转化定向、过程稳定和系统有序。本文从发酵微生物代谢途径动力学模型、细胞代谢特性、发酵提取相耦合与反应器设计四个方面,总结和讨论发酵过程多尺度解析与调控的研究进展。整合分析发酵过程不同尺度特征并且针对性地开展多尺度整合调控是实现高效工业微生物发酵的重要策略。
动力学模型,细胞代谢特性,发酵提取相耦合,反应器设计
工业发酵科学是工业生物学的重要组成部分,是促进重要生物产品从实验室制备走向工厂大规模生产的关键学科。工业发酵科学致力于从分子、细胞和系统不同层次解析工业环境下发酵微生物行为的基本规律,提高生物制造和生物工艺效率,实现高产量、高转化率和高生产强度的相对统一 (图1)。
发酵过程主要包含分子、细胞和系统3个层次,这3个层次交互作用并且共同决定着发酵过程的效率。例如枯草芽孢杆菌发酵合成N-乙酰氨基葡萄糖过程中,N-乙酰氨基葡萄糖合成途径和竞争途径基因表达在分子层次影响目标产物的合成效率;底物葡萄糖的和木糖的供给在细胞反应动力学层次决定产物合成的效率;反应器中搅拌转速和温度等条件在反应器层次影响目标产物的合成效率[1]。

图1 多尺度发酵条件对发酵过程的调控
发酵微生物代谢途径动力学模型设计与构建、细胞代谢特性分析与发酵过程调控、发酵-提取耦合系统开发与应用以及新型反应器设计 4个方面的进展显著提升了工业发酵科学的技术手段,促进了发酵过程多尺度解析与调控。本文针对上述4个方面的研究进展进行总结和讨论,并且对发酵过程多尺度解析与调控的发展趋势进行了展望。
1 基于代谢途径与发酵过程动力学模型的发酵过程优化与控制
将经验转变为数据模型并且预测发酵过程曲线是发酵工艺控制和优化的重要手段 (图2)。发酵过程代谢模型在发酵工艺控制和优化中具有重要意义,主要应用于以下3个方面,包括:指导发酵过程放大、解决大型发酵过程中不易测量数据估算的限制以及指导发酵工艺优化以提高目标产物产量。
首先,基于代谢速率和生长动力学相结合的发酵过程模型可用于评估反应器放大过程中的限制条件,通过模型计算来指导发酵工艺调整和优化,如pH、DO和发酵最大体积等参数优化[2]。例如,针对丝状真菌发酵过程,基于发酵过程模型的分析指导确定了不同工艺条件下的最优发酵体积,并且在此基础上开发了在线控制策略模型,成功预测了生物量等系统状态[3]。另外,在ω-3脂肪酸发酵过程中,动力学模型被用于分析、优化以及指导发酵工艺放大过程,并且模型分析发现控制发酵工艺划为前期生长和后期合成过程的两阶段法连续发酵可以显著提高目的产物合成效率[4]。根据数值分析和流体力学原理,计算流体力学能够辅助预测流体流动、传热、传质以及发酵放大过程的潜在限速步骤。计算流体力学与反应动力学相结合能够为发酵过程放大提供指导[5]。
其次,建立发酵模型还可以解决大型发酵过程中检测器因位置和成本因素等限制数据获取的限制,包括发酵罐中不同位置存在的pH和DO梯度等。例如,在700 L发酵罐中进行乳酸发酵过程中存在pH梯度,通过产物合成动力学模型和流体动力学相结合的模型,pH梯度范围得以准确地预测,并且用以指导发酵工艺优化[6]。
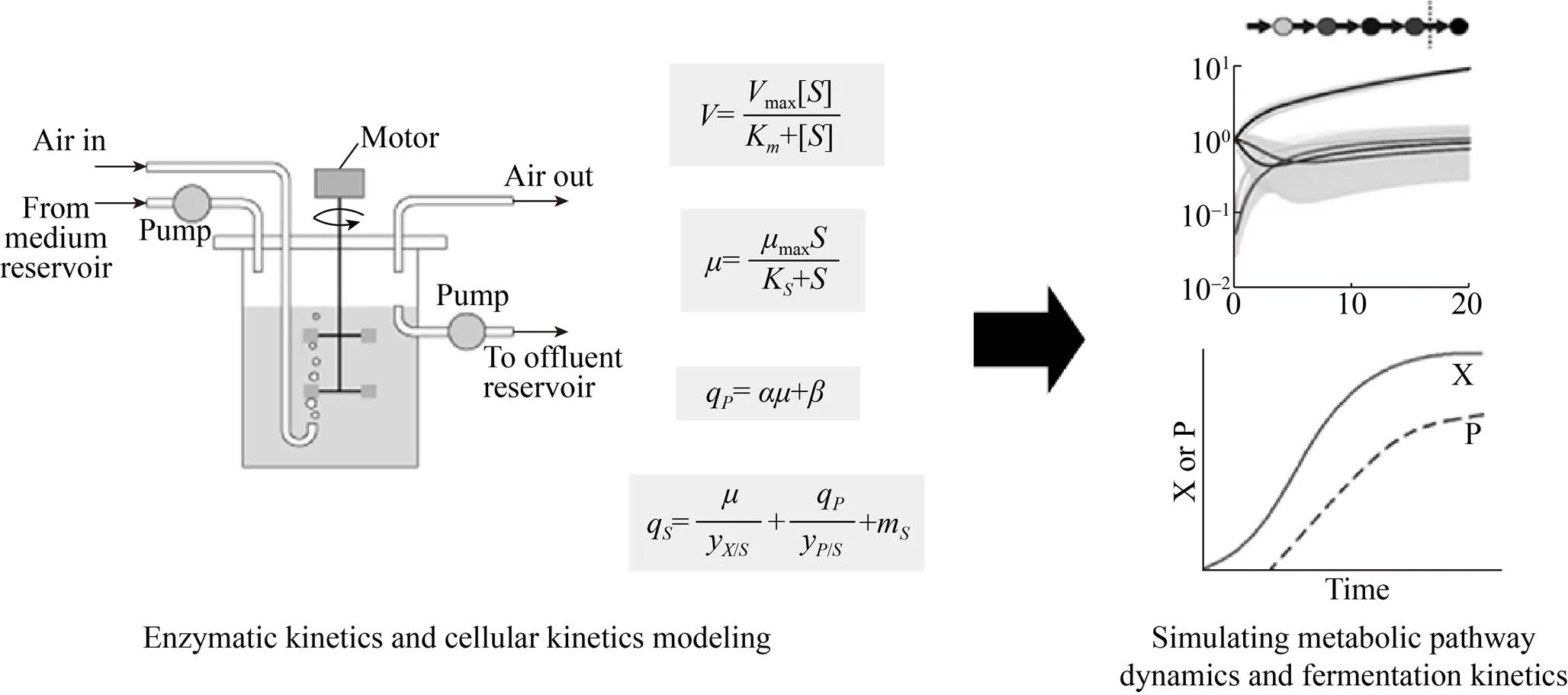
图2 代谢途径与发酵过程动力学模型的设计与构建
最后,发酵过程代谢模型能够指导发酵工艺优化,以提高目标产物产量。针对发酵过程的复杂多变的特点,将群体平衡模拟 (Population balance modeling) 和控制论模拟 (Cybernetic modeling) 之间进行柔性连接,能够使其形成系统性模型用以分析微生物和复杂发酵底物之间的发酵动力学关系,指导目的产物乙醇产量的提高[7-8]。结合Luedeking-Piret反应和Monod生长动力学,可对较难处理的分批发酵过程进行简便建模,用以计算生长和产物合成动力学数据[9]。基于线性微分方程组的发酵过程动力学模型已被成功应用于指导青霉素、乙醇等典型发酵产品的发酵过程优化与控制[10-12]。
2 针对细胞代谢特性的培养条件和补料策略优化
通过分析细胞代谢特性鉴定影响细胞代谢的关键因素,然后针对细胞代谢特性进行发酵过程补料和控制是发酵过程优化的重要策略。
以枯草芽孢杆菌生产异源蛋白、功能糖等目标产物为例,对于不同目标产物需要针对性地优化培养基组成和补料策略[13]。当利用枯草芽孢杆菌合成人类生长激素 (hGH) 时,使用富含蛋白胨为氮源的补料培养基有助于菌体快速生长,并且使得目的蛋白产量提高了约3倍[14]。当枯草芽孢杆菌用于合成N-乙酰氨基葡萄糖时,采用富含酵母粉和蛋白胨的复合培养基有助于提高N-乙酰氨基葡萄糖产量,添加尿素可进一步显著提高N-乙酰氨基葡萄糖的产量[1]。当利用枯草芽孢杆菌合成四甲基吡嗪时,在补料过程中添加(NH4)2HPO4可使四甲基吡嗪产量提高近2倍[15]。
使用特殊基因表达调控元件时,需要针对性地优化补料策略。例如采用特定条件激活启动子调控目标基因表达时,需要优化特定的培养条件和补料策略。相关条件激活启动子包括来源于枯草芽孢杆菌的葡萄糖饥饿诱导型启动子P、磷酸盐饥饿启动子P、DO饥饿型启动子P等[16-18]。
针对目标产物合成过程进行针对性且系统性的细胞代谢分析和前体供给平衡,能够促进目标产物的合成。例如,优化毕赤酵母合成granulyte- colony stimulating factor (G-CSF) 过程中,通过整合分析培养基优化和转录组学数据,获得了有利于细胞生长和蛋白质合成的培养基,使得目的产物 (G-CSF) 产量提高5倍[19]。以束丝放线菌为宿主生产安丝菌素P-3时,在工程菌株强化前体供给的基础上,进一步结合发酵补料策略强化前体供给,即通过在60、96和120 h间歇性补加15 g/L果糖和1.64 g/L异丁醇,安丝菌素产量显著提高[20]。
当目标产物积累对于细胞生长具有一定抑制作用时,针对性补加能够缓解抑制作用的物质可以显著促进目标产物合成。例如,以出芽短梗霉作为宿主生产苹果酸时,培养基中需要添加30 g/L的CaCO3,用以缓冲低pH对细胞的毒害作用[21-23]。另外,通过原位产物分离策略也可以实现解除有毒性的产物积累对细胞生长的抑制,例如通过添加有机相来萃取目的产物游离脂肪酸,以减少产物积累对细胞的毒害作用[24]。
3 发酵过程与提取过程相耦合的过程设计与优化
生物合成途径的调控机制包括诱导、营养阻遏 (包括碳、氮、磷、硫等) 和反馈调控等。其中,反馈调控是发酵与提取相耦合工艺 (product recovery/removal, ISPR) 及其优化所依赖的理论基础。它指的是代谢途径受其自身产物的控制,可以是限制已有酶的活性 (反馈抑制),或者是阻遏相关酶的继续合成 (反馈阻遏)。一般认为这是微生物进化出来的竞争和自保机制的一种。
工业生产中多种初级和次级代谢产物是具有反馈调控功能的,包括氨基酸、有机酸酸和抗生素等。例如,在大肠杆菌中,不但、和编码的天冬氨酸激酶同工酶受到苏氨酸、蛋氨酸和赖氨酸等终产物的反馈抑制,代谢途径中的每个节点还受到各自中间产物的抑制[25]。柠檬酸对其合成途径中的磷酸果糖激酶也有一定的抑制作用[26]。Sanchez和Demain总结了多种初级代谢产物反馈调控的例子[27]。抗生素的例子则更多,且通常是直接抑制其合成途径中最后一步或者接近最后一步的酶,在此不再赘述。有些次级代谢产物还能首先通过物理和化学的机制对菌体产生破坏作用,比如乳酸乳球菌素Nisin[28-30]。Nisin是乳酸乳球菌分泌的一种小分子多肽,由于其对革兰氏阳性菌具有很强的抑制作用,而作为多肽在人的消化道可以被迅速分解,常作为一种安全的防腐剂用于肉制品和奶制品中。其作用机理是通过与细胞膜中的磷脂及磷脂前体相结合,干扰细胞膜平衡离子浓度及pH的功能,造成胞内物质泄漏,破坏细菌的生理功能。与此类似但更加复杂的是传统丙酮-丁醇-乙醇发酵中 (ABE fermentation) 3种溶剂尤其是丁醇对生产菌丙酮丁醇酸菌的抑制[31]。ABE发酵在二战前曾是世界最大的生物产业,但战后随着石油工业的兴起及原料成本的增加而迅速失去了竞争力[32]。其中由于产物抑制,总溶剂浓度不超过18–20 g/L,后期分离提取能耗较高也是其中的一个原因。近年来,由于化石燃料面临枯竭及其对自然环境的巨大破坏,人们开始重新探索生物方法生产可再生能源,ABE发酵再次引起了研究人员的兴趣。在2009年时,我国仍有至少12家ABE发酵工厂[33],之后又有十几家新建或者恢复生产[34]。
虽然通过基因工程的方法可以在一定程度上改进生产菌对产物的耐性[35],但这与发酵提取相耦合的工艺并不矛盾,甚至是相辅相成的。在抗生素的生产中,ISPR通常采用膜分离或者是液-液萃取的方式[36],其他产品还有用到结晶[37]。前面提到的Nisin传统上是分批培养,发酵结束后通过泡沫分离进行提取[38]。Zheng等[39]发现,将泡沫分离与发酵工程相结合,在线提取Nisin可以明显提高底物利用率和产量。关于ABE发酵-提取相耦合的研究则更多,几乎所有常规的分离提取技术都有尝试,包括液-液萃取、渗透萃取、精馏、渗透蒸发、气提等[40-41]。美国现在仍在运行的唯一ABE发酵工厂明尼苏达州的Green Biologics采用的是低温真空精馏连续培养,其工艺流程应与图3所示类似。为了进一步降低气相中溶剂的分压,还可以在精馏塔中注入惰性气体[42],相当于气提与精馏相结合。实际上,发酵与一种以上分离提取技术相耦合的情况并不少见。同样在可再生能源的大环境下兴起的合成气发酵(Syngas fermentation) 也面临传统ABE发酵类似的问题。Phillips等给出的过程流程图就使用了超滤和精馏两种技术[43],简化后如图4所示。图3、图4各代表了ISPR回收目标产物的两种基本思路:直接接触式和间接接触式。
除上述目标产物的反馈调控,发酵过程中最常见的副产物CO2对微生物的生长和代谢也有很大的影响。Shimoda等[44]的实验发现,酿酒酵母在CO2的作用下呈现一阶线性死亡动力学特性。溶解的CO2对青霉素生产菌的影响较为复杂:在延迟生长期,低水平的CO2能促进菌的生长,但是以牺牲青霉素的产率为代价。较高的CO2溶解度则会严重抑制底物的摄取,造成生产菌形态学上的变化,影响目标产物的产量[45]。在好氧发酵中,通过监测呼吸商(Respiratory quotient, RQ) 来推算反应器内生物代谢状态是多尺度发酵控制的经典案例[46-47]。在合成气发酵中,虽然CO2是Wood Ljungdahl路径的底物,但推动反应进行的能源是由一氧化碳在一氧化碳脱氢酶(CODH) 的催化下还原铁氧化还原蛋白来提供的[48-50],如图5所示。此外,氢气在氢化酶的催化下被氧化也能提供一部分能量。原料气H2和CO的比例决定整个反应的最终结果是否有CO2排出以及各个产物之间的比例[51]。Simpson等[52]通过提高CO2的溶解度将产品导向2,3-丁二醇。相反,降低CO2分压则应有利于目标产物乙醇的合成。从发酵液中分离溶解的CO2可以使用选择性膜分离技术,但成本和能耗较高,得不偿失,目前未见报道。帝国化学工业(ICI) 在20世纪70年代末曾轰动一时的大规模单细胞蛋白生产所用60 m高的气升式反应器,则是利用从底部到顶部高达303.975 kPa 静压差使溶解的CO2析出,使循环到底部的发酵液含有较低的CO2,达到缓解其对生产菌抑制的效果[53]。
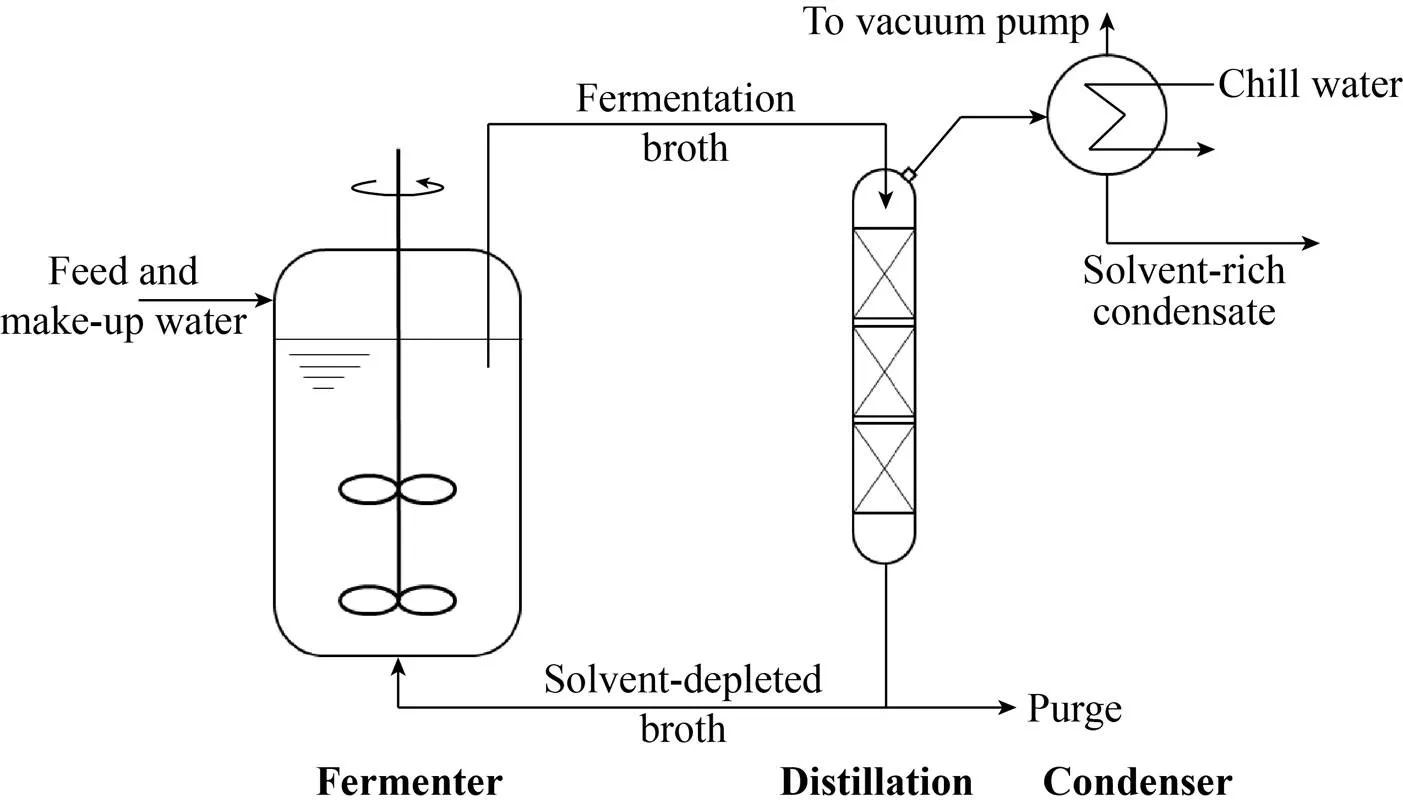
图3 真空精馏与发酵过程相耦合在线提取挥发性产物示意图

图4 合成气连续发酵与过滤、精馏相耦合流程示意图[42]
当然,发酵-提取相耦合也并不能适用于所有的发酵。使用基因重组大肠杆菌以果糖为原料生产的乙酸紫苏酯的中间产品柠檬烯是不溶于水的,而且在很低浓度下即可完全抑制大肠杆菌的生长。一般的思路是在反应器内添加有机相来萃取柠檬烯。然而,由于柠檬烯在有机相中分配系数过高,这反而阻断了反应的进行。Willrodt等[54]把柠檬烯的合成路径与乙酸紫苏酯的合成路径分别在两个大肠杆菌菌株中实现,然后以特定的比例将两个菌株混合培养,对柠檬烯生产菌来讲相当于产物在线提取,而对乙酸紫苏脂生产菌来讲相当于补料培养,很好地解决了柠檬烯溶解度低和生长抑制的问题。类似的例子并不多,可以说Willrodt等的工作为解决难溶、易挥发的中间产物抑制提供了一个新的思路。
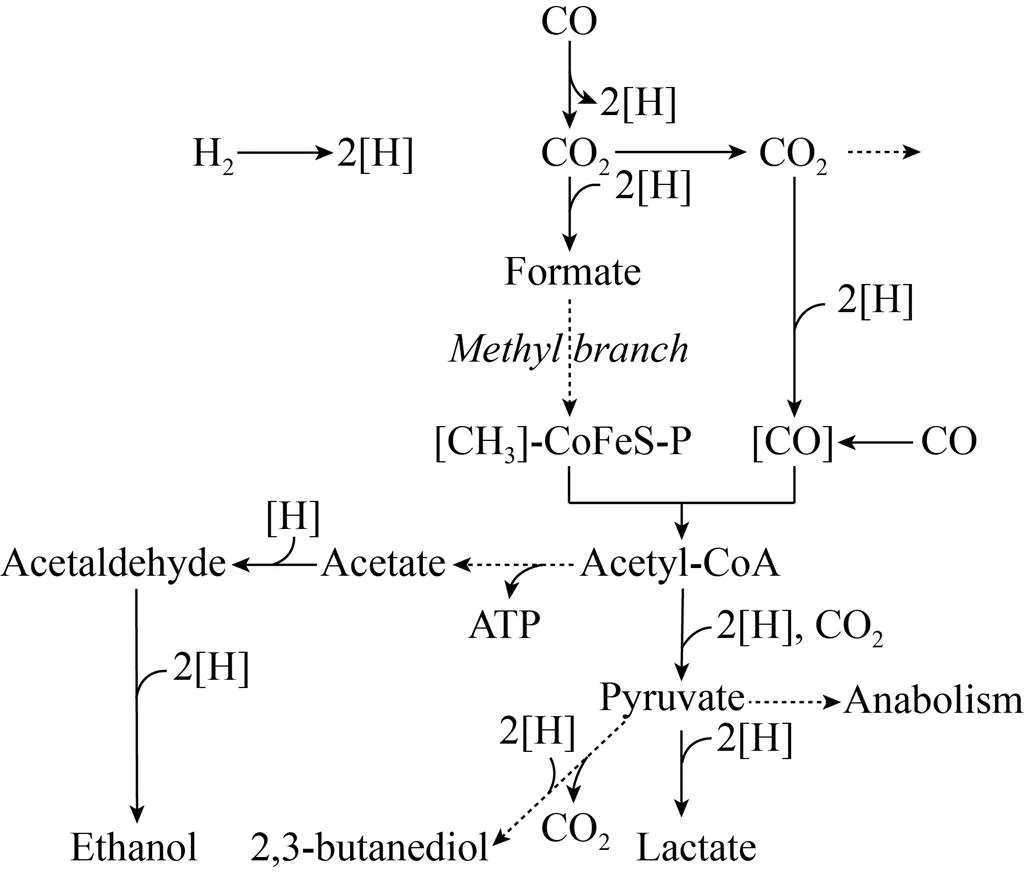
图5 简化的Wood Ljungdahl路径固定CO2示意图,包括向乙醇、乙酸、2,3-丁二醇的延伸
有些微生物还会依据培养环境中的菌体浓度调节基因表达,但一般不被归纳到反馈调节,而是自动诱导,因为其原理是基于菌体自身分泌的微量信号物质——自动诱导因子。如果需要延长对数生长期进而得到更高的菌体浓度,将自动诱导因子的浓度控制在较低水平的方法与发酵-分离相耦合是一致的。总之,发酵与分离相耦合本质上是为了达到系统中菌体停留时间 (Cell retention time) 与水力停留时间 (Hydraulic retention time) 解耦,进而使发酵产物可以独立于菌体浓度进行调节,给代谢调控更大的操作空间。
4 针对发酵动力学优化的反应器设计
发酵微生物代谢过程是生物反应器的核心和基础,生物反应器服务于细胞代谢与产物合成。因此,针对发酵微生物代谢的特点设计反应器能够显著提升发酵过程的效率。在小型和微型生物反应器中,保持发酵参数的均一性相对容易[55],但在工业规模的大型装置中,其不均一性是不可忽视的[56-57]。解决方法只能是针对生产菌的代谢动力学进行反应器优化设计。我国科研人员[47]根据计算流体力学(CFD) 模拟结果,将一个12 m3搅拌釜反应器的径向流搅拌桨更换成组合式的轴流搅拌桨来提高气液两相的混合效率,这不但显著降低了搅拌能耗,还使头孢霉素C的产量提高了15%。之后,该实验室与Haring等[58]合作,通过CFD模拟与底物消耗动力学相结合,预测在一个54 m3的反应器内,底物浓度梯度的存在能造成18%–46%的产黄青霉素得率损失 (与完全混合的理想反应器相比)。经进一步研究,他们将CFD与更为复杂的代谢动力学模型相结合,提出了理性生物反应器设计策略[59],如图6所示。University of Massachusetts Amherst与LanzaTech合作将基因组规模代谢模型 (Flux balance analysis) 与流体力学、反应动力学和传质模型相结合,对活塞流鼓泡塔合成气发酵进行了研究[60-61]。
在特定情况下,反应器内底物的梯度可能产生有利的结果。Enfors等[62]用流式细胞仪观测到在大规模反应器以及模型缩小反应器的动态环境的诱导下,大肠杆菌细胞的完整性得到了提升。有此类代谢特性的系统,可以考虑使用活塞流反应器,或者是多级反应器串联发酵。南京工业大学团队通过动力学模拟,优化了2–3级连续发酵生产二十二碳六烯酸 (DHA) 工艺,取得了比普通补料分批发酵高出将近一倍的产量[63]。合成气发酵生产燃料乙醇工艺是通过反应器设计对发酵过程进行精确代谢调控的经典例子[60-61]。如图5所示,Woold Ljungdahl路径下从乙酰辅酶A经乙酸、乙醛到乙醇这一分支上,乙酸的合成产生ATP有利于菌体生长,而目标产物乙醇的合成则需要消耗还原当量,与菌体生长是竞争关系。这一步的调控,对维持系统的稳定性和产物的选择性起着关键的作用。还原乙酸到乙醛的铁氧还蛋白氧化还原酶以及催化乙醛成乙醇的醇还原酶通常都是过量表达的,对产物选择性没有太大的影响,反应基本上是受还原当量[H]的浓度决定[49]。还原当量主要来自于一氧化碳脱氢酶催化的COàCO2这一步反应,而这一步反应又直接受反应器传质速率的控制,所以反应器的设计就直接决定了发酵的效果。

图6 理性反应器设计工作流程
总之,无论是以有机物为底物的传统发酵,还是近年来兴起的气体发酵,反应器的设计影响底物、产物、pH甚至温度等在反应器内的分布,对代谢调控有直接或者间接的影响。有时候,仅仅是改变一下进料位置,就能显著提高发酵的性能[66]。优化反应器设计能提高产量,降低能耗和成本,减少废物排放。它涉及到合成生物学、蛋白质组学、反应动力学、流体力学、材料、机械、电子、计算机等多个学科,进一步将多学科深度融合是发酵产业迈向现代化的发展方向。
5 结论
针对工业发酵过程分子、细胞和系统3个层次,发酵过程多尺度解析与调控在发酵微生物代谢途径动力学模型设计与构建、细胞代谢特性分析与发酵过程调控、发酵-提取相耦合系统开发与应用以及新型反应器设计4个方面取得了显著的进展,促进了工业发酵过程高产量、高转化率和高生产强度的实现。未来研究中,进一步从以下3个方面开展研究能够提升基于多尺度发酵条件的过程优化与控制:1) 建立工业规模多尺度实时生物感应系统,包括在分子尺度实时监测代谢途径的生物感应器,在细胞尺度实时监测细胞动力学特性的生物感应器,在反应器尺度实时监测多种代谢物浓度及多种发酵参数的在线检测系统;2) 建立发酵过程大数据系统,使细胞生理代谢特性可视化,建立基于大数据指导下的发酵培养基与发酵过程优化;3) 建立智能化高效发酵与分离耦合过程,提升发酵过程与分离过程的适配性与协调性,提升发酵过程的智能化控制。综上所述,进一步整合分析发酵微生物不同尺度特征并且针对性地开展多尺度整合调控能够提升工业微生物发酵的效率并且拓展生物制造的应用范围。
[1] Wu YK, Chen TC, Liu YF, et al. CRISPRi allows optimal temporal control of N-acetylglucosamine bioproduction by a dynamic coordination of glucose and xylose metabolism in. Metab Eng, 2018, 49: 232–241, doi: 10.1016/j.ymben.2018.08.012.
[2] Mears L, Stocks SM, Albaek MO, et al. Application of a mechanistic model as a tool for on-line monitoring of pilot scale filamentous fungal fermentation processes—the importance of evaporation effects. Biotechnol Bioeng, 2017, 114(3): 589–599.
[3] Mears L, Stocks SM, Albaek MO, et al. A novel model-based control strategy for aerobic filamentous fungal fed-batch fermentation processes. Biotechnol Bioeng, 2017, 114(7): 1459–1468.
[4] Xie DM, Miller E, Sharpe P, et al. Omega-3 production by fermentation of: From fed-batch to continuous. Biotechnol Bioeng, 2017, 114(4): 798–812.
[5] Xia J, Wang G, Lin JH, et al. Advances and practices of bioprocess scale-up. Adv Biochem Eng Biotechnol, 2016, 152: 137–151.
[6] Spann R, Glibstrup J, Pellicer-Alborch K, et al. CFD predicted pH gradients in lactic acid bacteria cultivations. Biotechnol Bioeng, 2019, 116(4): 769–780.
[7] Ho YK, Doshi P, Yeoh HK, et al. Interlinked population balance and cybernetic models for the simultaneous saccharification and fermentation of natural polymers. Biotechnol Bioeng, 2015, 112(10): 2084–2105.
[8] Jabarivelisdeh B, Waldherr S. Optimization of bioprocess productivity based on metabolic-genetic network models with bilevel dynamic programming. Biotechnol Bioeng, 2018, 115(7): 1829–1841.
[9] Garnier A, Gaillet B. Analytical solution of Luedeking-Piret equation for a batch fermentation obeying Monod growth kinetics. Biotechnol Bioeng, 2015, 112(12): 2468–2474.
[10] Tang WJ, Deshmukh AT, Haringa C, et al. A 9-pool metabolic structured kinetic model describing days to seconds dynamics of growth and product formation by. Biotechnol Bioeng, 2017, 114(8): 1733–1743.
[11] Slininger PJ, Dien BS, Lomont JM, et al. Evaluation of a kinetic model for computer simulation of growth and fermentation byfed D-xylose. Biotechnol Bioeng, 2014, 111(8): 1532–1540.
[12] Jing KJ, Tang YW, Yao CY, et al. Overproduction of L-tryptophan via simultaneous feed of glucose and anthranilic acid from recombinantW3110: Kinetic modeling and process scale-up. Biotechnol Bioeng, 2018, 115(2): 371–381.
[13] Liu YF, Liu L, Li JH, et al. Synthetic biology toolbox and chassis development in. Trends Biotechnol, 2018, 37(5): 548–562.
[14] Şahin B, Öztürk S, Çalık P, et al. Feeding strategy design for recombinant human growth hormone production by. Bioproc Biosyst Eng, 2015, 38(10): 1855–1865.
[15] Zhu BF, Xu Y. A feeding strategy for tetramethylpyrazine production bybased on the stimulating effect of ammonium phosphate. Bioproc Biosyst Eng, 2010, 33(8): 953–959.
[16] Panahi R, Vasheghani-Farahani E, Shojaosadati SA, et al. Auto-inducible expression system based on the SigB-dependent ohrB promoter in. Mol Biol, 2014, 48(6): 852–857.
[17] Kerovuo J, Von Weymarn N, Povelainen M, et al. A new efficient expression system forand its application to production of recombinant phytase. Biotechnol Lett, 2000, 22(16): 1311–1317.
[18] Oh JS, Kim BG, Park TH. Importance of specific growth rate for subtilisin expression in fed-batch cultivation ofspoIIG mutant. Enzyme Microb Technol, 2002, 30(6): 747–751.
[19] Matthews CB, Kuo A, Love KR, et al. Development of a general defined medium for. Biotechnol Bioeng, 2018, 115(1): 103–113.
[20] Du ZQ, Zhong JJ. Rational approach to improve ansamitocin P-3 production by integrating pathway engineering and substrate feeding in. Biotechnol Bioeng, 2018, 115(10): 2456–2466.
[21] Zou X, Zhou YP, Yang ST. Production of polymalic acid and malic acid byfermentation and acid hydrolysis. Biotechnol Bioeng, 2013, 110(8): 2105–2113.
[22] Liu JJ, Li JH, Liu YF, et al. Synergistic rewiring of carbon metabolism and redox metabolism in cytoplasm and mitochondria offor Increased l-malate production. ACS Synth Biol, 2018, 7(9): 2139–2147.
[23] Yuzbashev TV, Yuzbasheva EY, Sobolevskaya TI, et al. Production of succinic acid at low pH by a recombinant strain of the aerobic yeast. Biotechnol Bioeng, 2010, 107(4): 673–682.
[24] Ledesma-Amaro R, Dulermo R, Niehus X, et al. Combining metabolic engineering and process optimization to improve production and secretion of fatty acids. Metab Eng, 2016, 38: 38–46.
[25] Kikuchi Y, Kojima H, Tanaka T. Mutational analysis of the feedback sites of lysine-sensitive aspartokinase of. FEMS Microbiol Lett, 1999, 173(1): 211–215.
[26] Harmsen HJM, Kubicek-Pranz EM, Röhr M, et al. Regulation of 6-phosphofructo-2-kinase from the citric-acid-accumulating fungus. Appl Microbiol Biotechnol, 1992, 37(6): 784–788.
[27] Sanchez S, Demain AL. Metabolic regulation and overproduction of primary metabolites. Microb Biotechnol, 2008, 1(4): 283–319.
[28] Wu ZL, Li XL. Modification of the data-processing method for the turbidimetric bioassay of nisin. Appl Microbiol Biotechnol, 2007, 74(2): 511–516.
[29] Gao FH, Abee T, Konings WN. Mechanism of action of the peptide antibiotic nisin in liposomes and cytochrome c oxidase-containing proteoliposomes. Appl Environ Microbiol, 1991, 57(8): 2164–2170.
[30] ‘t Hart P, Oppedijk SF, Breukink E, et al. New insights into nisin’s antibacterial mechanism revealed by binding studies with synthetic lipid ii analogues. Biochemistry, 2016, 55(1): 232–237.
[31] Soni BK, Das K, Ghose TK. Inhibitory factors involved in acetone-butanol fermentation by. Curr Microbiol, 1987, 16(2): 61–67.
[32] Jones DT, Woods DR. Acetone-butanol fermentation revisited. Microbiol Rev, 1986, 50(4): 484–524.
[33] Ni Y, Sun ZH. Recent progress on industrial fermentative production of acetone-butanol-ethanol by clostridium acetobutylicum in China. Appl Microbiol Biotechnol, 2009, 83(3): 415–423.
[34] Jiang Y, Liu JL, Jiang WH, et al. Current status and prospects of industrial bio-production of n-butanol in China. Biotechnol Adv, 2015, 33(7): 1493–1501.
[35] Mao SM, Luo YM, Zhang TR, et al. Proteome reference map and comparative proteomic analysis between a wild typeDSM 1731 and its mutant with enhanced butanol tolerance and butanol yield. J Proteome Res, 2010, 9(6): 3046–3061.
[36] Mai NL, Koo YM. Enzymatic hydrolysis of penicillin andproduct separation in thermally induced reversible phase-separation of ionic liquids/water mixture. Enzym Microb Technol, 2014, 63: 34–38.
[37] Buque-Taboada EM, Straathof AJJ, Heijnen JJ, et al. In situ product recovery (ISPR) by crystallization: Basic principles, design, and potential applications in whole-cell biocatalysis. Appl Microbiol Biotechnol, 2006, 71(1): 1–12.
[38] Stevenson P, Li XL. Foam Fractionation: Principles and Process Design. Boca Raton, FL, USA: CRC Press, 2014: 206.
[39] Zheng HJ, Zhang D, Guo KM, et al. Online recovery of nisin during fermentation coupling with foam fractionation. J Food Eng, 2015, 162: 25–30.
[40] Kujawska A, Kujawski J, Bryjak M, et al. Abe fermentation products recovery methods—a review. Renew Sustain Energy Rev, 2015, 48: 648–661.
[41] Outram V, Lalander CA, Lee JGM, et al. Appliedproduct recovery in ABE fermentation. Biotechnol Progr, 2017, 33(3): 563–579.
[42] Andlar M, Oros D, Rezić T, et al.vacuum assisted gas stripping recovery system for ethanol removal from a column bioreactor. Fibers, 2018, 6(4): 88.
[43] Phillips JR, Huhnke RL, Atiyeh HK. Syngas fermentation: a microbial conversion process of gaseous substrates to various products. Fermentation, 2017, 3(2): 28.
[44] Shimoda M, Cocunubo-Castellanos J, Kago H, et al. The influence of dissolved CO2concentration on the death kinetics of. J Appl Microbiol, 2001, 91(2): 306–311.
[45] El-Sabbagh N, McNeil B, Harvey LM. Dissolved carbon dioxide effects on growth, nutrient consumption, penicillin synthesis and morphology in batch cultures of. Enzym Microb Technol, 2006, 39(2): 185–190.
[46] Scheiblauer J, Scheiner S, Joksch M, et al. Fermentation of– combining kinetic modeling and optimization techniques points out avenues to effective process design. J Theoret Biol, 2018, 453: 125–135.
[47] Yang YM, Xia JJ, Li JH, et al. A novel impeller configuration to improve fungal physiology performance and energy conservation for cephalosporin c production. J Biotechnol, 2012, 161(3): 250–256.
[48] Phillips JR, Clausen EC, Gaddy JL. Synthesis gas as substrate for the biological production of fuels and chemicals. Appl Biochem Biotechnol, 1994, 45(1): 145–157.
[49] Richter H, Molitor B, Wei H, et al. Ethanol production in syngas-fermentingis controlled by thermodynamics rather than by enzyme expression. Energy Environ Sci, 2016, 9(7): 2392–2399.
[50] Molitor B, Marcellin E, Angenent LT. Overcoming the energetic limitations of syngas fermentation. Curr Opin Chem Biol, 2017, 41: 84–92.
[51] Jack J, Lo J, Maness PC, et al. Directingfermentation products via hydrogen to carbon monoxide ratio in syngas. Biom Bioenergy, 2019, 124: 95–101.
[52] Simpson SD, Koepke M, Smart KF, et al. System and method for controlling metabolite production in a microbial fermentation: US, 20140273115. 2014-09-18.
[53] Westlake R. Large-scale continuous production of single cell protein. Chemie Ingenieur Technik, 1986, 58(12): 934–937.
[54] Willrodt C, Hoschek A, Bühler B, et al. Coupling limonene formation and oxyfunctionalization by mixed-culture resting cell fermentation. Biotechnol Bioeng, 2015, 112(9): 1738–1750.
[55] Kawase Y, Moo-Young M. Mixing time in bioreactors. J Chem Technol Biotechnol, 1989, 44(1): 63–75.
[56] Schmidt FR. Optimization and scale up of industrial fermentation processes. Appl Microbiol Biotechnol, 2005, 68(4): 425–435.
[57] Hadjiev D, Sabiri NE, Zanati A. Mixing time in bioreactors under aerated conditions. Biochem Eng J, 2006, 27(3): 323–330.
[58] Haringa C, Tang WJ, Deshmukh AT, et al. Euler-lagrange computational fluid dynamics for (bio)reactor scale down: An analysis of organism lifelines. Eng Life Sci, 2016, 16(7): 652–663.
[59] Haringa C, Tang WJ, Wang G, et al. Computational fluid dynamics simulation of an industrial.fermentation with a coupled 9-pool metabolic model: Towards rational scale-down and design optimization. Chem Eng Sci, 2018, 175: 12–24.
[60] Li XG, Griffin D, Li XL, et al. Incorporating hydrodynamics into spatiotemporal metabolic models of bubble column gas fermentation. Biotechnol Bioeng, 2019, 116(1): 28–40.
[61] Chen J, Daniell J, Griffin D, et al. Experimental testing of a spatiotemporal metabolic model for carbon monoxide fermentation with. Biochem Eng J, 2018, 129: 64–73.
[62] Enfors SO, Jahic M, Rozkov A, et al. Physiological responses to mixing in large scale bioreactors. J Biotechnol, 2001, 85(2): 175–185.
[63] Guo DS, Ji XJ, Ren LJ, et al. Development of a multi-stage continuous fermentation strategy for docosahexaenoic acid production bysp. Bioresour Technol, 2018, 269: 32–39.
Advances in multi-scale analysis and regulation for fermentation process
Yanfeng Liu1,2, Xueliang Li2, Xiaolong Zhang1,2, Xianhao Xu1,2, Long Liu1,2, and Guocheng Du1,2
1,,,214122,,2,,,214122,,
Industrial fermentation focuses on realizing the uniform of high titer, high yield, and high productivity. Multi-scaleanalysis and regulation, including molecule level, cell level, and bioreactor level, facilitate global optimization and dynamic balance of fermentation process, which determine high efficiency of biosynthesis, targeted directionality of bioconversion, process robustness, and well-organized system. In this review, we summariz and discuss advances in multi-scale analysis and regulation for fermentation process focusing on the following four aspects: 1) kinetic modeling of metabolic pathways, 2) characteristic of cell metabolism, 3) co-coupling fermentation and purification, and 4) bioreactor design. Integrating multi-scaleanalysis of fermentation process and integrating multi-scale regulation are expected as an important strategy for realizing highly efficient fermentation by industrial microorganisms.
kinetic modeling, characteristics of cell metabolism, co-coupling fermentation and purification, bioreactor design
10.13345/j.cjb.190244
堵国成 教授,博士生导师,教育部长江学者特聘教授、国家“万人计划”教学名师,长期从事工业微生物发酵领域的科研和教学工作。作为项目负责人承担包括国家重点研发计划项目、国家863项目、科技部重点领域创新团队项目和教育部长江学者创新团队项目等在内的国家和部省级项目8项。获国家技术发明二等奖2项、国家科技进步二等奖1项,部省级科技成果一等奖5项,中国专利金奖 1项。担任、副主编,编委。

刘延峰, 李雪良, 张晓龙, 等. 发酵过程多尺度解析与调控的研究进展. 生物工程学报, 2019, 35(10): 2003–2013.
Liu YF, Li XL, Zhang XL, et al. Advances in multi-scale analysis and regulation for fermentation process. Chin J Biotech, 2019, 35(10): 2003–2013.
June 11, 2019;
September 23, 2019
Supported by: National Natural Science Foundation of China (Nos.31622001, 31671845, 31600068), Natural Science Foundation of Jiangsu Province (No.BK20160176).
Guocheng Du. Tel/Fax: +86-510-85918309; E-mail: gcdu@jiangnan.edu.cn
国家自然科学基金 (Nos.31622001, 31671845, 31600068),江苏省自然科学基金(No.BK20160176)资助。
(本文责编 郝丽芳)
