典型工业发酵过程环境变化下的细胞自适应行为与系统优化
2019-10-31丁健罗洪镇史仲平
丁健,罗洪镇,史仲平
典型工业发酵过程环境变化下的细胞自适应行为与系统优化
丁健1,罗洪镇2,史仲平1
1 江南大学 生物工程学院,江苏 无锡 214122 2 淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003
工业发酵过程中,当细胞遭受到极端环境胁迫或剧烈环境变化时,细胞必须要作出必要的举动来适应环境的剧烈变化。细胞的自适应行为有可能不能应对剧烈的环境变化,导致发酵失败;但也有可能产生意想不到的效果,改善发酵性能。文中以毕赤酵母生产异源蛋白和丁醇发酵过程为例,阐述了环境变化条件下的细胞自适应行为及其基于自适应行为的发酵过程优化方法和策略,为利用基于细胞自适应行为的发酵过程优化提供参考。
细胞自适应行为,环境变化,发酵过程优化,异源蛋白生产,丁醇发酵
工业发酵产业在我国国民经济中占重要地位,如何深化工业发酵的内涵和外延是发酵领域科研工作者需要深思的重要问题。近年来,通过先进生物技术的创新实现工业发酵的系统优化得到了广泛关注,而微生物菌株是工业发酵的核心要素。但是,在工业发酵过程中,操作模式经常需要进行改变(如温度、底物切换、操作环境、环境胁迫等),微生物细胞必须对上述环境变化作出适应,以确保自我生存。上述细胞自适应行为将导致细胞内部基因转录、关键生物酶活性、代谢流、电子流等发生变化,并最终在发酵性能上得到体现。有时发酵性能可以得到提高,有时则恶化。如何充分利用“细胞自适应行为”,改善或稳定发酵性能是本综述所要探讨的主要内容。
1 环境变化下的细胞自适应行为与系统优化
1.1 环境变化下的细胞自适应行为
细胞自适应行为有两种类型:1) 隐性自适应,也就是说即使由于细胞自适应、其内部结构发生了变化,但表观发酵参数却没什么变化[1-2],很长时间以后发酵性能的差异才能得到体现;2) 显性自适应,当环境条件或操作变量发生后,表观发酵参数很快就会发生显著变化。比较典型的例子包括:在高浓度乙醇连续发酵过程中,将稀释速率直接设定为0.04 h−1,发酵过程可以达到稳态;而将稀释速率由0.027 h−1切换至0.04 h−1后,过程则在较短的时间内进入到周期振荡状态[3];在丁醇发酵进入产酸期后添入废弃毕赤酵母处理悬浊液,发酵产气量迅速大幅增加[4]。细胞的这种自适应行为对于提高发酵性能指标,有时是有利 的[3-4],有时则是有害的,必须通过一定的控制手段将其抑制或排除,以确保发酵性能的稳定[2]。
1.2 利用细胞自适应行为的过程优化
利用细胞的这种自适应行为改善发酵过程性能是可能的。以显性自适应行为为例,在高浓度乙醇连续发酵过程中,细胞自适应所引发的周期振荡状态可以降低残糖浓度、提高乙醇平均浓度和生产强度[3]。在利用带遗传质粒的酿酒酵母分批补料发酵生产b-半乳糖苷酶时,利用周期控制策略强行将葡萄糖浓度从“过量”向“匮乏”的状态进行切换,并重复4–5个周期,可将细胞遗传质粒的脱落率控制在较低水平,提高b-半乳糖苷酶的产量[5]。具有隐性自适应特征的发酵过程也可以利用数据聚类、代谢分析等手段[1-2]找出原因后,对有害的细胞自适应行为加以抑制,同样也可以优化发酵过程[2]。
2 利用细胞自适应行为的优化
2.1 毕赤酵母高效生产异源蛋白
甲醇营养型毕赤酵母能够在以甲醇为唯一碳源的条件下生长,基于这一特性开发出的表达系统是一种应用广泛的异源蛋白表达系统。毕赤酵母蛋白表达系统通过诱导醇氧化酶启动子(Alcohol oxidase,AOX)进行异源蛋白的合成。在异源蛋白表达过程中,甲醇起着碳源、能源和诱导剂的三重作用。与大肠杆菌等原核表达系统相比,毕赤酵母表达系统除了具有遗传操作简单、细胞生长快、易于培养等原核生物的特点外,还具有真核生物特有的加工、修饰蛋白的功能。毕赤酵母表达系统具有表达效率高、外源基因遗传稳定、易实现高密度培养、蛋白翻译后可被正确加工、蛋白产物分泌于胞外等众多优点,已经成为极受青睐的外源蛋白表达宿主,产品种类涉及药物蛋白、抗体、酶制剂、食品添加剂等。毕赤酵母表达宿主菌株主要包括两种表型,即甲醇利用慢型菌(MutS) 和甲醇利用快型菌(Mut+)。Mut+型菌的AOX由1和2基因共同编码,胞内AOX活性高、细胞利用甲醇速度快;而MutS型菌1基因缺失,AOX仅由2一个基因编码,因此其胞内AOX活性较低,细胞利用甲醇的速度较慢。
典型的、利用重组毕赤酵母高密度培养生产异源蛋白的发酵过程可以大致分为细胞培养和甲醇诱导两个阶段。在培养阶段,适宜的环境条件(如溶解氧浓度DO、甘油浓度等) 是细胞快速生长,同时保证细胞以较高生理活性状态进入诱导阶段的前提条件[6]。诱导阶段中的环境条件(如温度、甲醇浓度、DO等) 则决定了异源蛋白的表达水平[7-9]。毕赤酵母对培养和诱导阶段环境的综合自适应调节能力决定了细胞自身的生理状态,并最终影响到异源蛋白的转录、翻译、折叠、分泌,特别是最终的发酵性能指标。
2.1.1 细胞高密度培养条件下异源蛋白表达主要抑制物乙醇的控制方法
在使用MutS型毕赤酵母表达猪a干扰素(pIFN-a) 的过程中,即便采用相同的甘油流加策略和甲醇诱导控制策略,发酵性能也会表现出很大的差异[1]。“正常发酵”批次的pIFN-a抗病毒活性在106–107IU/mL,而“异常发酵”批次的pIFN-a抗病毒活性只有105IU/mL,甚至更低。
在细胞培养阶段,所有10个发酵批次的DO变化、最终细胞浓度和甘油耗量是基本一致的。将诱导期内的各种表观数据的组合(O2摄取速度OUR、CO2释放速度CER、呼吸商RQ、甲醇浓度和流加速度) 在二维平面上进行聚类分析发现,“正常”发酵批次的表观数据基本聚类于几个特定区域,而“异常”发酵批次的表观数据则散落于平面的各处(图1)。
葡萄糖效应(Crabtree effect) 是细胞高密度培养时普遍存在的现象。有报道指出,在重组酿酒酵母和大肠杆菌表达外源蛋白的过程中,葡萄糖过量流加会导致代谢副产物乙醇和乙酸的积累,这本身就是细胞对于培养环境的一种隐性自适应行为,其结果最终导致目标蛋白表达水平和发酵稳定性显著下降[10–11]。即便乙醇或乙酸被耗尽,这种发酵性能恶化也无法避免。细胞长时间处在高乙醇或高乙酸浓度环境,其功能骨架受到严重破坏,进而抑制目标产物的表达,而且这种抑制作用还是不可逆的。重组菌功能骨架因代谢副产物的严重积累而受到破坏是一种典型的和具有负面效应的“细胞隐性自适应”现象。因此,必须在细胞培养期遏制住上述“细胞隐性自适应”现象,才能保证发酵性能的稳定。

图1 诱导期“正常”和“异常”发酵批次的表观(在线测量)数据在二维平面上的聚类(纯甲醇诱导)
毕赤酵母表达pIFN-a过程中,上述“细胞隐性自适应”行为(葡萄糖效应) 也会出现。在细胞流加培养期,使用传统DO-Stat甘油流加策略时,某些批次的最终pIFN-a浓度也可以达到相当高的水平。如批次#1,最大乙醇浓度相对较低 (4.37 g/L) 且细胞处于高乙醇浓度环境的时间比较短(图2,表1)。有时乙醇浓度高(7.08 g/L) 且细胞处于高乙醇浓度环境的时间较长,进入诱导期后AOX根本无法正常启动,pIFN-a浓度很低(批次#3)。pIFN-a发酵性能不稳定的原因就在于此。商业化的甲醇电极,可以同时在线检测甲醇和乙醇:细胞培养阶段发酵液只含有乙醇;进入到诱导阶段后,由于前期积累的乙醇全部消耗殆尽,发酵液中仅含有甲醇。因此,甲醇电极可以分别用于在线检测细胞培养阶段的乙醇和诱导阶段的甲醇浓度,且互不干扰。在此基础上,提出了一种基于乙醇/DO在线测量的“改良型”DO-Stat甘油流加控制策略,根据乙醇浓度测量值自动调节DO-Stat策略的流加延迟时间,交替利用甘油和积累的乙醇作为碳源,可以将培养期内的乙醇浓度控制在任意水平。控制乙醇浓度在低水平(约2.0 g/L),则AOX被激活,pIFN-a表达顺利稳定地进行;控制乙醇浓度在高水平(约10.0 g/L),则AOX被抑制,pIFN-a表达无法进行(图2, 表1)。高效稳定的pIFN-a表达控制策略得到了实验验证[2]。
2.1.2 联合操控DO和甲醇诱导浓度促进异源蛋白表达
在确保重组菌达到高密度,且其功能骨架完整健全后,发酵就进入到甲醇诱导阶段。诱导阶段的主要目标就是通过合理地控制诱导条件,实现目标产物产量或活性的最大化。甲醇诱导体系的一个最主要的特征就是高耗氧,甲醇浓度和溶解氧浓度DO是影响诱导性能和目标代谢产物表达水平的主要操作或控制参数。甲醇消耗与O2消耗相互耦联,在使用空气的条件下很难同时将甲醇和DO控制在相应的设定水平。这时,只能选择其中一个参数并将其优先控制于设定水平。因此,可行的甲醇和DO控制模式就只有以下两种,即“高甲醇浓度/低DO”或“高DO/低甲醇浓度”。Mut+和MutS型的毕赤酵母是两种最常用的表达宿主,但是,两种模式菌株对不同控制环境的自适应行为是不同的[12-15],难以形成统一的最优控制标准。有研究者针对利用Mut+和MutS型毕赤酵母表达目标产物提出了不同的、但具有一定普适效果的DO/甲醇浓度“次优(Sub-optimal)”联合操控方案,并对“次优控制”条件下的细胞自适应行为与系统优化机理进行了归纳总结[16–17]。

图2 使用不同甘油流加控制策略时,培养期内的乙醇、DO、甘油流加速度和细胞浓度的变化模式

表1 不同控制策略下的猪a干扰素的发酵性能和甲醇代谢关键酶的基因转录水平
Note: 1) †: Refers to the gene transcriptional data collected at 40 h after initiating methanol induction; 2) Methanol/sorbitol co-feeding induction mode was adopted; 3) Methanol/sorbitol co-feeding ratio of 1:1 was applied for runs #1–#7, but 4:1 for run #8; 4) N/A presented no measurements.
MutS和Mut+型毕赤酵母在“高甲醇/低DO”和“高DO/低甲醇”诱导模式下显示出不同的显性自适应行为表征。有研究[16-17]以一株产人血清白蛋白-人粒细胞集落刺激因子突变体融合蛋白(HSA- GCSFm) 的Mut+型和一株产pIFN-a的MutS型重组毕赤酵母为模式菌株,探讨了二者在“高甲醇/低DO”和“高DO/低甲醇”模式下的发酵性能差异,并与文献结果[12-13,18-21]进行了综合分析比较。对Mut+型毕赤酵母而言,通过限制甲醇流加的方式可将DO控制在10%左右,此时甲醇浓度降低到接近于0 g/L的水平,形成了“高DO/低甲醇”的诱导环境,诱导50 h后HSA-GCSFm浓度达到587.5 mg/L。而利用在线甲醇电极将甲醇浓度控制在5–8 g/L的较高水平,由于甲醇供应充足、耗氧剧烈,DO迅速降至接近于0%的低水平,形成了“高甲醇/低DO”的诱导环境,诱导50 h后HSA-GCSFm浓度仅有88.5 mg/L。但是,MutS型菌却表现出与Mut+型菌截然相反的特性:同样,在限制甲醇流加的条件下,可将DO控制在10%左右,甲醇浓度自然降低到接近于0 g/L的水平,形成了“高DO/低甲醇”的诱导环境,但诱导70 h后pIFN-a浓度仅有0.79 g/L。而将甲醇浓度控制在5–8 g/L的较高水平,DO自然降低到接近于0%的低水平,形成“高甲醇/低DO”的诱导环境,诱导70 h后pIFN-a浓度则高达1.86 g/L。
Mut+型毕赤酵母生产异源蛋白时,用限制碳源流加的方式来提高DO水平,甲醇浓度虽然很低,但细胞消耗利用甲醇速率的变化不大(仅降低10%左右),这增加了甲醇利用效率,促进了异源蛋白的高效表达。而MutS型毕赤酵母生产异源蛋白时,限制碳源流加虽然提高了DO水平,但同时会导致甲醇消耗速率大幅下降(超过50%),进而减少异源蛋白合成过程所需的碳源供给,显著降低了异源蛋白的表达水平。以上结果总结归纳在表2中,总的结论就是:Mut+型毕赤酵母的“次优诱导控制”策略是“高DO/低甲醇”;而MutS型毕赤酵母的“次优诱导控制”策略则是在“高甲醇/低DO”。从转录组学分析的角度研究了Mut+型和MutS型毕赤酵母应对不同“次优控制”诱导环境的自适应调节机制:Mut+型菌在“高DO/低甲醇” (甲醇/山梨醇共混诱导) 的诱导环境下,上调的基因主要集中在甲醇主代谢、TCA循环和过氧化物酶体合成途径中,下调的基因则主要集中在蛋白水解过程中。表明在该诱导条件下,甲醇和山梨醇的代谢活性高,细胞抗高DO冲击能力强,错误折叠的蛋白减少。而MutS型菌在“高甲醇/低DO”的诱导环境下,上调基因主要集中于甲醇代谢、过氧化物酶体合成和核糖体蛋白合成途径中,甲醇代谢和异源蛋白合成得到促进[17]。
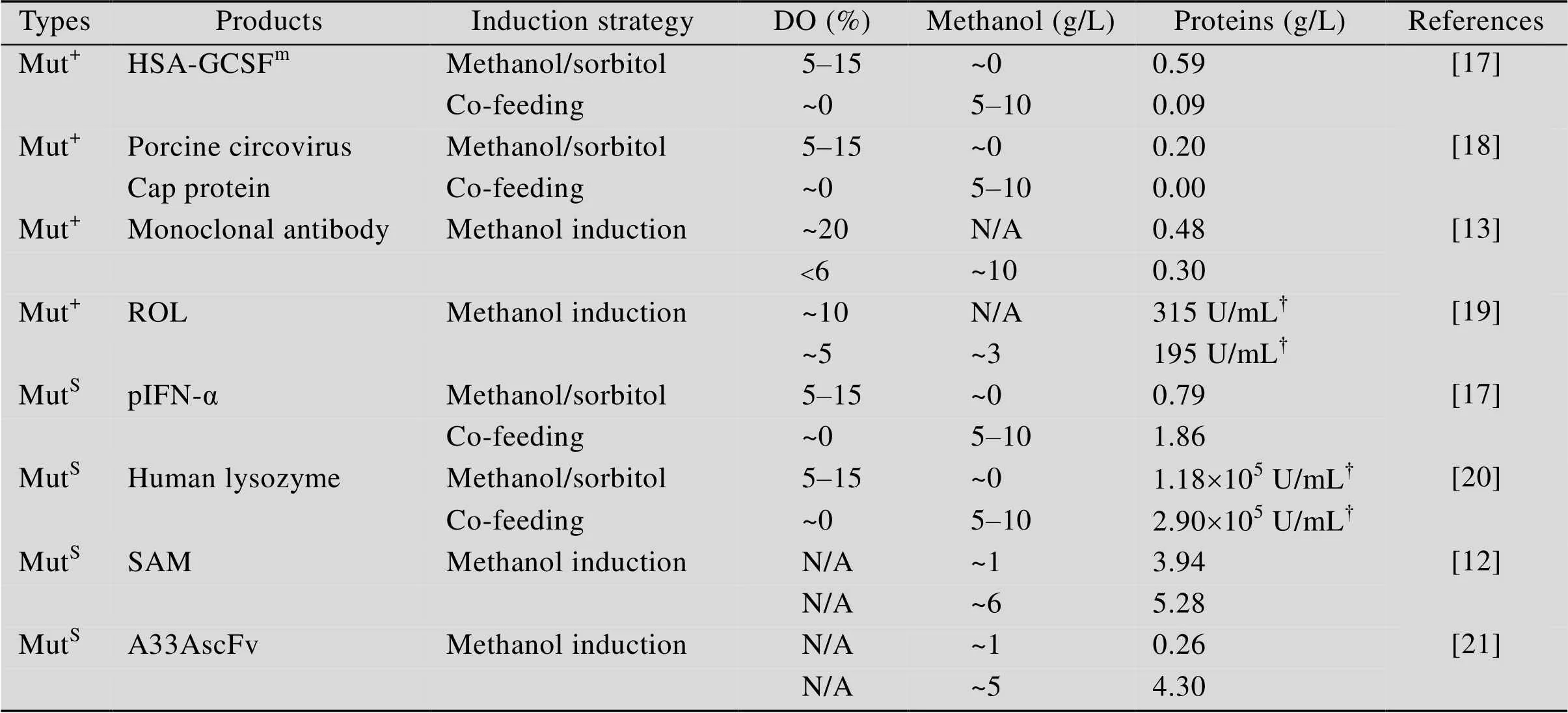
表2 “高甲醇浓度-低DO”和“低甲醇浓度-高DO”诱导模式下Mut+和MutS型毕赤酵母异源蛋白表达量比较
Note: 1) N/A represented that the data not found; 2)†: Using the enzymatic data to replace the concentrations data.
2.1.3 甲醇浓度周期控制强化MutS型毕赤酵母表达外源蛋白
将状态变量(如浓度、比生长速度、底物比消耗速度等) 定值控制在恒定水平,是实现发酵过程优化的普遍控制方法。但是,周期控制(Periodic control),无论是自发式的[22]还是强制式的[5],在某些特定情况下比定值控制具有优势。所谓周期控制,就是将状态变量以一定的频率在两种不同的状态之间反复切换,并具有一定数量的周期重复循环次数。
周期控制在发酵过程控制领域也有一定的应用和研究报道[4-5,23-24]。实际上,周期控制与细胞自适应行为和基于自适应行为的过程优化密切相关。比如,Ye等[23]利用费氏丙酸杆菌发酵生产维生素B12,发现细胞在厌氧环境中生长较快,但是长期在厌氧环境中培养,生成的丙酸浓度较高,会抑制细胞生长。细胞长期处在有氧环境下会造成细胞生长速率和产物合成大幅下降。因此,采用一种周期性的、在有氧和厌氧环境进行切换的操作方法来解决上述问题。与传统厌氧发酵相比,利用上述“周期控制”发酵的细胞浓度提高了189%,丙酸控制在较低水平(5.08 g/L®2.78 g/L),维生素B12产量提高了 1倍左右。马善康等[24]通过大幅改变发酵环境,利用双碳源(甲醇和甘油) 交替刺激毕赤酵母高效表达人尿激酶原,5 L罐上的发酵结果表明,与对照相比(单纯流加甲醇),双碳源交替刺激法的人尿激酶原酶活可以提高57%。
MutS型毕赤酵母嗜好“高甲醇/低DO”的诱导环境,在利用MutS型毕赤酵母表达生产pIFN-a和人源溶菌酶(hLYZ) 的过程中,通常将甲醇浓度控制在5–10 g/L。但是如果细胞长期处于“高甲醇/低DO”的诱导环境,由于O2匮乏,由AOX催化的甲醇代谢的第一步反应(甲醇+O2®甲醛) 成了律速反应步骤。这时,甲醇(有毒物质) 不断地跨膜进入细胞体内,却又无法高效消耗利用,胞内积累严重,最终造成细胞代谢活性和目标蛋白合成能力逐步下降,限制了目标产物诱导表达效率的提升。为解决这一问题,有研究提出了一种新颖的周期甲醇诱导控制策略,并将其用于MutS型毕赤酵母表达生产pIFN-a和hLYZ的过程中[25]。研究的基本思路如图3所示。使用传统的“高甲醇/低DO”诱导策略,甲醇和DO长时间处于高浓度和低浓度,会造成毒性物质甲醇在胞内的积累;而在“高DO/低甲醇”的极端诱导环境下,细胞可以吸收并有效利用胞内的毒性物质甲醇合成目标产物。甲醇周期诱导控制就是利用上述两种极端诱导环境下的细胞自适应特性,在“高甲醇/低DO”的诱导环境下,增强诱导强度(T1= 7 h);而在“高DO/低甲醇”的诱导环境下,旨在解除胞内甲醇毒性作用,恢复细胞的代谢活性(T2=4 h)。图5对每一完整控制周期内的T1和T2进行了优化。以此循环往复,持续5–6个周期。相比于传统的定值控制策略(甲醇浓度和DO定值控制),使用该甲醇周期控制策略进行甲醇诱导,两种目标蛋白的产量和活性都有大幅提升。表达生产pIFN-a时,使用传统的甲醇浓度定值控制策略(8–10 g/L),胞内甲醇浓度最高可达0.014 g/g DCW,诱导后期pIFN-a不能持续表达。而使用周期诱导控制时,甲醇诱导强度并没有受到太大影响,胞内甲醇浓度控制在极低水平(≤0.003 g/g DCW),pIFN-a抗病毒活性达到水平3.90×107IU/mL,比使用“甲醇浓度定值控制”策略时提高了86%,与低温、通纯O2进行甲醇诱导时的水平相当[26](图4)。代谢强度(OUR、CER) 维持在较高水平,甲醇比消耗速率也有提高。表达生产hLYZ时,使用周期诱导控制也可将胞内甲醇浓度控制在低水平,最终hLYZ酶活达到2.15×105IU/mL,比使用“高甲醇/低DO”诱导控制策略提高了69%。周期诱导控制策略能提高MutS型毕赤酵母生产异源蛋白的通用性得到了一定程度的验证。甲醇周期诱导控制策略有效整合了“高甲醇/低DO”和“高DO/低甲醇”两种极端诱导环境下细胞自适应行为的优点,使得目标蛋白的产量和活性得到大幅改善。

图3 甲醇周期诱导控制提高发酵性能的概念图
2.2 丁醇 (丙酮A-丁醇B-乙醇E,ABE) 发酵过程中的细胞自适应行为及其优化
丁醇和丙酮都是重要的平台化合物。另外,它们也都是清洁/高效的液态燃料或燃料添加剂。丁醇作为燃料添加剂使用时,其许多性能均优于乙醇[27-31]。丙酮也是高效的柴油助燃剂,可以大幅改善柴油的燃烧性能,燃烧后产生的尾气中SOX和NOX含量低[32-33]。丙酮是丁醇发酵的主要副产物(丁醇60%、丙酮30%)。随着化石资源的日益枯竭,微生物发酵法生产丁醇和丙酮重新受到人们的重视。目前国内外科研人员对丁醇发酵的研究主要包括代谢工程改造微生物细胞、利用廉价原料发酵生产丁醇、通过分离耦合技术解除丁醇对微生物细胞的抑制作用以及发酵过程优化与控制策略改善丁醇发酵性能等。关于上述几个方面的相关综述和成果最近几年已有较多论文发表[34-35],在此不再赘述。这里,主要针对丁醇发酵过程环境变化下的细胞自适应行为与系统优化方面进行探讨,为丁醇发酵过程优化提供新的思路和参考。
2.2.1 电子受体添加条件下的梭菌生理代谢自适应特征以及丁醇合成的强化
提高丁醇产量、丁醇/丙酮比或丁醇占总溶剂比例是改善丁醇发酵性能的主要目标。添加电子载体(如中性红、甲基紫等) 可导致丙丁梭菌胞内的代谢流发生变化,是提高丁醇/丙酮比的比较公认的手段[36],但是,丁醇/丙酮比的提升实际上是以降低丙酮浓度或总ABE浓度为代价的。另外,电子载体一般是对细胞有毒的化学染料或色素,其添加增加了产品分离纯化过程的操作成本。
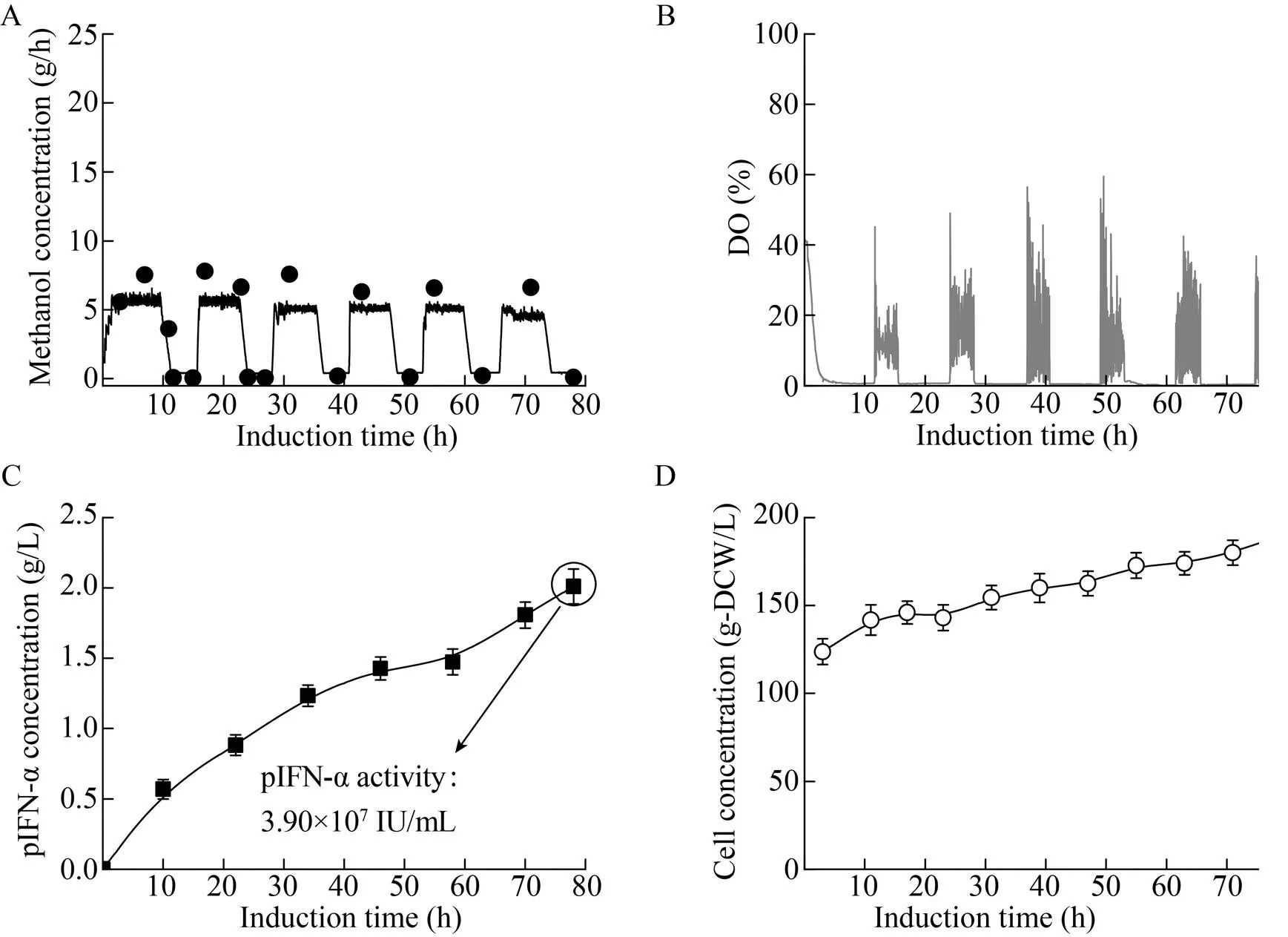
图4 甲醇周期控制策略下的pIFN-a发酵性能

图5 理论确定每一诱导周期内的T1和T2
最近,有研究提出了电子受体添加策略强化丁醇合成的新型发酵策略[37]。外添Na2SO4/CaSO4等电子受体后,梭菌胞内发生硫还原反应,少量的SO42–被还原成H2S。该反应打破了胞内H+/e–的原有平衡,造成e–相对过剩和H+相对匮乏。这时,细胞为了自身正常生存,必须要恢复H+/e–的原有平衡。在梭菌胞内电子穿梭传递系统中,NADH再生反应和H2合成反应都需要H+和e–,并因此产生竞争。但NADH再生反应中e–的需求量是H2合成反应中e–需求量的2倍,在H+相对匮乏的情况下,为了消耗过量的e–,更多的e–/H+(电子/质子对) 必须向NADH再生途径迁移,使得丁醇合成得到强化(图6)。在此过程中,细胞应对环境变化的自适应行为得到了充分体现。7 L厌氧发酵罐下,当发酵进入到产溶剂期后,在发酵液中添加2.0 g/L的CaSO4或Na2SO4,最终丁醇浓度分别达到12.80 g/L和12.94 g/L,比不添加电子受体的发酵批次的相应值提高35%左右,丁醇/丙酮比也有一定幅度的增加(15%)。添加Na2SO4等廉价电子受体提高了丁醇浓度,虽然提高幅度有限,但通过合理地利用细胞自适应行为,可为改善丁醇发酵性能提供一条新的途径和优化模式。

图6 电子受体添加条件下的丙丁梭菌代谢简图
2.2.2 梭菌/酿酒酵母混菌培养改善丁醇发酵性能
混菌培养作为一种重要的发酵技术,广泛应用于食品生产、生物降解和生物燃料生产等领域。近几年,在实验室规模,研究者们已经将混菌培养技术用于丁醇的发酵生产。Tran等[38]将丁酸梭菌和枯草芽孢杆菌进行混菌培养,由于芽孢杆菌分泌a-淀粉酶,并在其生长过程中消耗培养液中的氧气,而自产的a-淀粉酶可以将淀粉分解为单糖,在无需对可溶性淀粉进行预处理的前提下改善了丁醇的发酵性能。Li等[39]将拜氏梭菌和酪丁酸梭菌混合培养,拜氏梭菌可以将酪丁酸梭菌产生的丁酸直接用于丁醇合成。在某些混合培养体系中,“辅菌”被置于恶劣的生存环境之下。“辅菌”为了生存,通过其自适应行为被迫释放出某些有益于“主菌”生存或代谢的物质或辅因子,而“主菌”则通过充分利用上述物质,提高其自身的发酵性能。Ashe等[40]发现,在10 g/L的高浓度丁醇环境下,酿酒酵母会发生适应性改变,胞内翻译过程中的真核起始因子2B活性被抑制,胞内氨基酸存留在“氨基酸池”中。如果将酿酒酵母置于高丁醇胁迫环境下,使其从“氨基酸池”中分泌一定量的有益于丁醇合成和梭菌耐受生存的氨基酸,将有望提高丁醇发酵性能。
基于以上分析,Luo等提出了混菌培养丁醇发酵策略:当丁醇发酵进入到产溶剂期后,添加少量活性酿酒酵母(辅菌,0.2 g DCW/L)。酿酒酵母在恶劣的生存环境(37 ℃、严格厌氧) 下,可释放出苯丙氨酸、酪氨酸、蛋氨酸和赖氨酸 4种有益于丁醇合成的氨基酸,但释放量(浓度) 有限;总葡萄糖消耗速度提高,但梭菌(主菌) 的葡萄糖消耗速度反而有所下降;总ABE产量提高,ABE产量的提高完全得益于乙醇浓度的大幅上升(2.0–3.0 g/L®8.4 g/L),混菌培养的优越性没有得到体现。于是,在添加活性酿酒酵母的同时外添4.0 g/L的丁酸,这时,丁醇发酵性能得到了极大的改善。首先,在丁醇/丁酸同时存在的情况下,酿酒酵母生存环境更加恶劣,被迫释放出更多的上述4种“有益”氨基酸,氨基酸浓度大幅度提高,可以进入到梭菌胞内,强化梭菌对高丁醇浓度环境的耐受能力;其次,丁酸的添入压制住了酿酒酵母的乙醇合成和对葡萄糖的消耗;最后,丁酸虽然是丁醇的合成前体之一,但它对梭菌细胞具有毒性。丁酸进入梭菌胞内后,必须通过代谢反应Butyrate®Butyryl-CoA®Butanol将其排出胞外,而Butyryl-CoA®Butanol这步反应又依赖于NADH。过量的NADH需求,必然诱发和刺激梭菌对葡萄糖的利用消耗和NADH的再生(速率)。以上因素造就了如下结果:在7 L厌氧发酵罐中,实施上述“丙丁梭菌/酿酒酵母混菌培养耦联丁酸外添”的发酵策略(图7),丁醇浓度从对照的11.63 g/L大幅提高至15.74 g/L,丁醇/丙酮比也从对照的1.98猛增至2.83[41]。为降低发酵成本,使用酪丁酸梭菌厌氧发酵浓缩液替代化学合成丁酸,丁醇浓度可提高到16.34 g/L的最高水平,丁醇/丙酮比达到3.02[42]。充分利用“主菌”和“辅菌”的自适应举动,极大地提高了丁醇发酵的性能。
2.2.3 调控还原力再生速率提高丙酮生物合成和丙酮/丁醇比
丁醇是丁醇发酵或ABE发酵的主产物,提高丁醇浓度和丁醇/丙酮比是ABE发酵的首要性能指标。但是,在维持原有丁醇浓度基本不变的基础上,提高主要副产物丙酮浓度也可以认为是改善ABE发酵性能的另一个重要指标[43]。目前,自然界中还没有专一性合成丙酮的微生物,从生命周期评价(LCA) 角度上看,强化ABE发酵中丙酮合成具有显著的环保和工业需求意义[44–46],还可以实现ABE发酵的产品多样化。
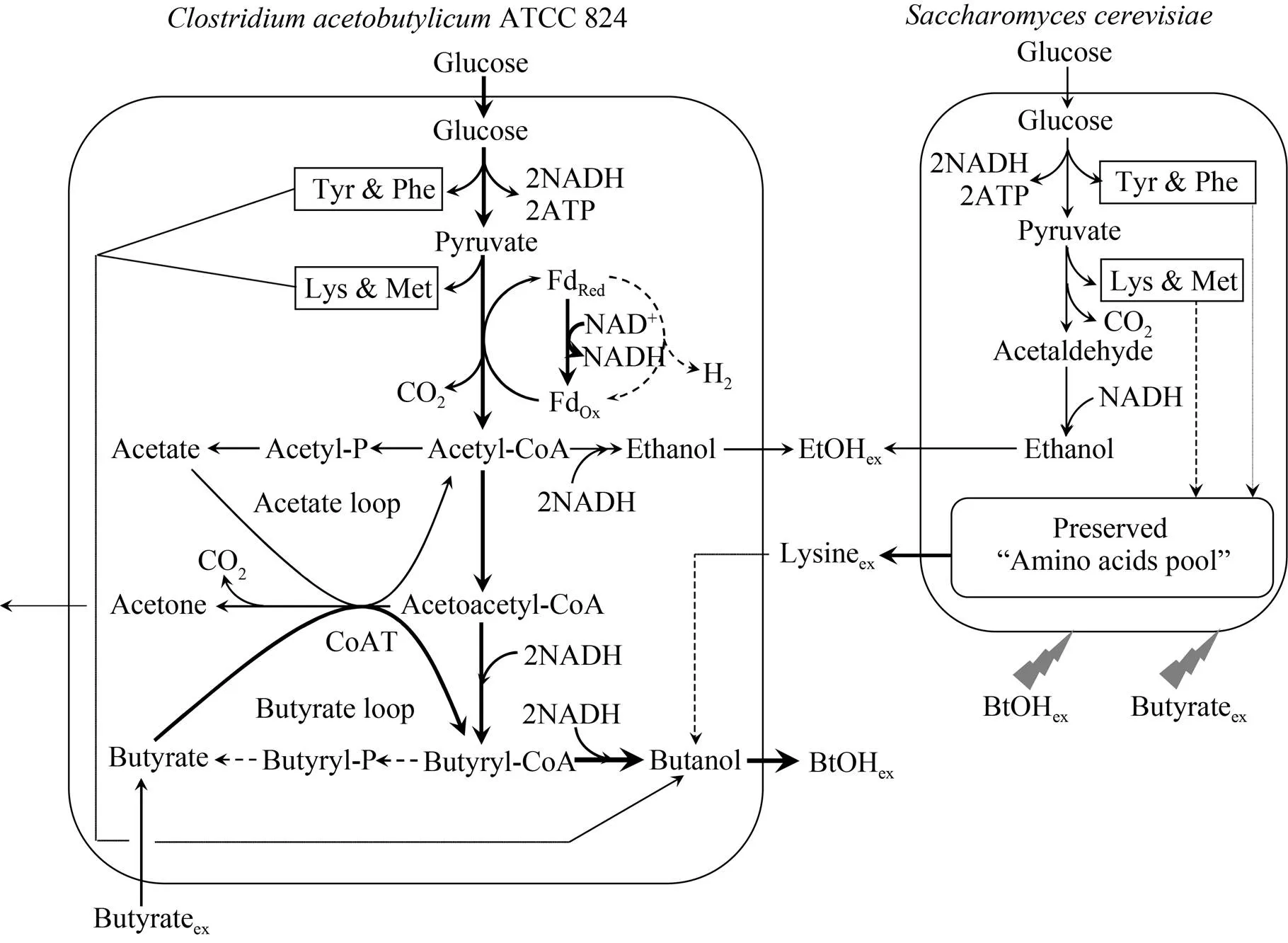
图7 丙丁梭菌/酿酒酵母混合培养外添少量丁酸体系下的ABE发酵代谢网络简图
有研究提出了“混菌培养同时外添少量乙酸(4.0 g/L) 的高效合成丙酮的ABE发酵策略”[47]。与“丙丁梭菌/酿酒酵母混菌培养耦联丁酸外添”的发酵策略基本类似,该策略也可以充分利用“主菌”和“辅菌”的自适应举动,改善ABE发酵性能,在此不再赘述。与后者唯一不同的是:外添的乙酸可以直接通过反应途径Acetate®Acetyl-CoA®Acetoacetyl-CoA®Acetone合成丙酮,而无需NADH的参与;乙酸对梭菌细胞也具有毒性,但其毒性小于丁酸,外添乙酸可以适度降低梭菌的葡萄糖消耗速度和NADH再生速率,使较多碳流走向不依存NADH的丙酮合成途径,造成丁醇和丙酮比例的改变;适中的NADH再生速率还可以缓解细胞能量周转负荷,延长有效发酵时间。在7 L厌氧发酵罐中实施“混菌培养外添少量乙酸的ABE发酵策略”,丙酮和丁醇浓度同时达到8.27 g/L和13.91 g/L的较高水平,分别比对照提高了41%和20%。在此基础上,Luo等[48]又提出了“葡萄糖受限条件下葡萄糖/乙酸双底物耦联混菌培养”的更加新型的高效丙酮发酵策略。该策略可以将丙酮浓度和丙酮/丁醇比自由控制在6–12 g/L和0.5–1.0之间,最大丙酮浓度和丙酮/丁醇比达到了11.74 g/L和1.02,且丁醇浓度不受影响。上述策略为ABE发酵的产品多样化和供需灵活化等目标的实现提供了重要信息。
2.2.4 使用废弃酵母进行丁醇发酵实现玉米原料的资源化和生物质废料的减量化
利用玉米原料生产丁醇存在原料成本高和与人争粮的问题,用廉价基质替代或部分替代粮食原料是目前解决该问题的有效方法。目前这方面的研究主要集中在利用秸秆、木屑等农业废弃物发酵生产乙醇和丁醇等液态燃料方面。2.1章节所论述的高密度毕赤酵母细胞(400 g-DCW/L,干物质约35%) 属于难以处理的半固态废弃生物质,严重污染环境,但却拥有农业废弃物所不具备的高能量密度化特征,其组成除了含有36%的多糖(碳水化合物) 外,还含有46%的蛋白质(氮源) 和12%的脂肪等物质[49]。利用废弃毕赤酵母部分替代玉米原料也颇具发展前景。
有研究报道显示,用NaOH处理半固态废弃酵母,形成废弃酵母处理悬浊液,并在ABE发酵进入产溶剂期后向玉米粉培养基发酵液中投入悬浊液,发酵产气量增加约30%,有机酸积累量最大提高了近300%,总糖(以葡萄糖为结构单位)利用效率从低于50%提高到超过90%的水平,这是一个典型的具有显性自适应特征的发酵过程。这种细胞自适应行为或特征极大地改善了丁醇发酵性能,特别是整个发酵体系的资源化率(玉米淀粉/固态废弃酵母) 和半固态废弃酵母的减量化率[4,50]。这种显性的细胞自适应特征行为显著改善丁醇发酵性能和促进半固态废弃酵母的利用主要得益于:1) 投入废弃酵母处理液后所自然形成的高SO42–和氨基酸浓度环境(在酸碱中和与蛋白质分解中产生),根据章节2.2.1和2.2.2所述,上述因素均有利于丁醇合成;2) 丙丁梭菌有分泌糖化酶的能力,减少初始玉米粉用量、并在葡萄糖浓度降低到较低水平后投入废弃酵母处理液后,糖化酶得到诱导、混合培养基中的二糖/三糖可以得到有效利用,有利于总糖利用效率的提升;3) 废弃酵母处理液的某些特定物质(尚未能确定) 直接刺激了玉米淀粉中多糖和还原糖的利用,这是总糖利用效率大幅提升的最主要原因,还需今后进一步的研究和探索。
2.2.5 木质纤维素预处理抑制物对梭菌生理代谢的干扰及胁迫响应规律
利用来源更广泛的木质纤维素废弃原料进行液态燃料的发酵生产,依旧是相关研究的主流。在利用最常用的稀硫酸法预处理木质纤维素得到可被微生物利用的可发酵糖的过程中,也伴随有弱酸(如甲酸、乙酸、糠醛等)、呋喃类衍生物和酚类物质(如丁香醛、香草醛、香草酸、阿魏酸等) 的产生(图8)[34,51]。上述物质对微生物细胞的正常生理代谢均有抑制作用,导致细胞发生适应性改变。
低浓度糠醛可促进拜氏梭菌利用葡萄糖产丁醇的效率,这与胞内还原力再生有关[52]。随着糠醛浓度的提高,菌株抑制逐渐显现出来,且需要更长的解毒时间用于恢复发酵能力。高浓度的呋喃类物质可以引发丙丁梭菌的DNA损伤和细胞膜结构的破坏,严重扰乱胞内氧化还原平衡,最终导致发酵效能低下。有研究表明[53],预处理过程产生的甲酸会导致丁醇发酵的“酸崩溃”现象的发生,最终造成发酵失败。Cho等[54]评估了六类酚化合物对拜氏梭菌的代谢干扰特征,结果显示当酚类物质的含量达到1.0 g/L时,菌体生长降低64%–74%,丁醇发酵完全停止。丁香醛和香草醛对细胞毒性较小,但对于丁醇合成的毒性却非常高。在另一篇研究报道中[55],对拜氏梭菌BA101毒性最大的酚类物质是阿魏酸,其次是对香豆酸。近期的研究结果表明[56],在合成培养基条件下,添加少量的香兰素或香草酸(0.2 g/L) 可以提高丙丁梭菌的产酸能力,在丁醇浓度基本不变的前提下,实现了有机酸和溶剂的共生产,这主要是由于梭菌为了适应酚类胁迫必须强化菌体和能量物质ATP的合成。这种现象为基于环境变化下的细胞自适应行为的过程优化提供了借鉴。为了揭示发酵抑制物对产溶剂梭菌生理代谢的影响,国内外研究者进行了大量工作。如俄亥俄州立大学的Ezeji教授团队基于转录组学技术首次解析了拜氏梭菌对糠醛的胁迫响应机制[52]。结果表明,在产溶剂期,糠醛的存在使得721个基因出现差异性表达,而这些基因与辅因子水平调控、膜转运、糖代谢、热激蛋白表达等因素关联密切。中国科学院成都生物研究所的赵海研究员团队发现,硫化钠可以解除小麦秸秆水解液对丁醇发酵的抑制作用,并利用基于RNA-seq技术揭示了硫化钠添加后丙丁梭菌CICC8012在转录水平上的变化特征[57]。未来的工作需要分析梭菌胁迫环境下的细胞自适应特征:通过宏观生理生化参数的测定、发酵性能的比较以及系统生物学的分析,进而全局性地揭示发酵抑制物对丁醇合成的影响特征,并明确关键的抑制靶点;通过代谢工程和基因编辑技术提高微生物细胞对抑制物的耐受能力,拓宽产溶剂梭菌对多种可发酵糖的利用能力,最终实现利用木质纤维素原料高效生产丁醇的目标。

图8 木质纤维素预处理过程中产生的各类发酵抑制物
3 总结与展望
围绕“典型工业发酵过程环境变化下的细胞自适应行为与系统优化”这一主题,结合介绍国内外的研究者以及本研究团队在该领域的研究成果,以毕赤酵母高效生产异源蛋白和丁醇发酵过程为例,阐述了环境变化条件下的细胞自适应行为及其基于自适应行为的过程优化方法和策略。目前,基于细胞自适应行为的发酵过程优化方法和策略的研究例证并不很多,发酵性能的提升幅度有限,分子机制研究的还不透彻。这些问题有待今后进一步的深入研究加以解决。
[1] Yu RS, Dong SJ, Zhu YM, et al. Effective and stable porcine interferon-aproduction byfed-batch cultivation with multi-variables clustering and analysis. Bioprocess Biosyst Eng, 2010, 33(4): 473–483.
[2] Ding J, Gao MJ, Hou GL, et al. Stabilizing porcine interferon-α production bywith an ethanol on-line measurement based DO-Stat glycerol feeding strategy. J Chem Technol Biotechnol, 2014, 89(12): 1948–1953.
[3] Shen Y, Ge XM, Bai FW. Impact of fermentation system initial status on oscillations in very high gravity ethanol continuous fermentation process and analysis of fermentation efficiency improvement. Chin J Biotech, 2010, 26(5): 604–609 (in Chinese).申渝, 葛旭萌, 白凤武. 初始条件对高浓度乙醇连续发酵过程的影响及振荡行为提高发酵效率的机理分析. 生物工程学报, 2010, 26(5): 604–609.
[4] Ding J, Xu M, Xie F, et al. Efficient butanol production using corn-starch and wastesemi-solid mixture as the substrate. Biochem Eng J, 2019, 143: 41–47.
[5] Cheng C, Huang YL, Yang ST. A novel feeding strategy for enhanced plasmid stability and protein production in recombinant yeast fedbatch fermentation. Biotechnol Bioeng, 1997, 56(1): 23–31.
[6] Chiruvolu V, Eskridge K, Cregg J, et al. Effects of glycerol concentration and pH on growth of recombinantyeast. Appl Biochem Biotechnol, 1998, 75(2/3): 163–173.
[7] Jahic M, Gustavsson M, Jansen AK, et al. Analysis and control of proteolysis of a fusion protein infed-batch processes. J Biotechnol, 2003, 102(1): 45–53.
[8] Zhang WH, Inan M, Meagher MM. Fermentation strategies for recombinant protein expression in the methylotrophic yeast. Biotechnol Bioprocess Eng, 2000, 5(4): 275–287.
[9] Oliveira R, Clemente JJ, Cunha AE, et al. Adaptive dissolved oxygen control through the glycerol feeding in a recombinantcultivation in conditions of oxygen transfer limitation. J Biotechnol, 2005, 116(1): 35–50.
[10] Lin KH, Iijima S, Shimizu K, et al. Control of gene expression from thepromoter ofwith the aid of a glucose analyser. Appl Microbiol Biotechnol, 1989, 32(3): 313–316.
[11] Johnston W, Cord-Ruwisch R, Cooney M. Industrial control of recombinant.fed-batch culture: new perspectives on traditional controlled variables. Bioprocess Biosyst Eng, 2002, 25(2): 111–120.
[12] Zhang JG, Wang XD, Su EZ, et al. A new fermentation strategy for S-adenosylmethionine production in recombinant. Biochem Eng J, 2008, 41(1): 74–78.
[13] Kim S, Warburton S, Boldogh I, et al. Regulation of alcohol oxidase 1 () promoter and peroxisome biogenesis in different fermentation processes in. J Biotechnol, 2013, 166(4): 174–181.
[14] Bushell ME, Rowe M, Avignone-Rossa CA, et al. Cyclic fed-batch culture for production of human serum albumin in. Biotechnol Bioeng, 2003, 82(6): 678–683.
[15] Charoenrat T, Ketudat-Cairns M, Stendahl-Andersen H, et al. Oxygen-limited fed-batch process: an alternative control forrecombinant protein processes. Bioprocess Biosyst Eng, 2005, 27(6): 399–406.
[16] Jia LQ, Mpofu E, Tu TY, et al. Transcriptional analysis for carbon metabolism and kinetic modeling for heterologous proteins productions byin induction process with methanol/sorbitol co-feeding. Process Biochem, 2017, 59: 159–166.
[17] Jia LQ, Gao MJ, Yan J, et al. Evaluation of the sub-optimal induction strategies for heterologous proteins production byMut+/MutSstrains and related transcriptional and metabolic analysis. World J Microbiol Biotechnol, 2018, 34(12): 180.
[18] Ding J, Zhang CL, Gao MJ, et al. Enhanced porcine circovirus Cap protein production bywith a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy. J Biotechnol, 2014, 177: 35–44.
[19] Ponte X, Montesinos-Seguí JL, Valero F. Bioprocess efficiency inlipase production byunder the control of Pis oxygen tension dependent. Process Biochem, 2016, 51(12): 1954–1963.
[20] Chen SS. High-level expression of human lysozyme in[D]. Wuxi: Jiangnan University, 2018 (in Chinese).陈珊珊. 人源溶菌酶在毕赤酵母中的高效表达[D]. 无锡: 江南大学, 2018.
[21] Damasceno LM, Pla I, Chang HJ, et al. An optimized fermentation process for high-level production of a single-chain Fv antibody fragment in. Protein Expr Purif, 2004, 37(1): 18–26.
[22] Shen Y, Zhao XQ, Ge XM, et al. Metabolic flux and cell cycle analysis indicating new mechanism underlying process oscillation in continuous ethanol fermentation withunder VHG conditions. Biotechnol Adv, 2009, 27(6): 1118–1123.
[23] Ye KM, Shijo M, Jin S, et al. Efficient production of vitamin B12from propionic acid bacteria under periodic variation of dissolved oxygen concentration. J Ferment Bioeng, 1996, 82(5): 484–491.
[24] Ma SK, Li Q, Gu XY. High expression of human pro-urokinase gene inthrough feeding two carbon sources alternatively. Chin J Process Eng, 2002, 2(5): 448–451 (in Chinese).马善康, 李强, 顾小勇. 双碳源交替刺激毕赤酵母高效表达人尿激酶原. 过程工程学报, 2002, 2(5): 448–451.
[25] Yan J, Jia LQ, Ding J, et al. Enhancing pIFN-aproduction byvia periodic methanol induction control. China Biotechnol, 2019, 39(6): 32–40 (in Chinese).严建, 贾禄强, 丁健, 等. 甲醇周期诱导控制强化毕赤酵母生产猪a干扰素. 中国生物工程杂志, 2019, 39(6): 32–40.
[26] Jin H, Liu GQ, Ye XF, et al. Enhanced porcine interferon-aproduction by recombinantwith a combinational control strategy of low induction temperature and high dissolved oxygen concentration. Biochem Eng J, 2010, 52(1): 91–98.
[27] Lee SY, Park JH, Jang SH, et al. Fermentative butanol production by clostridia. Biotechnol Bioeng, 2008, 101(2): 209–228.
[28] Dürre P. Biobutanol: an attractive biofuel. Biotechnol J, 2007, 2(12): 1525–1534.
[29] Dürre P. Fermentative butanol production: bulk chemical and biofuel. Ann N Y Acad Sci, 2008, 1125(1): 353–362.
[30] Han SH, Cho DH, Kim YH, et al. Biobutanol production from 2-year-old willow biomass by acid hydrolysis and acetone-butanol-ethanol fermentation. Energy, 2013, 61: 13–17.
[31] Rice RW, Sanyal AK, Elrod AC, et al. Exhaust gas emissions of butanol, ethanol, and methanol-gasoline blends. J Eng Gas Turbines Power, 1991, 113(3): 377–381.
[32] Wu H, Nithyanandan K, Zhang JX, et al. Impacts of Acetone–Butanol–Ethanol (ABE) ratio on spray and combustion characteristics of ABE-diesel blends. Appl Energy, 2015, 149: 367–378.
[33] Berzin V, Kiriukhin M, Tyurin M. Selective production of acetone during continuous synthesis gas fermentation by engineered biocatalystsp. MAceT113. Lett Appl Microbiol, 2012, 55(2): 149–154.
[34] Maiti S, Gallastegui G, Sarma SJ, et al. A re-look at the biochemical strategies to enhance butanol production. Biomass Bioenergy, 2016, 94: 187–200.
[35] Xue C, Zhao JB, Chen LJ, et al. Recent advances and state-of-the-art strategies in strain and process engineering for biobutanol production by. Biotechnol Adv, 2017, 35(2): 310–322.
[36] Tashiro Y, Shinto H, Hayashi M, et al. Novel high-efficient butanol production from butyrate by non-growingN1-4 (ATCC 13564) with methyl viologen. J Biosci Bioeng, 2007, 104(3): 238–240.
[37] Ding J, Luo HZ, Xie F, et al. Electron receptor addition enhances butanol synthesis in ABE fermentation by. Bioresour Technol, 2018, 247: 1201–1205.
[38] Tran HTM, Cheirsilp B, Hodgson B, et al. Potential use ofin a co-culture withfor acetone-butanol-ethanol production from cassava starch. Biochem Eng J, 2010, 48(2): 260–267.
[39] Li L, Ai HX, Zhang SX, et al. Enhanced butanol production by coculture ofand. Bioresour Technol, 2013, 143: 397–404.
[40] Ashe MP, Slaven JW, de Long SK, et al. A novel eIF2B-dependent mechanism of translational control in yeast as a response to fusel alcohols. EMBO J, 2001, 20(22): 6464–6474.
[41] Luo HZ, Ge LB, Zhang JS, et al. Enhancing butanol production under the stress environments of co-culturing/integrated with exogenous butyrate addition. PLoS ONE, 2015, 10(10): e0141160.
[42] Luo HZ, Zeng QW, Han S, et al. High-efficient n-butanol production by co-culturingandintegrated with butyrate fermentative supernatant addition. World J Microbiol Biotechnol, 2017, 33(4): 76.
[43] Luo HZ. The key technologies of synthesizing typical fermentation products under different substrates feedings/oxygen supply and reductive power regulation strategies[D]. Wuxi: Jiangnan University, 2016 (in Chinese).罗洪镇. 不同底物流加/供氧和发酵还原力调控模式下典型发酵产物合成的关键技术[D]. 无锡: 江南大学, 2016.
[44] Zhou J, Zhang HF, Zhang YP, et al. Designing and creating a modularized synthetic pathway in cyanobacteriumenables production of acetone from carbon dioxide. Metab Eng, 2012, 14(4): 394–400.
[45] Köhler KAK, Rühl J, Blank LM, et al.Integration of biocatalyst and process engineering for sustainable and efficient-butanol production. Eng Life Sci, 2015, 15(1): 4–19.
[46] Wu M, Wang M, Liu J, et al. Life-cycle assessment of corn-based butanol as a potential transportation fuel. Argonne: Argonne National Laboratory, Center for Transportation Research, Energy Systems Division, 2007. http://www.osti.gov/bridge.
[47] Luo HZ, Ge LB, Zhang JS, et al. Enhancing acetone biosynthesis and acetone-butanol-ethanol fermentation performance by co-culturing/integrated with exogenous acetate addition. Bioresour Technol, 2016, 200: 111–120.
[48] Luo HZ, Zhang JS, Wang H, et al. Effectively enhancing acetone concentration and acetone/butanol ratio in ABE fermentation by a glucose/acetate co-substrate system incorporating with glucose limitation and./.co-culturing. Biochem Eng J, 2017, 118: 132–142.
[49] Chen CN. Isolation, purification and bioactivities of polysaccharide from[D]. Dalian: Dalian University of Technology, 2011 (in Chinese).陈超男. 巴斯德毕赤酵母多糖的分离纯化及生物活性研究[D]. 大连: 大连理工大学, 2011.
[50] 日本エネルギー学会. バイオマスハンドブック. 東京: オーム社, 2002: 170.
[51] Baral NR, Shah A. Microbial inhibitors: formation and effects on acetone-butanol-ethanol fermentation of lignocellulosic biomass. Appl Microbiol Biotechnol, 2014, 98(22): 9151–9172.
[52] Zhang Y, Ezeji TC. Transcriptional analysis ofNCIMB 8052 to elucidate role of furfural stress during acetone butanol ethanol fermentation. Biotechnol Biofuels, 2013, 6(1): 66.
[53] Wang SH, Zhang YP, Dong HJ, et al. Formic acid triggers the “Acid Crash” of acetone-butanol-ethanol fermentation by. Appl Environ Microbiol, 2011, 77(5): 1674–1680.
[54] Cho DH, Yun JL, Um Y, et al. Detoxification of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanol production from. Appl Microbiol Biotechnol, 2009, 83(6): 1035–1043.
[55] Ezeji T, Qureshi N, Blaschek HP. Butanol production from agricultural residues: impact of degradation products ongrowth and butanol fermentation. Biotechnol Bioeng, 2007, 97(6): 1460–1469.
[56] Luo HZ, Zheng PL, Xie F, et al. Co-production of solvents and organic acids in butanol fermentation byin the presence of lignin-derived phenolics. RSC Adv, 2019, 9(12): 6919–6927.
[57] Jin YL, Fang Y, Huang MJ, et al. Combination of RNA sequencing and metabolite data to elucidate improved toxic compound tolerance and butanol fermentation offrom wheat straw hydrolysate by supplying sodium sulfide. Bioresour Technol, 2015, 198: 77–86.
Fermentation optimization based on cell self-adaptation to environmental stress – a review
Jian Ding1, Hongzhen Luo2, and Zhongping Shi1
1,,214122,,2,,223003,,
In industrial fermentation processes, bacteria have to adapt environmental stresses. Sometimes, such a self-adaption does not work and will cause fermentation failures, although such adaptation also can generate unexpected positive effects with improved fermentation performance. Our review introduces cell self-adaption to environmental variations or stress, process optimization based on such self-adaptions, with heterologous proteins production byand butanol fermentation as examples. Our review can sever as reference for fermentation optimization based on cell self-adaption.
cell self-adaption, environmental variations, fermentation optimization, heterologous proteins production, butanol fermentation
10.13345/j.cjb.190207
史仲平 江南大学生物工程学院教授、博士生导师。1991年日本名古屋大学工学部获工学博士学位。1991–1995年历任日本九州工业大学情报工学部助教,美国得克萨斯大学校、西弗吉尼亚大学化工系博士后研究员。1995–2002年在美国/加拿大科技公司工作。研究方向:发酵工程、发酵过程控制、代谢工程、生物燃料。获中国石油和化学工业协会及中国轻工业联合会科技进步二等奖3项,发表论文145篇、其中SCI论文81篇。

丁健, 罗洪镇, 史仲平. 典型工业发酵过程环境变化下的细胞自适应行为与系统优化. 生物工程学报, 2019, 35(10): 1986–2002.
Ding J, Luo HZ, Shi ZP. Fermentation optimization based on cell self-adaptation to environmental stress – a review. Chin J Biotech, 2019, 35(10): 1986–2002.
May20, 2019;
July16, 2019
Supported by: National Natural Science Foundation of China (Nos. 21606106, 21808075), Natural Science Foundation of Jiangsu Province (Nos. BK20150127, BK20160162, BK20170459).
Zhongping Shi. Tel/Fax: +86-510-85918292; E-mail: zpshi@jiangnan.edu.cn
国家自然科学基金 (Nos. 21606106, 21808075),江苏省自然科学基金 (Nos. BK20150127, BK20160162, BK20170459) 资助。
2019-08-20
http://kns.cnki.net/kcms/detail/11.1998.q.20190819.1736.001.html
(本文责编 陈宏宇)
