三七总皂苷传递体凝胶剂的制备及其离体皮肤渗透性研究
2019-10-30陈思思郑杭生钱丽梅王俊
陈思思 郑杭生 钱丽梅 王俊
[摘要]目的 制备三七总皂苷(PNS)传递体凝胶剂,并对其体外皮肤渗透性能和滞留特性进行考察。方法 采用薄膜分散法制备PNS传递体,再以卡波姆-940为基质制备PNS传递体凝胶剂;对所制得的PNS传递体凝胶剂的稳定性与安全性进行初步评价;采用Franz擴散池法对PNS传递体凝胶剂进行体外透皮考察(以PNS脂质体凝胶剂为对照组),分别于上样后0.5、1、2、4、6、8、10、12、24、36 h取样,同时于36 h体外透皮试验完成后,取下离体皮肤用于PNS皮肤滞留量测定,以高效液相色谱法测定PNS的皮肤累积渗透量和皮肤滞留量。结果 本研究制得的PNS传递体凝胶剂中各成分的含量分别为:人参皂苷Rg1(1.82±0.13)mg/g、人参皂苷Re(0.33±0.05)mg/g、三七皂苷R1(0.57±0.10)mg/g及人参皂苷Rb1(1.58±0.07)mg/g(n=3)。PNS传递体凝胶剂为细腻半透明浅白色胶体,皮肤刺激性小,在低温[(4±2)℃]和避光条件下稳定性良好。PNS传递体凝胶剂中各成分的36 h皮肤累积渗透量分别为:人参皂苷Rg1(601.70±42.26)μg/cm2、人参皂苷Re(171.45±12.46)μg/cm2、三七皂苷R1(327.23±16.41)μg/cm2及人参皂苷Rb1(397.08±29.61)μg/cm2(n=4),约为PNS脂质体凝胶剂的2.0~3.5倍。36 h后PNS脂质体凝胶剂中各成分的皮肤滞留量分别为:人参皂苷Rg1(8.16±1.60)μg/cm2、人参皂苷Re(3.70±0.72)μg/cm2、三七皂苷R1(5.34±0.95)μg/cm2及人参皂苷Rb1(11.61±1.77)μg/cm2(n=4),约为PNS传递体凝胶剂的2.0~7.0倍。结论 PNS传递体凝胶剂质量稳定,能促进药物的皮肤渗透。
[关键词]三七总皂苷;传递体;凝胶剂;体外透皮试验
[中图分类号] R283.6 [文献标识码] A [文章编号] 1674-4721(2019)8(c)-0007-07
[Abstract] Objective To prepare the Panax Notoginseng Saponins (PNS) Transfersome Gel and evaluate the transdermal permeation and skin deposition in vitro. Methods The PNS transfersomes were prepared by using the thin film dispersion method, and the Carbopol-940 was added as matrix for the preparation of the PNS Transfersome Gel. The stability and safety of the PNS Transfersome Gel was preliminary evaluated. In vitro transdermal experiments were done by Franz diffusion pool method and the PNS Liposome Gel was used as control group. Samples were taken in 0.5, 1, 2, 4, 6, 8, 10, 12, 24 and 36 hours after the preparation was loaded. And the in vitro skin was retained for the determination of the skin deposition quantity of the contents of PNS after the transdermal experiments. The skin cumulative permeated quantity and skin deposition quantity of the contents of PNS were determined by high performance liquid chromatography method. Results The contents of ginseng saponin Rg1, ginseng saponin Re, notoginsenoside R1 and ginseng saponin Rb1 of the PNS Transfersome Gel prepared in this study were (1.82±0.13), (0.33±0.05), (0.57±0.10) and (1.58±0.07) mg/g respectively (n=3). The PNS Transfersome Gel had a promising appearance with low skin irritation. It was stable when protected from light and kept at low temperature ([4±2]℃). The skin cumulative permeated quantity values of ginseng saponin Rg1, ginseng saponin Re, notoginsenoside R1 and ginseng saponin Rb1 of the PNS Transfersome Gel were (601.70±42.26), (171.45±12.46), (327.23±16.41) and (397.08±29.61) μg/cm2 (n=4) respectively after 36 hours, the assayed components in PNS Transfersome Gel were about 2.0-3.5 times of those in the PNS Liposome Gel. While the skin deposition quantity values of ginseng saponin Rg1, ginseng saponin, Re notoginsenoside R1 and ginseng saponin Rb1 of the PNS Liposome Gel were (8.16±1.60), (3.70±0.72), (5.34±0.95) and (11.61±1.77) μg/cm2 (n=4) respectively after 36 hours, the assayed components in PNS Liposome Gel were about 2.0-7.0 times of those in the PNS Transfersome Gel. Conclusion The PNS Transfersome Gel is stable and it can enhance the transdermal permeation efficiency of PNS.
[Key words] Panax Notoginseng Saponins; Transfersome; Gel; In vitro transdermal experiment
三七總皂苷(Panax Notoginseng Saponins,PNS)是中药三七的主要有效成分,PNS主要包括人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re和三七皂苷R1等[1]。研究表明,PNS具有改善血液循环、消炎、镇痛、改善记忆力和抗肿瘤等作用[2-5]。在临床上,PNS已广泛用于治疗软组织损伤,它可通过扩张血管、改善血液循环、消炎止痛等作用,促使损伤部位的生理代谢功能、软骨组织得以修复[6-7]。但目前PNS的市售剂型主要以口服和静脉滴注制剂为主[1,8],由于用药后局部损伤部位的药物浓度较低,当这些制剂用于治疗身体局部软组织损伤时难以充分发挥疗效,反而会增加其不良反应的发生,而药物皮肤应用常可以提高用药部位皮肤下局部组织的药物浓度并有效降低药物的不良反应。
传递体(即柔性纳米脂质体)作为一种高效的经皮给药载体,其相较于普通脂质体拥有更好的皮肤渗透性能[9-11]。近年来,传递体逐渐成为了国内外经皮给药系统研究中的一大焦点[12-18]。本研究以薄膜分散法制备PNS传递体,并将其制成凝胶剂,然后对所制得的PNS传递体凝胶剂进行质量评价及离体皮肤渗透研究,为PNS新型透皮制剂的研究奠定基础,现报道如下。
1仪器与试药
1.1仪器
LC-2130高效液相色谱仪(上海天美公司);LC-2030紫外检测器(上海天美公司);UV-1800紫外可见分光光度计(日本岛津公司);XL2000超声破碎仪(美国MISONIX公司);BX51光学显微镜(日本奥林巴斯);聚碳酸酯径迹蚀刻膜(0.05 μm、0.1 μm,英国Whatman公司);HOMOEX-25高压膜挤出器(上海赫默仕机电科技有限公司);5804R冷冻离心机(德国EPPENDORF公司);10K离心超滤管(美国PALL公司);Nano-ZS90激光粒度仪(英国Malvern公司);JEM-1200EX型透射电子显微镜(日本Jeol公司);TT-8D型药物透皮吸收仪(天津市正通科技有限公司)。
1.2试药
PNS(云南植物药物有限公司,注射级,批号HB2 0081103);人参皂苷Rg1对照品(中国食品药品检定研究院,纯度98.2%,批号110703-201426);人参皂苷Rb1对照品(中国食品药品检定研究院,纯度93.7%,批号110704-201424);人参皂苷Re对照品(中国食品药品检定研究院,纯度89.1%,批号110754-201322);三七皂苷R1对照品(中国食品药品检定研究院,供含量测定用,批号110745-201015);胆固醇(上海艾伟特医药科技有限公司,英文缩略语CH,注射级,批号B40333);维生素E(浙江新和成股份有限公司,英文缩略语VE,批号V20171009);大豆卵磷脂(上海太伟药业有限公司,英文缩略语sbPC,注射级,PC≥70%,批号131002);柠檬烯(吉安市聚鹏天然香料油有限公司,质量分数≥98.3%,批号为140825);柠檬醛(吉安市聚鹏天然香料油有限公司,质量分数≥97.5%,批号141006);乙腈(美国Honeywell公司)为色谱纯;高效液相色谱(high performance liquid chromatography,HPLC)用水为双蒸水;其余试剂均为分析纯。
1.3实验动物
清洁级SD大鼠的体重(180±20)g,由浙江中医药大学动物实验中心提供,合格证号SCXK沪2013-0016。所有动物实验均按照浙江中医药大学动物饲养和使用指南进行。本研究已通过我校实验动物伦理委员会审核批准。
2方法与结果
2.1色谱条件与含量测定方法的建立
2.1.1色谱条件
色谱柱为CNW C18色谱柱(250 mm×4.6 mm,5 μm)。流动相为水(A)-乙腈(B),进行梯度洗脱,梯度比例为:0~12 min,A:81%,B:19%;13~60 min,A:81%~64%,B:19%~36%;61~62 min,A:64%~0%,B:36%~100%。流速为1.0 ml/min;柱温为30℃;检测波长为203 nm;进样量为20 μl[18]。
2.1.2含量测定方法的建立
精密称取人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1对照品适量,加入甲醇溶解并定容,制成人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1四种成分的混合对照品储备液。其中,人参皂苷Rg1的浓度为0.327 mg/ml,人参皂苷Re的浓度为0.0829 mg/ml,三七皂苷R1的浓度为0.0706 mg/ml,人参皂苷Rb1的浓度为0.325 mg/ml。
分别依次精密量取上述人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1四成分的混合对照品储备液0.2、0.5、1.0、2.0、3.0、4.0、5.0 ml,用甲醇定容至5 ml,制得系列浓度的人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1四个成分的混合对照品溶液。其中,人参皂苷Rg1的浓度分别为13.1、32.7、65.4、131.0、196.0、262.0、327.0 μg/ml,人参皂苷Re的浓度分别为3.32、8.29、16.60、33.20、49.70、66.30、82.90 μg/ml,三七皂苷R1的浓度分别为2.82、7.06、14.10、28.20、42.40、56.50、70.60 μg/ml,人参皂苷Rb1的浓度分别为13.0、32.5、65.0、130.0、195.0、260.0、325.0 μg/ml。
按“2.1.1”项下的色谱条件进样进行含量测定,以峰面积(A)为横坐标,浓度(C)为纵坐标进行线性回归,得到人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1的回归方程依次为:A=7621.8 C+4792.9(n=7),r=0.9998;A=3736.9 C+1493.6(n=7),r=0.9996;A=4717.9 C+117.54(n=7),r=0.9997;A=5520.4 C+5130.2(n=7),r=0.9998。表明人參皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1的浓度分别在13.10~327.00、3.32~82.90、2.82~70.60、13.00~325.00 μg/ml的范围内与峰面积呈良好的线性关系。日内精密度RSD为1.62%(n=5),日间精密度RSD为1.71%(n=5)。
2.2统计学方法
采用SPSS 17.0软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2.3样品的制备
2.3.1传递体和脂质体的制备
2.3.1.1 PNS传递体的制备 根据前期实验成果所得最优处方工艺制备PNS传递体[18]。处方工艺如下:称取PNS 100 mg、CH 15 mg、sbPC 120 mg、VE 2 mg、中药挥发油(柠檬烯∶柠檬醛=4∶1)80 mg,溶于35 ml甲醇:二氯甲烷(3∶4,V/V)混合溶剂中,转移至500 ml茄形瓶中,在避光、45 ℃、50 r/min下减压旋转蒸发去除溶剂,得到干膜,继续旋转蒸发2 h以确保有机溶剂除尽,加入10 ml水化液[磷酸盐缓冲液(PBS),pH为5.0,相对离子浓度为1/10],振摇至水化完全,放置过夜后进行超声破碎处理(温度为25℃,功率为19 W,时间为1 min,开5 s,关5 s),并将传递体混悬液在40℃水浴、氮气压条件下依次挤压通过100 nm与50 nm孔径的聚碳酸酯径迹蚀刻膜(挤出压力分别为0.25、0.49 MPa),即得PNS传递体。
2.3.1.2 PNS脂质体的制备 PNS脂质体的处方如下:PNS 100 mg、CH 15 mg、sbPC 120 mg、VE 2 mg,按“2.3.1.1”项下PNS传递体的制备工艺制得PNS脂质体。
2.3.2 PNS传递体/脂质体凝胶剂的制备
2.3.2.1空白凝胶基质的制备 称取0.5 g卡波姆-940,加入蒸馏水且不断搅拌,放置过夜,使其溶胀完全,以PBS调节pH至6.5,得空白凝胶基质。
2.3.2.2 PNS传递体凝胶剂的制备 取10 ml“2.3.1.1”项下所制得的PNS传递体加入“2.3.2.1”项下所制得的空白凝胶基质中,并不断搅拌,最后加入5 ml甘油,继续搅拌均匀即得PNS传递体凝胶剂。
2.3.2.3 PNS脂质体凝胶剂的制备 取10 ml“2.3.1.2”项下所制得的PNS脂质体加入“2.3.2.1”项下所制得的空白凝胶基质中,并不断搅拌,最后加入5 ml甘油,继续搅拌均匀即得PNS脂质体凝胶剂。
2.4 PNS传递体凝胶剂的含量测定
精密称取“2.3.2.2”项下的PNS传递体凝胶剂0.7 g,置于10 ml的容量瓶中,加入适量甲醇,超声数分钟使溶解,用甲醇稀释至刻度,摇匀,过0.45 μm微孔滤膜后,按“2.1.2”项下HPLC法测定样品中药物的含量。测定结果表明,PNS传递体凝胶剂中各成分的含量分别为:人参皂苷Rg1(1.82±0.13)mg/g、人参皂苷Re(0.33±0.05)mg/g、三七皂苷R1(0.57±0.10)mg/g及人参皂苷Rb1(1.58±0.07)mg/g(n=3)。
2.5 PNS传递体凝胶剂的性状
本品为浅白色半透明凝胶,质地均匀细腻,无黏性块状物,涂展性好。分别取3批“2.3.2.2”项下PNS传递体凝胶剂样品1 g,置于烧杯中,以10 ml蒸馏水稀释后,搅拌均匀,测得pH值为6.0~7.0。
2.6离心试验
分别取3批“2.3.2.2”项下PNS传递体凝胶剂样品5 g,置于离心管中,于5000 r/min下离心30 min,结果显示所制备的凝胶均无分层现象。
2.7渗漏率测定
精密称取“2.3.2.2”项下PNS传递体凝胶剂样品1.0 g,加入PBS(pH 6.5)浸泡4 h后,涡旋10 s,置于冷冻离心机中,于20 000 r/min下离心30 min,取上清液(游离药物部分),进样,按“2.1.2”项下方法测定含量,按公式1计算渗漏率(%)[19]。公式1中,Wf为游离药物量,Wb为包封率测定时游离药物量,Wa为药物含量。
2.8温度、湿度及光照试验
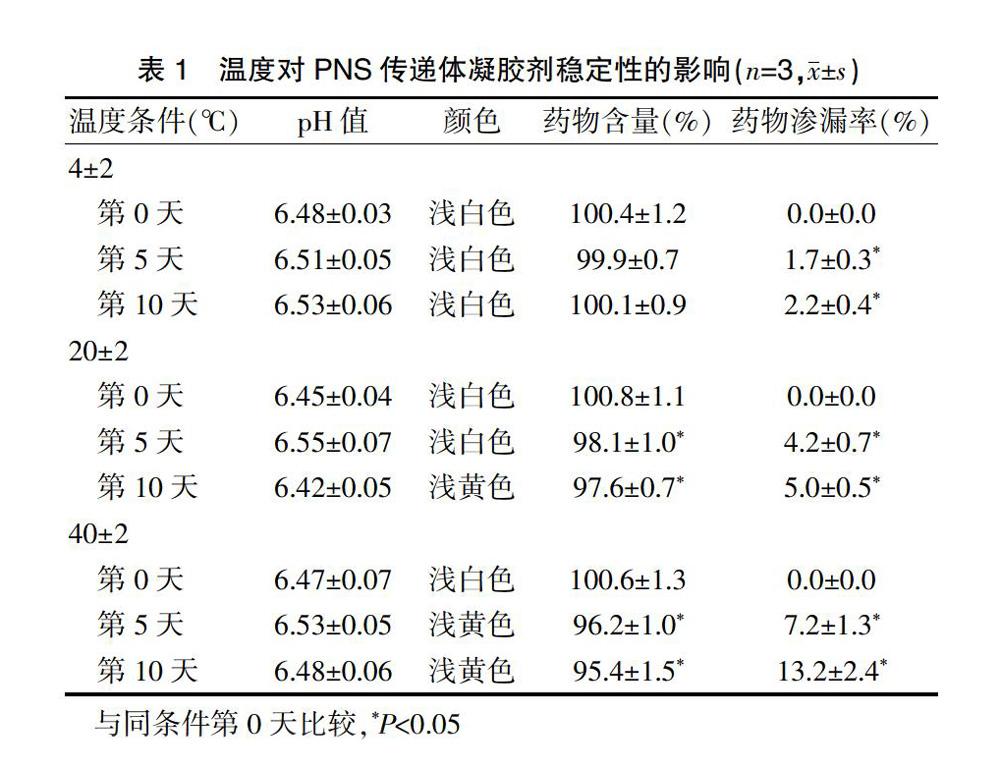
2.8.1温度对PNS传递体凝胶剂稳定性的影响
精密称取“2.3.2.2”项下PNS传递体凝胶剂样品3.0 g,置于棕色玻璃瓶中密封保存,分别于(4±2)℃、(20±2)℃、(40±2)℃恒温条件下放置10 d,定时取样,测定药物含量(%)、药物渗漏率(%)及pH值,与同条件第0天的样品进行比较。同时对样品的性状进行观察,以评价温度对PNS传递体凝胶剂稳定性的影响。
试验结果表明,在(4±2)℃时,传递体凝胶剂的药物含量和性状均无明显变化,但其第5天和第10天的药物渗漏率高于同条件第0天,差异有统计学意义(P<0.05),在(20±2)℃和(40±2)℃时,传递体凝胶剂第5天和第10天的药物渗漏率高于同条件第0天,差异有统计学意义(P<0.05),且制剂由浅白色变为浅黄色,同时其第5天和第10天的药物含量也低于同条件第0天,差异有统计学意义(P<0.05)(表1)。提示在低温[(4±2)℃]条件下,PNS传递体凝胶剂稳定性良好。
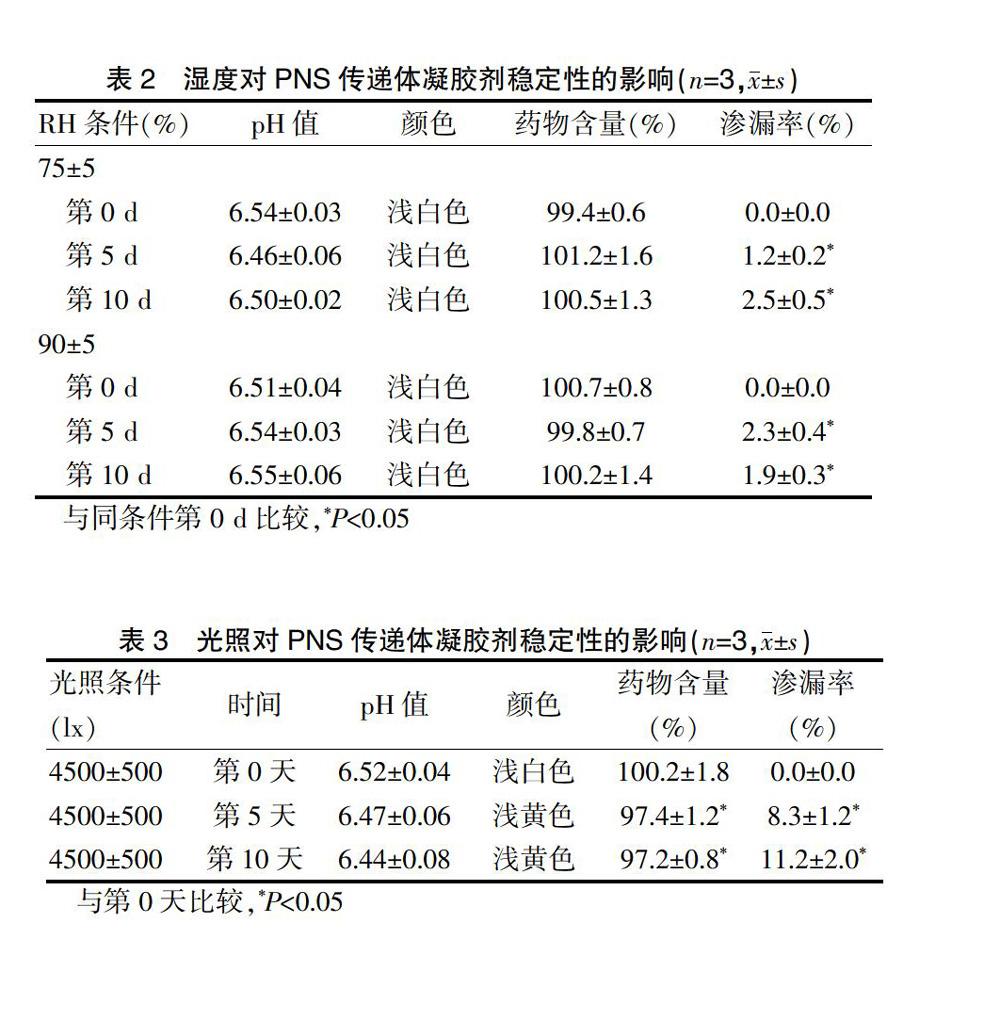
2.8.2湿度对PNS传递体凝胶剂稳定性的影响
精密称取“2.3.2.2”项下的PNS传递体凝胶剂样品3.0 g,置于棕色玻璃瓶中,敞口,置于相对湿度(RH)分别为(75±5)%和(90±5)%的4 ℃恒温密闭容器中,放置10 d,定时取样,测定药物含量(%)、药物渗漏率(%)及pH值,与同条件第0天的样品进行比较。同时对样品的性状进行观察,以评价湿度对PNS传递体凝胶剂稳定性的影响。
试验结果表明,不同湿度下,传递体凝胶剂的药物含量和性状均无明显变化,但是在RH为(75±5)%、(90±5)%条件下,第5天和第10天的药物渗漏率均高于同条件第0天,差异有统计学意义(P<0.05)(表2)。其药物渗漏率均较小(<3.0%),PNS传递体凝胶剂稳定性均良好。
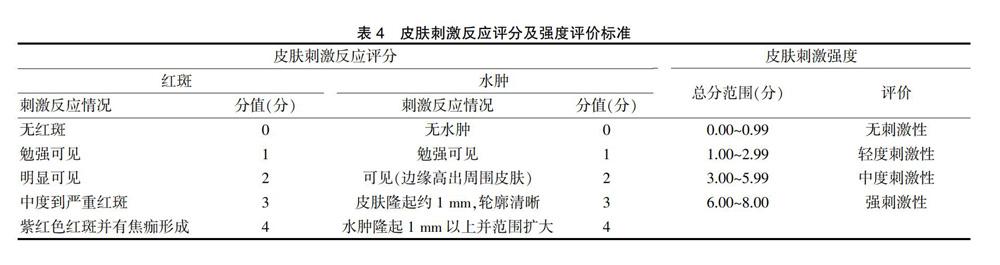
2.8.3光照对PNS传递体凝胶剂稳定性的影响
精密称取“2.3.2.2”项下PNS传递体凝胶剂样品3.0 g,置于透明无色玻璃瓶中密封保存,使其接收(4500±500)lx的强光光照,于温度为4 ℃的条件下放置10 d,定时取样,测定药物含量(%)、药物渗漏率(%)及pH值,与同条件第0天的样品进行比较。同时对样品的性状进行观察,以评价光照对PNS传递体凝胶剂稳定性的影响。
试验结果表明,在强光照射下,传递体凝胶剂第5天和第10天的药物渗漏率高于第0天,差异有统计学意义(P<0.05),且制剂由浅白色变为浅黄色,同时其第5天和第10天的药物含量也低于第0天,差异有统计学意义(P<0.05)(表3)。提示避光条件下,PNS传递体凝胶剂稳定性良好。
2.9皮肤刺激性试验
2.9.1单次给药皮肤刺激性试验
选取8只雌雄各半的健康SD大鼠,将其随机分为基质对照组和PNS传递体凝胶剂组,每组各4只。试验前,将两组大鼠的腹部毛发剃除,进行左右等分,左侧作为正常皮肤,右侧皮肤用400号的纱布纸进行摩擦造成局部擦伤(以渗血为度),作为损伤皮肤[20]。次日,在两组大鼠的正常皮肤和损伤皮肤上分别涂抹“2.3.2.1”项下制得的空白凝胶基质和“2.3.2.2”项下制得的PNS传递体凝胶剂3 g(给药面积控制在25 cm2),用医用灭菌纱布固定,6 h后,用灭菌温水清洗皮肤。分别于停药后1、24、48和72 h对给药部位的红斑、水肿等情况进行观察,做好记录,并按照标准(表4)进行评分。
试验结果表明,基质对照组和PNS传递体凝胶剂組对大鼠正常皮肤和破损皮肤的刺激反应评分值均为(0±0)分(n=4),提示PNS传递体凝胶剂单次给药对大鼠完整皮肤和破损皮肤均无刺激性。
2.9.2多次给药皮肤刺激性试验
在单次给药皮肤刺激性试验结果良好的前提下,笔者进行了多次给药皮肤刺激性试验,同样选取8只雌雄各半的健康SD大鼠,分组方法、试验动物皮肤处理方法同“2.9.1”项下的“单次给药皮肤刺激性试验”。次日,在两组大鼠的正常皮肤和损伤皮肤上分别涂抹“2.3.2.1”项下制得的空白凝胶基质和“2.3.2.2”项下制得的PNS传递体凝胶剂3 g(给药面积控制在25 cm2),用医用灭菌纱布固定,每天1次,连续给药7 d,末次给药24 h后,用灭菌温水清洗皮肤。分别于停药后1、24、48和72 h对给药部位的红斑、水肿等情况进行观察,做好记录,并按照“2.9.1”项下的“单次给药皮肤刺激性试验”中表4的标准进行评分。
试验结果表明,基质对照组和PNS传递体凝胶剂组对大鼠正常皮肤和破损皮肤的刺激反应评分值均为(0±0)分(n=4),表明PNS传递体凝胶剂多次给药对大鼠完整皮肤和破损皮肤均无刺激性。
2.10体外皮肤渗透性试验
2.10.1制备离体皮肤
取雄性SD大鼠,颈椎脱臼处死,固定于鼠板上,用剃毛器与弯头剪去除大鼠胸骨至腹部的毛发,剪下大鼠腹部皮肤,去除皮下组织,确保皮肤角质层的完整性,取生理盐水将皮肤漂洗干净,展平并吸去多余水分后用锡箔纸包裹,置于-70℃冰箱中冷藏备用。
2.10.2体外透皮试验
试验前,先将“2.10.1”项下制得的离体皮肤于室温下解冻,剪取适宜大小(有效皮肤面积为0.636 cm2),固定于供给池与接受池之间,将角质层面向供给池,放入接受液[0.9%生理盐水-乙醇(4:1)混合液],排尽接受池中的气泡使接受液液面与皮肤内层完全接触,接受池保持(32±1)℃恒温水浴,池内磁力搅拌速度为400 r/min,平衡15 min后,更换新的接受液,取“2.3.2.2”项下PNS传递体凝胶剂0.5 g涂布于皮肤表面,记录时间为0 h,于0.5、1、2、4、6、8、10、12、24、36 h时间点取样200 μl,并及时补加等体积的新鲜接收液。试验以“2.3.2.3”项下制得的PNS脂质体凝胶剂作为参比制剂。
2.10.3体外皮肤累积渗透量的计算
取“2.10.2”项下的体外透皮试验中所得样品,按“2.1.2”项下方法测定样品中各成分的含量,按公式2计算累积渗透量。公式2中0.636为透皮扩散面积(cm2),5为接受池体积(ml),0.2为取样体积(ml),Cn为第n个取样点测得的药物成分浓度(μg/ml),Ci为第n个取样点之前某时间点该成分的测定浓度(μg/ml)。
2.10.4体外皮肤累积渗透结果及渗透曲线的绘制
2.10.5体外皮肤渗透速率分析
本研究对PNS传递体凝胶剂和PNS脂质体凝胶剂中各成分的离体皮肤渗透曲线进行观察后,按照不同时间段渗透速率的特点将渗透曲线分割成三部分[依次为0.5~6(V1)、>6~12(V2)及>12~36 h(V3)3个时间段,渗透速率依次减小],分别进行线性回归以估算不同时间段的渗透速率。结果提示,在V1和V2两个时间段,PNS传递体凝胶剂中各成分(三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1)的渗透速率都大于PNS脂质体凝胶剂中各成分的渗透速率,差异有统计学意义(P<0.05),V3时间段,PNS传递体凝胶剂和PNS脂质体凝胶剂中各成分的渗透速率皆趋于0,两者比较,差异无统计学意义(P>0.05)(表5)。结果表明,与PNS脂质体凝胶剂相比,PNS传递体凝胶剂能显著提高PNS的透皮效率。
表5 不同时间段PNS传递体凝胶剂和PNS脂质体凝胶剂中各成分渗透速率的比较[μg/(cm2·h),x±s,n=3]
与PNS脂质体凝胶剂同时间段比较,*P<0.05
2.11 PNS传递体凝胶剂和PNS脂质体凝胶剂中各成分36 h的皮肤滞留量
取“2.10.2”项下经过36 h体外透皮试验后的离体皮肤。用生理盐水冲净皮肤内外表面,并用滤纸将皮肤表面水分吸干,剪碎后置于研磨器中,加入200 μl生理盐水,充分研磨,得皮肤匀浆;加入3 ml提取溶剂(丙酮∶甲醇=3∶1),涡旋2 min,于2000 r/min离心15 min后将上清液转移至具塞塑料离心管中;此提取过程重复2次,合并各次提取液,于60℃下氮气流吹干;残留物用200 μl甲醇溶解,涡旋1 min,离心后吸取20 μl上清液,按“2.1.2”项下方法测定药物皮肤滞留量,结果见表6。测得36 h后PNS脂质体凝胶剂中人参皂苷Rg1、人参皂苷Re、三七皂苷R1及人参皂苷Rb1的皮肤滞留量约为PNS传递体凝胶剂中各成分的2.0~7.0倍。
3讨论
本研究所制得的PNS传递体凝胶剂性质稳定、安全性良好。体外皮肤渗透性试验表明,PNS传递体凝胶剂的皮肤渗透性具有明显优势,PNS传递体凝胶剂中各成分的36 h皮肤累计渗透量约为参比制剂PNS脂质体凝胶剂的2.0~3.5倍;而皮肤滞留试验的结果显示,36 h后PNS脂质体凝胶剂中4种成分的皮肤滞留量约为参比制剂PNS传递体凝胶剂的2.0~7.0倍。
通过分析PNS传递体凝胶剂与PNS脂质体凝胶剂的体外皮肤渗透与滞留特性,本研究结果提示,PNS传递体凝胶剂中的药物能够较好的穿透皮肤。相反,PNS脂质体凝胶剂中的药物则是大量滞留于皮肤中而使得其药物皮肤渗透量大大降低,这一结果证明了传递体相比于传统脂质体具有明显的经皮渗透优势,更适合作为药物的经皮渗透载体。
近年来,已有多位研究者对不同药物传递体制剂的体外透皮性能进行了考察[13,15,21],结果均表明传递体能促进药物的经皮吸收,但是关于传递体的透皮机制仅仅停留在理论猜想阶段,而未得出一个权威性解释,这一直是困扰大家的一大难题,后期本研究将对载体的转运机制进行系统研究,以期得出科学解释。
本研究以传递体为载体,将其制备成凝胶剂,充分发挥了载体的优势和凝胶剂的特点,促进大分子混合物PNS的透皮吸收,实现了其皮肤局部给药并具有缓释特性,避免药物在给药局部出现峰谷浓度现象,增加其使用的安全性。因此,PNS传递体凝胶剂具有良好的应用前景。
[参考文献]
[1]陈雅慧,傅春升,孙爱萍,等.三七总皂苷制剂研究进展[J].中南药学,2018,16(6):812-816.
[2]王钢,陈琼芳,李钊飞,等.三七总皂苷及其主要成分对脑细胞保护作用的机制研究进展[J].中华中医药学刊,2017, 35(7):1743-1746.
[3]卢晓燕,王琰,陈旻静,等.三七总苷抑制黑色素瘤A375細胞增殖的作用及机制研究[J].中药材,2017,40(5):1199-1202.
[4]李青融,王子妤.三七总皂苷药理作用的研究进展[J].湖南中医杂志,2017,33(9):216-218.
[5]杨松,洪勇.三七总皂苷与乳腺癌治疗[J].现代肿瘤医学,2018,26(9):1454-1457.
[6]付开礼.三七总皂苷在骨科的药理与临床研究进展[J].云南中医中药杂志,2006,27(2):49-51.
[7]宋山峰,韩文朝,王晓冰,等.三七活血止血作用临床应用研究进展[J].中医临床研究,2016,8(31):147-148.
[8]方鹏飞,常丽霞,宋渊.三七总皂苷临床应用研究进展[J].中医药学报,2016,44(3):120-123.
[9]Cevc G,Blume G.Lipid vesicles penetrate into intact skin owing to transdermal osmotic gradients and hydration force[J].Biochim Biophys Acta,1992,1104(1):226-232.
[10]Cevc G,Schatzlein A,Richardsen H.Ultradeformable lipid vesicles can penetrate the skin and other semi-permeable barriers unfragmented. Evidence from double label CLSM experiments and direct size measurements[J].Biochim Biophys Acta,2002,1564(1):21-30.
[11]熊蕊,吴方建.经皮给药系统中新型载体的应用[J].中国药师,2017,20(12):2233-2237.
[12]Lei W,Yu CQ,Lin HQ,et al.Development of tacrolimus-loaded transfersomes for deeper skin penetration enhancement and therapeutic effect improvement in vivo[J].Asian J Pharm Sci,2013,8(6):336-345.
[13]杨树芳,吴智敏,郭淑娟,等.广藿香酮传递体体外透皮效能评价及传递体透皮机制研究[J].中南药学,2018,16(2):187-191.
[14]Avadhani KS,Manikkath J,Tiwari M,et al.Skin delivery of epigallocatechin-3-gallate (EGCG) and hyaluronic acid loaded nano-transfersomes for antioxidant and anti-aging effects in UV radiation induced skin damage[J].Drug Deliv,2017,24(1):61-74.
[15]孙爱珍,郑银,王亚静,等.芒果苷传递体的制备及其经皮给药特性的研究[J].中国药学杂志,2016,51(9):727-731.
[16]魏燕,张永生,郑杭生,等.盐酸青藤碱传递体的制备及其对大鼠类风湿性关节炎的药效评价[J].中草药,2017, 48(23):4872-4879.
[17]卢耀文,杨升云,龙晓英,等.处方组成对槲皮素传递体透皮作用的影响[J].中国医药工业杂志,2017,48(4):523-528.
[18]陈思思,郑杭生,王娟,等.三七总皂苷传递体的制备及其治疗大鼠急性软组织损伤作用研究[J].中草药,2015, 46(14):2070-2075.
[19]时军,王芳,滕希峰,等.丹皮酚离子脂质体凝胶剂的稳定性及离体皮肤渗透试验研究[J].中药材,2012,35(5):803-807.
[20]张继红,王海燕,李小妹,等.珠子参皂苷脂质体凝胶剂的制备及皮肤毒性实验研究[J].三峡大学学报(自然科学版),2018,40(1):100-105.
[21]马闪闪,张志锋,吕露阳,等.白花丹醌传递体凝胶的制备及其体外透皮研究[J].中草药,2018,49(15):3625-3631.
(收稿日期:2019-01-17 本文编辑:孟庆卿)
