气调包装对烤鸭腿货架期及微生物多样性的影响
2019-10-30赵嘉越杨啸吟毛衍伟梁荣蓉董鹏程朱立贤张一敏刘国星高合江
赵嘉越,罗 欣,2,杨啸吟,毛衍伟,梁荣蓉,董鹏程,朱立贤,*,张一敏,*,刘国星,高合江
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095;3.北京市恒慧通肉类食品有限公司,北京 101302)
烤鸭作为我国传统肉制品之一,历史悠久且深受消费者喜爱,具有色泽诱人、香气浓郁、皮脆肉嫩、肥而不腻的特点而享誉中外。但目前烤鸭大多通过简单的托盘包装或直接暴露于空气中销售,产品易受微生物污染,导致货架期短且销售半径小[1]。部分企业通过二次杀菌结合真空包装来延长烤鸭的货架期,但二次杀菌会使烤鸭失去皮香脆的特点,烤鸭特有风味及营养损失严重,真空包装则易造成烤鸭汁液损失、脂肪溢出、产品变形等[2-3]。
无氧气调包装(modified atmosphere packaging,MAP)能抑制肉品的微生物生长和脂肪氧化酸败,抑制风味劣变,延长其货架期[4],使产品具有卫生安全、良好外观的优点。其中,CO2和N2的混合气体因能抑制大多数微生物生长而特别适合保存熟肉和腌制肉[5]。CO2是主要的抑菌物质,它能延长微生物的迟滞期并降低对数期的生长速率[6]。N2主要作为填充气体使用,可防止CO2被产品吸收后造成的包装塌陷并排除O2[7]。体积分数5%~50%的CO2具有抑菌作用,而更高体积分数的CO2抑菌效果不明显[1,8],一旦CO2体积分数超过50%则会导致包装出现明显凹陷,对外观造成不利影响[9-10]。对于易腐败且无呼吸作用的肉制品而言,理想状态应是排除O2,适当提高CO2或N2体积分数[11-12]。
肉品腐败是由优势菌群不可控生长和其一系列代谢活动所致[13]。微生物生长特别是具有高腐败潜力的细菌生长会使肉品腐败并产生变色、不愉快气味、黏液等有害影响[14]。不同贮藏条件如包装内气体组分、温度和抗菌物质的应用等会影响微生物菌群演替及其致腐能力[15-16]。气调包装下,肉品中的微生物群落为适应包装内气体环境的改变,通常会向不同方向进行生态演替,导致贮藏过程中菌群的多样性不断发生变化,进而影响肉制品的微生物货架期[16-18]。然而,对于气调包装熟肉制品微生物多样性的研究目前还多选用传统培养方法,但这种方法评估熟肉制品中细菌群落的能力有限。近几年,高通量测序正逐渐被应用于对微生物多样性的分析,它既能完整覆盖微生物群落,还可根据数百万序列对每个样本中单个操作分类单元(operational taxonomic units,OTUs)的数量进行定量估计,被证明是能更精确鉴定微生物种类的有效手段[19]。目前已有研究将高通量测序技术应用于生鲜肉和熟肉制品,Wang Taojun[18]、Yang Xiaoyin[16]等分别研究了不同气调包装羊肉和牛肉的菌群变化及差异,Chen Xue等[20]研究了冰温下牛肉贮藏过程中的菌群结构变化,Ge Qingfeng等[21]对不同工厂间金华火腿的菌群结构差异进行了分析。对于熟肉制品,Xiao Xiang[22]、谢萍[23]和Li Xinfu[24]等分别对真空包装下肴肉、散装酱卤鸭翅和烟熏培根贮藏过程中的菌群结构变化进行了研究,但鲜有高通量测序技术应用于气调包装烤鸭类产品微生物多样性分析,明确不同包装烤鸭的微生物多样性及主要微生物有助于对该类产品品质控制的研究。
本实验以烤鸭腿为研究对象,以托盘包装作为对照,研究了体积分数100% N2、体积分数50% CO2+50%N2气调包装的烤鸭腿在0~4 ℃下贮藏期间微生物、品质及感官指标的变化规律,并采用高通量测序技术研究3 种包装烤鸭腿贮藏过程中微生物群落演替规律,探究气调包装对烤鸭腿货架期的影响及不同包装方式对烤鸭腿菌群结构的影响,为揭示烤鸭的微生物致腐机理、气调包装延长烤鸭货架期等问题提供理论依据。
1 材料与方法
1.1 材料与试剂
烤鸭腿产品取自北京市恒慧通肉类食品有限公司。
TQBC-0775托盘包装盒(23 ℃、相对湿度(relative humidity,RH)0%下,透氧率为10 cm3/(m2·24 h);38 ℃、RH 90%水蒸气透过率为15 g/(m2·24 h))、Lid 1050/550密封阻隔膜(23 ℃、RH 0%下,透氧率为25 cm3/(m2·24 h),4 ℃、RH 100%下水蒸气透过率为10 g/(m2·24 h)) 希悦尔包装上海有限公司。
平板计数琼脂、MRS培养基、VRBGA培养基北京陆桥技术股份有限公司;BagPage®拍打袋法国Interscience公司;PicoGreen dsDNA定量检测试剂盒美国Invitrogen公司。
1.2 仪器与设备
DT-6D气调保鲜包装机 中国大江机械设备有限公司;CheckPoint气体成分分析仪 丹麦PBI-Dansensor A/S公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;T18匀浆机 艾卡(广州)仪器设备有限公司;MiSeq测序仪 美国Illumina公司;NanoDrop 1000分光光度计 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 样品处理与实验设计
烤鸭加工工艺流程:生鸭前处理→生鸭上线→过热水(2~3 min)→沥水(2 min)→挂糖衣(1~2 min)→热风吹干(40 ℃、≥10 min)→烘烤(240 ℃、50 min)→室温冷却(≥30 min)→熟鸭下线→卸腿→真空包装→杀菌(90 ℃、10 min)。
将上述杀菌结束后的烤鸭腿通过冷链物流车运回实验室0~4 ℃冷库,取真空包装后的鸭腿,随机分为3 组,每组52 只,分别进行50% CO2+50% N2和100% N2的气调包装,并以普通托盘包装为对照组。将包装后的鸭腿置于0~4 ℃的黑暗环境中贮藏21 d,分别在第1、4、7、11、14、21天测定样品的各项微生物指标及脂肪氧化值,并在第1、7、14、21天进行感官评定。每个时间点每个处理组重复6 次。
1.3.2 硫代巴比妥酸反应产物值的测定
硫代巴比妥酸反应产物(thiobarbituric acid reactive substance,TBARS)值参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法测定。
1.3.3 感官评定
参照Santos[25]、宋莲军[26]等的方法稍作修改,由长期从事肉品研究的10 名人员组成评定小组,从滋味和总体可接受性两个方面进行评定。将烤鸭腿微波复热,参数为高火(700 W)1 min、中高火(539 W)1 min、中火(385 W)1 min,品尝复热后的滋味和总体可接受性,具体标准见表1,当任一项评分低于5 分时,则表示不能接受。

表1 烤鸭腿感官评定评分标准Table 1 Criteria for sensory evaluation of roast duck legs
1.3.4 微生物的测定
于无菌环境下从每个样品中随机剪取25 g肉样(包含表皮),剪碎放入含225 mL灭菌蛋白胨生理盐水(含8.5 g/L NaCl和1 g/L蛋白胨)的拍打袋中,拍打袋在均质拍打器中拍打2 min,按10 倍梯度稀释到所需要的稀释度。菌落总数的测定参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》;乳酸菌数的测定参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》;肠杆菌科数的测定参照GB 4789.41—2016《食品安全国家标准 食品微生物学检验 肠杆菌科检验》。结果均以lg(CFU/g)表示。
1.3.5 DNA提取及高通量测序
DNA提取参考Yang Xiaoyin等[16]的方法,取相应时间点的样品,提取细菌总DNA(每个时间点、每个处理组3 个重复)后,通过质量分数0.8%琼脂糖凝胶电泳检测并通过紫外分光光度计定量。采用由上海派森诺生物公司提供的方法,对细菌的16S rDNA的V3~V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增引物为338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR扩增参数为:98 ℃预变性2 min;进入热循环,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,25~30 个循环;最后一个延伸为72 ℃、5 min。扩增产物通过Agencourt AMPure Beads纯化,由PicoGreen dsDNA定量检测试剂盒定量,再通过Illumina MiSeq平台进行DNA测序。
1.4 数据统计分析
采用SPSS 18.0软件一般线性模型中的单变量进行双因素方差分析,包装方式和贮藏时间为固定因子,使用最小显著性差异法对两个因素的主效应进行多重比较,以F值测验判断两因素交互作用是否显著,P<0.05为交互作用显著。采用Sigma Plot 10.0软件作图。
测序数据分析参考Chen Xue等[20]的方法,通过定量微生物生态软件(quantitative insights into microbial ecology,QIIME)v1.8.0软件筛选并通过Fast Length Adjustment of Short (FLASH)合并,从而得到高质量Clean tags。嵌合体检测后,用UCLUST对Effective tags按97%的序列相似度聚类成OTUs并筛选出代表序列,通过BLAST与SILVA数据库中的模板序列对比,进行进一步分析。Alpha多样性包括Shannon和Chao 1指数,均通过QIIME和R软件(Version 3.2.0)分析。使用可视化工具GraPhlAn绘制分类等级树以快速发现优势菌群。用R软件进行聚类分析绘制热图并对属水平群落组成结构进行主成分分析(principal component analysis,PCA),以二维图像描述样本间的自然分布特征。
2 结果与分析
2.1 不同气调包装对烤鸭腿贮藏过程中TBARS值的影响

表2 不同气调包装对烤鸭腿贮藏过程中TBARS值的影响Table 2 Effect of MAP on TBARS values of roast duck legs during storage
如表2所示,贮藏时间和包装方式的交互作用显著影响烤鸭腿的TBARS值(P<0.05)。两种气调包装烤鸭腿的TBARS值在21 d贮藏期内变化平稳,均始终维持在0.29~0.40 mg/kg内,而托盘包装烤鸭腿的TBARS值在贮藏期间显著增加(P<0.05),从初始值0.58 mg/kg增加到末期的1.53 mg/kg,并在第11天超过1 mg/kg,说明脂肪氧化程度逐步增大。从贮藏4 d起,托盘包装烤鸭腿的TBARS值显著高于气调包装(P<0.05),但两种气调包装烤鸭腿无显著性差异(P>0.05)。Guo Yuchen等[27]同样发现与放置于空气相比,气调包装显著抑制了烤鸡的脂肪氧化(P<0.05),但100% N2包装与含不同比例CO2的气调包装对烤鸡TBARS值的影响无显著差异(P>0.05)。由于托盘包装中的O2促进了脂肪氧化,导致TBARS值不断增加,而气调包装的残氧含量极低。因此,O2是导致烤鸭腿脂肪氧化极为重要的因素,可进一步影响口感、风味等,甚至损害其营养价值[9,28-29]。可见无氧气调包装有效抑制了烤鸭腿的脂质氧化。
2.2 不同气调包装对烤鸭腿贮藏过程中感官指标的影响
感官评分是衡量肉制品品质较为直接、快速的指标,对消费者购买烤鸭起决定性作用。贮藏时间和包装方式的交互作用对烤鸭腿品尝时的滋味和总体可接受性影响显著(P<0.05)。由表3可知,3 种包装烤鸭腿的滋味和总体可接受性的评分在贮藏期间显著降低(P<0.05),气调包装和托盘包装烤鸭腿的两项评分均分别在21 d和7 d降到5 分以下,贮藏7 d后,托盘包装烤鸭腿的评分显著低于气调包装(P<0.05),可能由于托盘包装烤鸭腿的脂肪氧化严重,产生了不愉快味道。但两种气调包装烤鸭腿的评分无显著性差异(P>0.05)。在贮藏初期,产品没有表现出腐臭、酸败、发黏等腐败特性。托盘包装烤鸭腿在14 d时已表现出酸败味,此时,气调包装下的烤鸭腿依然可以接受,而气调包装烤鸭腿在贮藏21 d时表现出轻微酸败味。感官品评结果表明,气调包装烤鸭腿的感官货架期接近21 d,托盘包装烤鸭腿的感官货架期接近7 d。因此相对于托盘包装,气调包装更有利于烤鸭腿风味的保持[30]。

表3 不同气调包装对烤鸭腿贮藏过程中滋味和总体可接受性的影响Table 3 Effect of MAP on taste and overall acceptability of roast duck legs during storage
2.3 不同气调包装对烤鸭腿贮藏过程中微生物指标的影响
2.3.1 不同气调包装对烤鸭腿贮藏过程中菌落总数的影响

表4 不同气调包装对烤鸭腿贮藏过程中菌落总数的影响Table 4 Effect of MAP on total viable count of roast duck legs during storage
由表4可知,贮藏时间和包装方式的交互作用对烤鸭腿菌落总数影响显著(P<0.05)。50% CO2+50% N2、100% N2和托盘包装烤鸭腿的菌落总数初始值分别为2.64、2.54、2.52(lg(CFU/g)),且均随贮藏时间延长而显著增加(P<0.05)。21 d内100% N2包装烤鸭腿的菌落总数增长速率最快,在第11天有4 个样品(共6 个样品)超过GB 2726—2016《食品安全国家标准 熟肉制品》中规定的熟肉制品菌落总数的最高安全限量值5(lg(CFU/g))。50% CO2+50% N2和托盘包装烤鸭腿菌落总数增长缓慢,在第21天各有2 个样品超过5(lg(CFU/g))。因此50% CO2+50% N2包装烤鸭腿的货架期接近21 d,100% N2包装烤鸭腿的货架期接近11 d。贮藏前7 d,3 种包装烤鸭腿的菌落总数无显著性差异(P>0.05),但100% N2包装烤鸭腿在11 d后的菌落总数显著高于50% CO2+50% N2和托盘包装组(P<0.05),可见CO2明显抑制了烤鸭腿菌落总数的增加,是因为CO2具有延长细菌生长迟滞期并降低对数生长期的作用[6]。梁荣蓉等[10]同样发现相较于100% N2包装,50% CO2+50% N2气调包装可极显著延长黄焖鸡的货架期(P<0.01)。
2.3.2 不同气调包装对烤鸭腿贮藏过程中乳酸菌数的影响

表5 不同气调包装对烤鸭腿贮藏过程中乳酸菌数的影响Table 5 Effect of MAP on lactic acid bacterial count of roast duck legs during storage
如表5所示,贮藏时间和包装方式的交互作用对烤鸭腿乳酸菌数无显著性影响(P>0.05),而贮藏时间和包装方式分别对烤鸭腿乳酸菌数影响显著(P<0.05)。就贮藏时间而言,乳酸菌数随贮藏时间延长显著增加(P<0.05)。就包装方式而言,100% N2包装烤鸭腿的乳酸菌数显著高于50% CO2+50% N2和托盘包装(P<0.05),可能由于乳酸菌是兼性厌氧菌且是无氧条件下的优势腐败菌,可以看出CO2明显抑制了烤鸭腿贮藏过程中乳酸菌生长。Zhai Yang等[9]同样发现相较于100% N2包装,30% CO2+70% N2气调包装盐水鸭中乳酸菌数较低。Lerasle等[29]则发现50% CO2+50% N2气调包装与空气放置的禽肉肠中乳酸菌数无明显差异。
2.3.3 不同气调包装对烤鸭腿贮藏过程中肠杆菌科数的影响
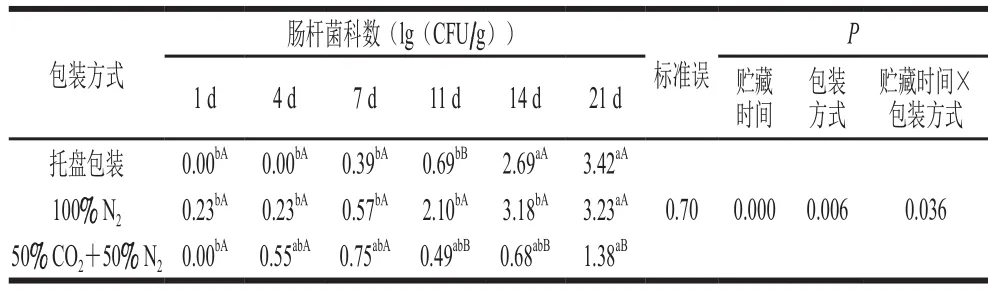
表6 不同气调包装对烤鸭腿贮藏过程中肠杆菌科数的影响Table 6 Effect of MAP on Enterobacteriacese count of roast duck legs during storage
由表6可知,贮藏时间和包装方式的交互作用对烤鸭腿肠杆菌科数影响显著(P<0.05)。50% CO2+50% N2、100% N2和托盘包装烤鸭腿的肠杆菌科数均随贮藏时间延长而显著增加(P<0.05)。100% N2和托盘包装烤鸭腿的肠杆菌科分别在贮藏11 d和14 d后显著高于50% CO2+50% N2包装组(P<0.05),可以看出CO2对肠杆菌科的生长有一定的抑制作用。
尽管传统培养方法可以测定微生物数量,但它不能完全反映贮藏过程中微生物菌群变化,由于一些不可培养的微生物无法通过传统方法进行检测[16]。因此,采用高通量测序技术进一步探究烤鸭腿贮藏过程中的微生物多样性。
2.4 高通量测序
2.4.1 不同包装方式下烤鸭腿的微生物多样性分析
通过剔除疑问序列,得到了每个样本的序列标签数,其中50% CO2+50% N2、100% N2和托盘包装烤鸭腿的平均有效序列标签数分别为48 709、48 902、48 702 个。如表7所示,3 种包装烤鸭腿中所含细菌存在差异,表明不同包装方式的烤鸭腿在贮藏期间具有各自平衡的微生物菌群结构和多样性。Shannon指数和Chao 1指数均在前7 d增加,之后呈减小趋势,表明烤鸭腿中菌群多样性呈先升高后下降趋势。覆盖度在99%以上,表明烤鸭中主要的微生物被发现,测序数据可以反映样品的多样性。

表7 贮藏期间3 种包装烤鸭腿的菌群丰度和多样性Table 7 Species richness and diversity of roast duck legs during storage under 3 different packaging conditions
2.4.2 不同包装方式下烤鸭腿的微生物群落结构变化

图1 贮藏期间3 种包装烤鸭腿中微生物群落的相对丰度(属水平)Fig. 1 Relative abundance of bacterial community in roast duck legs during storage under 3 different packaging conditions (at genus level)
图1 显示贮藏时间和包装方式对烤鸭腿微生物菌群结构变化影响较大。从属水平分析,烤鸭腿中主要的微生物(相对丰度>1%)有16 种。整体来看,贮藏初期泛菌属(Pantoea)在3 种包装烤鸭腿中占绝对优势,但从7 d起逐渐降低,这时不同贮藏时间和包装方式间的烤鸭腿微生物群落开始出现差异。
由图1A可知,对于50% CO2+50% N2包装烤鸭腿而言,贮藏过程中Pantoea、假单胞菌属(Pseudomonas)和类香味菌属(Myroides)交替成为优势菌群,Myroides相对丰度在11 d时突然增加,并成为11 d和14 d的优势菌群(相对丰度分别为43.3%和32.6%),之后其相对丰度开始降低;Pseudomonas相对丰度从第7天(7.7%)开始增加,在第21天时占据绝对优势(34.9%)。Pseudomonas、Pantoea和不动杆菌属(Acinetobacter)可能是导致50% CO2+50% N2包装烤鸭腿最终腐败的主要微生物(21 d时相对丰度大于10%)。
由图1B可知,对于100% N2包装烤鸭腿,贮藏过程中索丝菌属(Brochothrix)、Pantoea、Pseudomonas和肉食杆菌属(Carnobacterium)交替成为优势菌群,贮藏初期除Pantoea占绝对优势外,Carnobacterium相对丰度较高;Brochothrix从贮藏7 d开始增加,并在11~21 d占有绝对优势(分别为45.6%、53.5%和42.7%);Pseudomonas和明串珠菌属(Leuconostoc)也在7 d开始增加,但始终低于Brochothrix;Pseudomonas、Brochothrix(11~21 d相对丰度均大于10%)和Leuconostoc(第21天相对丰度大于10%)可能是导致100% N2包装烤鸭腿最终腐败的主要微生物。
由图1C可知,对于托盘包装烤鸭腿而言,贮藏过程中Pantoea、Pseudomonas和Myroides交替成为优势菌群。同50% CO2+50% N2包装烤鸭腿相似,托盘包装烤鸭腿中Myroides相对丰度也在11 d时突然增加,成为优势菌群(43.3%),之后其相对丰度开始降低;而Brochothrix在14 d时最具优势(24.9%),Pseudomonas相对丰度从第7天(18.0%)开始增加,在第21天时占据绝对优势(48.5%)。Pseudomonas和Brochothrix可能是导致托盘包装烤鸭腿最终腐败的主要微生物(21 d时相对丰度大于10%)。Pseudomonas的蛋白水解能力可使它们渗入肉中利用营养物质等占据利于其生长的生态位,从而在贮藏后期更具优势[31]。Pseudomonas数量的突然增加也可能与包装膜的透气率有关,随着透气率增加,Pseudomonas的数量增加,进而导致Brochothrix的相对丰度在贮藏末期呈现下降趋势,但其数量依然增加[5]。Wang Taojun等[18]也发现无氧气调包装羊肉中的Pseudomonas数量在贮藏后期大幅度增加。
贮藏中后期50% CO2+50% N2和托盘包装烤鸭腿中Myroides和Acinetobacter的相对丰度大于100% N2包装烤鸭腿,100% N2包装烤鸭腿中Brochothrix和Leuconostoc的相对丰度较高,为优势菌群;因此100% N2包装烤鸭腿的菌落总数在11 d后显著高于50% CO2+50% N2和托盘包装可能与Brochothrix和Leuconostoc相对丰度增加有关。
2.4.3 不同包装方式下烤鸭腿的微生物群落结构比较
图2是对微生物群落构建的等级树,不同颜色表示不同的OTUs,节点大小(从里到外)表示微生物(从界到属)的丰度分布。分类等级树可以直观反映3 种包装烤鸭腿在整个贮藏期间的优势菌群。21 d贮藏期内,3 种包装烤鸭腿中相对丰度较高的门均为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。不同包装烤鸭腿的菌群结构在科和属水平差异较大,在科水平上,50% CO2+50% N2包装烤鸭腿中相对丰度较高的为肠杆菌科(Enterobacteriaceae)、黄杆菌科(Flavobacteriaceae)、莫拉氏菌科(Moraxellaceae)和假单胞菌科(Pseudomonadaceae);李斯特氏菌科(Listeriaceae)、肠杆菌科、假单胞菌科、肉杆菌科(Carnobacteriaceae)、莫拉氏菌科(Moraxellaceae)和明串珠菌科(Leuconostocaceae)在100% N2包装烤鸭腿中相对丰度较高;托盘包装烤鸭腿中肠杆菌科、假单胞菌科、莫拉氏菌科、黄杆菌科和李斯特氏菌科的相对丰度较高。
在属水平上,Pantoea、Myroides、Pseudomonas和Acinetobacter在50% CO2+50% N2包装烤鸭腿中的相对丰度较高;100% N2包装烤鸭腿中Brochothrix、Pantoea、Pseudomonas、Carnobacterium和Leuconostoc的相对丰度较高;托盘包装烤鸭腿中相对丰度较高的是Pantoea、Pseudomonas、Myroides和Acinetobacter。可见50% CO2+50% N2与托盘包装烤鸭腿的菌群结构较为相似;且3 种包装烤鸭腿的货架期不同是优势菌群不同导致。相较于100% N2包装,CO2可能抑制了烤鸭腿贮藏过程中的Brochothrix、Carnobacterium和Leuconostoc等的繁殖,而导致含CO2包装组的微生物数量更少,也延长了烤鸭腿的货架期。热杀索丝菌可能会产生乳酸、乙醇和少量短链脂肪酸,使肉品产生不愉快的异味,影响烤鸭质量。乳酸菌能使肉品变酸、发黏、产气或绿变,从而引起腐败[32]。Soldatou等[33]发现30% CO2+70% N2和70% CO2+30% N2包装相较于托盘包装,均在贮藏后期显著抑制了羊肉产品Souvlaki中热杀索丝菌的生长;Sheridan等[34]也发现相较于80% O2+20% CO2和真空包装,50%CO2+50% N2包装显著降低了羊肉中热杀索丝菌的数量。


图2 贮藏期间3 种包装烤鸭腿微生物群落总体分类等级树图Fig. 2 Classification tree diagram of bacterial community in roast duck legs during storage under 3 different packaging conditions
为进一步分析3 种包装烤鸭腿贮藏过程中菌群结构的变化及差异,进行了热图分析(图3a)和PCA(图3b)。热图分析将相对丰度大于1%的菌群进行聚类,可以发现在21 d贮藏期内,3 种包装烤鸭腿的菌群在1 d和4 d时聚在一起,说明贮藏初期3 种包装烤鸭腿的菌群结构相似,并在7 d时开始出现差异,50% CO2+50% N2和托盘包装烤鸭腿的菌群与100% N2包装组分别在11~21 d聚在一起,说明它们在此期间分别表现出相似的菌群结构。PCA展现了不同取样时间点微生物组成的相似度,第一主成分(PC1)和第二主成分(PC2)贡献率分别为48.45%和25.07%。贮藏初期所有点聚集在一起,说明微生物菌群结构相似,从第7天起,3 种包装烤鸭腿的菌群结构与初始微生物不同,并逐渐分化,且3 种包装方式下烤鸭腿的菌群也出现差异,结果与热图分析一致。

图3 贮藏期间3 种包装烤鸭腿微生物群落的热图(a)和PCA(b)结果Fig. 3 Heatmap (a) and principal component analysis (b) of bacterial community in roast duck legs during storage under 3 different packaging conditions
3 结 论
本实验通过微生物、品质和感官指标研究了3 种包装方式对烤鸭腿货架期的影响。相比于100% N2包装,50% CO2+50% N2包装对烤鸭腿菌落总数、乳酸菌和肠杆菌科具有明显的抑制效果,可使烤鸭腿货架期接近21 d。与托盘包装烤鸭腿相比,气调包装显著降低了烤鸭腿的脂肪氧化速率,感官品质更佳。综合比较,优选出更适合烤鸭腿贮藏的包装方式为50% CO2+50% N2包装。
本实验的微生物多样性结果发现贮藏时间和包装方式对烤鸭腿贮藏期间的菌群结构产生了明显影响。3 种包装烤鸭腿的初始菌群结构相似,但从第7天起出现差异并随贮藏时间出现变化。50% CO2+50% N2和托盘包装烤鸭腿的菌群结构较为相似,但与100% N2包装差别较大,对于50% CO2+50% N2包装烤鸭腿,泛菌属、假单胞菌属、类香味菌属及不动杆菌属交替成为优势菌群,对于托盘包装烤鸭腿,假单胞菌属、泛菌属、类香味菌属和索丝菌属交替成为优势菌群,而100% N2包装烤鸭腿中的优势菌群为索丝菌属、泛菌属、假单胞菌属、肉食杆菌属及明串珠菌属。50% CO2+50% N2气调包装可能由于抑制了索丝菌属、肉食杆菌属及明串珠菌属的生长而延长了烤鸭腿的货架期。本研究有关微生物群落演替规律的结果有助于开发靶向抑菌物质而进一步延长烤鸭货架期。
