唐古特白刺果实花色苷改善高脂饮食诱导的小鼠非酒精性脂肪肝损伤
2019-10-30李翠芹
李 冰,刘 康,张 锦,李翠芹,2,*
(1.陕西师范大学 西北濒危药材资源开发国家工程实验室,药用植物资源与天然药物化学教育部重点实验室,陕西 西安 710119;2.陕西师范大学生命科学学院,陕西 西安 710119)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是代谢综合征在肝脏中的表现,是临床上十分常见的肝脏疾病[1]。NAFLD很容易发展为非酒精性脂肪性肝炎、肝纤维化和肝硬化[2]。长期摄入高脂饮食会导致肥胖和NAFLD等疾病[3]。来源于天然植物中的黄酮类成分可预防或辅助治疗高脂饮食诱发的肥胖和肝损伤[4]。花色苷是一种常见的黄酮类天然色素和膳食营养因子,广泛分布于水果、蔬菜和农作物中[5]。由于具有较高的药用价值和亮丽的色泽,花色苷已经作为一种功能性的天然色素和营养物质广泛应用于食品和药品等领域[6-7]。
唐古特白刺(Nitraria tangutorun Bobr.)为蒺藜科(Zygophyllaceae)白刺属(Nitraria)植物,广泛分布于青藏高原沙漠地区,为中国特有品种[8]。《本草拾遗》记载“东廧(白刺古名),味甘平、无毒,益气轻身(减肥),久服不饥,坚筋骨”,唐古特白刺果实经常被当地人用来治疗脾胃虚弱、消化不良、神经衰弱和感冒[9]。现代研究表明,唐古特白刺果实富含花色苷、多酚和黄酮等多种生物活性成分[10]。唐古特白刺是花色苷的优质来源[11],然而有关唐古特白刺果实花色苷防治高脂饮食诱发的肥胖及NAFLD损伤的研究鲜见报道。
本研究提取唐古特白刺果实花色苷,经过长期高脂饮食建立小鼠NAFLD模型。在此基础上研究唐古特白刺果实花色苷对NAFLD的预防与缓解作用,及其作用机制。以期为唐古特白刺果实花色苷防治NAFLD提供数据支撑,并对唐古特白刺果实的资源开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
30 只SPF级C57BL/6J雄性小鼠,体质量(20±2)g,购自第四军医大学动物实验中心(生产许可证号:SCXK(陕)2014-002)。
唐古特白刺干果购于青海西宁市城东区中药批发市场。
XDA-6大孔树脂 西安蓝晓新材料有限公司;总胆固醇(total cholesterol,TC)、总甘油三酯(total triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)和低密度脂蛋白(low density lipoprotein,LDL)测定试剂盒 长春汇力生物技术有限公司;谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、过氧化物酶增殖体激活受体-α(peroxisome proliferative activated receptor-α,PPAR-α)、肝X受体α(liver X receptor-α,LXR-α)、脂肪酸转位酶(fatty acid translocase,CD36)和乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,ACC)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 南京建成生物工程研究所;无水甲醇、无水乙醇和多聚甲醛等试剂均为国产分析纯;超纯水为自制。
1.2 仪器与设备
DFT-50粉碎机 温岭市林大机械有限公司;TCX-600S超声波清洗机 济宁天宇超声机械设备有限公司;1510型全波长酶标仪 美国Thermo Scientific公司;H1850型离心机 湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 唐古特白刺果实花色苷的制备
按照本实验室建立的唐古特白刺总花色苷的分离纯化方法[11]制备唐古特白刺总花色苷样品。具体步骤如下:用粉碎机粉碎唐古特白刺干果,粉末用0.1%(体积分数,下同)HCl-70%甲醇溶液以料液比1∶10(m/V)、70 ℃提取32 min,提取液用旋转蒸发仪除去甲醇,然后用XDA-6大孔树脂分离纯化,得到纯化后的唐古特白刺果实花色苷。将唐古特白刺果实花色苷溶液冷冻干燥保存于-20 ℃冰箱待用。采用高效液相色谱面积归一化法测得唐古特白刺果实花色苷中酰化花色苷占总花色苷的77.76%。
1.3.2 实验动物分组与喂养
30 只小鼠适应性喂养1 周后,随机分为3 组(每组10 只):对照组(N)、模型组(M)和唐古特白刺果实花色苷组(TA)。饲养条件:温度(22±2)℃,相对湿度(55±5)%,12 h光照/12 h黑暗饲养,自由进食与饮水。普通啮齿动物饲料为40%(质量分数,下同)玉米粉、26%小麦粉、10%麸皮、10%鱼粉、10%豆饼、2%矿物质、1%粗粉和1%维生素,高脂饲料为普通饲料与牛油以质量比3∶1制得,添加唐古特白刺果实花色苷的高脂饲料为普通饲料+1%花色苷粉末与牛油(质量比3∶1)[12],小鼠花色苷粉末摄入量为479.62 mg/kg。所有实验均遵守中国第四军医大学动物伦理委员会颁布的《实验动物管理条例》。对照组喂食普通饲料;模型组喂食高脂饲料;TA组喂食添加唐古特白刺果实花色苷的高脂饲料,持续饲养14 周,监测小鼠每天的进食量及形态、行动特征,每周末称量小鼠体质量一次,最后1 d禁食不禁水12 h,摘眼球取血,测量小鼠体长(鼻尖至肛门的长度),并收集肝组织、腹部脂肪和内脏脂肪。所有实验均按照国家科学技术委员会发布的实验动物管理指南(ISBN-100-309-15396-4)进行。
1.3.3 脂体指数的测定
小鼠处死后分离附睾周围脂肪并称质量,按式(1)计算脂体指数。

1.3.4 Lee’s指数的测定
小鼠处死前,测量每组小鼠的体质量和体长,按式(2)计算Lee’s指数。

1.3.5 血清AST和ALT活力、TC和TG质量浓度、HDL和LDL浓度的测定
收集的血液样本于3 000×g离心15 min,取上层血清于1.5 mL离心管中4 ℃贮存备用。血清AST和ALT活力、TC和TG质量浓度、HDL和LDL浓度均依据相应的试剂盒说明书进行测定。
1.3.6 肝匀浆中MDA含量、SOD和GSH-Px活力、PPAR-α、LXR-α、CD36和ACC质量浓度的测定
称取0.5 g肝脏组织,加入4.5 mL生理盐水后用手持匀浆机3 000 r/min充分匀浆,肝匀浆于3 000×g离心10 min,取上清液于离心管中贮存备用。MDA含量、SOD和GSH-Px活力、PPAR-α、LXR-α、CD36和ACC质量浓度均按相应试剂盒说明进行测定。
1.4 数据统计与分析
实验数据以 ±s表示,用GraphPad Prism 5.01软件中单因素方法分析和Tukey’s Multiple Comparison Test进行分析并作图,P<0.05为有显著性差异。
2 结果与分析
2.1 唐古特白刺果实花色苷对高脂饮食小鼠体质量的影响
整个实验过程中,对照组小鼠食欲正常、毛色光洁且行动灵活,未出现异常特征。与对照组比较,模型组小鼠毛色油亮、行动迟缓且体型肥胖。与模型组比较,TA组小鼠毛色和体型得到很好地改善,毛色光洁、体态均匀灵活。实验过程中各组小鼠均未死亡。
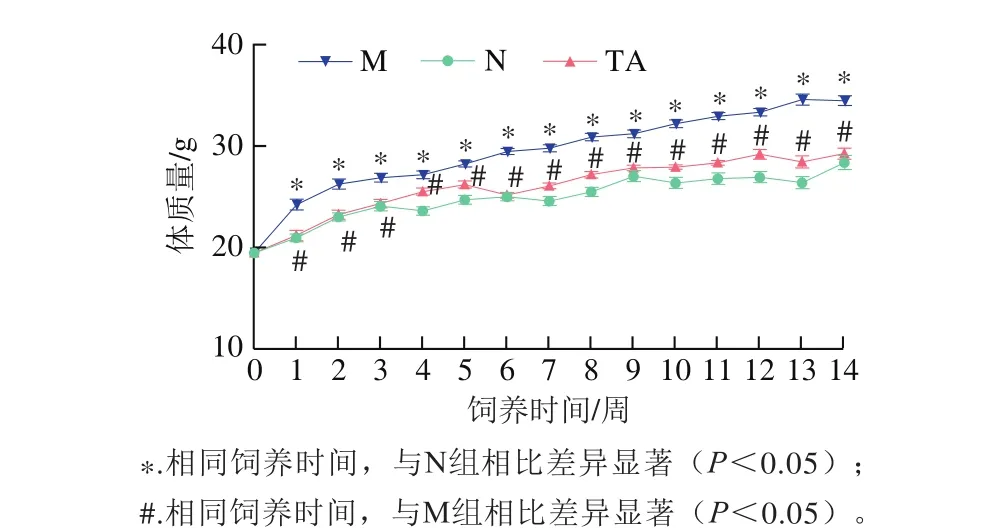
图1 唐古特白刺果实花色苷对高脂饮食小鼠体质量的影响Fig. 1 Effects of anthocyanins from N. tangutorun Bobr. on HFD-induced body mass gain in C57BL/6J mice
体质量异常是长期高脂饮食引起的主要健康问题之一[13]。如图1所示,从第2周开始,模型组小鼠体质量显著高于对照组,TA组小鼠体质量显著低于模型组,对照组和TA组小鼠体质量没有显著性差异;第9周后,模型组小鼠体质量增长速率并未减慢,对照组和TA组小鼠体质量增长缓慢。与模型组相比,TA组小鼠体质量增长情况得到改善。
2.2 唐古特白刺果实花色苷对高脂饮食小鼠常规生理指标的影响

表1 唐古特白刺果实花色苷对C57BL/6J小鼠常规生理指标的影响Table 1 Effects of anthocyanins from N. tangutorun Bobr. on food intake, abdominal fat mass, body fat index, visceral fat mass, body length and Lee’s index in HFD-fed C57BL/6J mice
表1结果显示,对照组、模型组和TA组小鼠进食量无明显差异。连续14 周摄入高脂饮食导致模型组小鼠的腹部脂肪质量、脂体指数、内脏脂肪质量以及Lee’s指数与对照组小鼠比较分别显著增加了263.64%、192.16%、90.91%和8.93%(P<0.05)。而与模型组比较,TA组小鼠腹部脂肪质量、脂体指数、内脏脂肪质量以及Lee’s指数显著降低,且Lee’s指数与对照组相比无显著差异。
2.3 唐古特白刺果实花色苷对高脂饮食小鼠肝脏损伤的影响
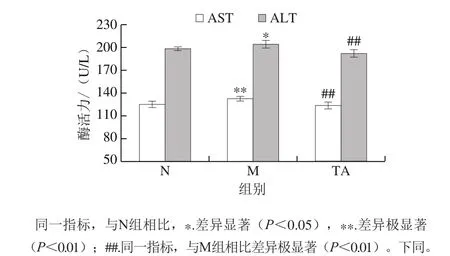
图2 唐古特白刺果实花色苷对C57BL/6J小鼠血清中AST和ALT活力的影响Fig. 2 Effects of anthocyanins from N. tangutorun Bobr. on AST and ALT activity in serum of C57BL/6J mice
血清AST和ALT活力是评价肝损伤程度的经典指标,肝损伤发生时,血清AST和ALT活力会显著升高[14]。如图2所示,与对照组比较,模型组小鼠血清中AST和ALT活力显著增加,表明长期摄入高脂饮食导致了明显的肝损伤。而与模型组比较,唐古特白刺果实花色苷极显著降低了小鼠血清中AST和ALT活力(P<0.01)。
2.4 唐古特白刺果实花色苷对高脂饮食小鼠肝脏脂肪代谢的影响
长期摄入高脂饮食在导致体质量异常增加的同时,通常伴随着脂质代谢紊乱的发生,而脂质代谢紊乱是NAFLD的主要诱因[15]。肝脏发生脂肪性病变时,脂肪代谢能力下降,导致血液中TC和TG质量浓度上升。LDL和HDL与胆固醇在体内的运输相关,其浓度会随着血液中TC和TG质量浓度的变化而变化[16]。如图3所示,与对照组比较,模型组小鼠血清中TC、TG质量浓度和LDL浓度极显著增加(P<0.01),而HDL浓度极显著降低(P<0.01),表明长期摄入高脂饮食导致了明显的肝脏脂肪代谢异常。而与模型组比较,唐古特白刺果实花色苷极显著降低了小鼠血清中TC、TG质量浓度和LDL浓度(P<0.01),并极显著提高了血清HDL浓度(P<0.01)。
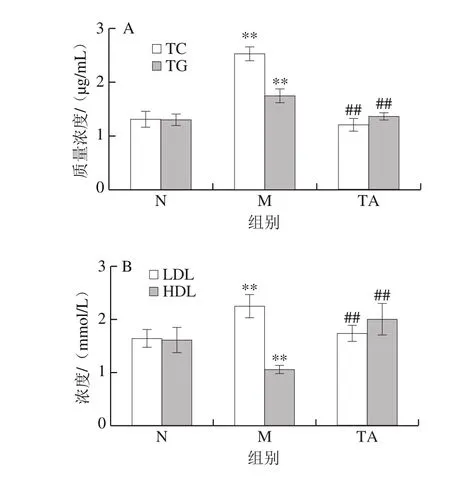
图3 唐古特白刺果实花色苷对C57BL/6J小鼠血清中TC和TG质量浓度(A)、LDL和HDL浓度(B)的影响Fig. 3 Effects of anthocyanins from N. tangutorun Bobr. on TC and TG (A), LDL and HDL (B) levels in serum of C57BL/6J mice
2.5 唐古特白刺果实花色苷对高脂饮食小鼠肝匀浆中MDA含量、SOD和GSH-Px活力的影响


图4 唐古特白刺果实花色苷对C57BL/6J高脂饮食小鼠肝匀浆中MDA含量(A)、SOD活力(B)和GSH-Px活力(C)的影响Fig. 4 Effects of anthocyanins from N. tangutorun Bobr. on MDA (A),SOD (B) and GSH-Px (C) levels in liver homogenate of C57BL/6J mice
如图4所示,与对照组比较,模型组小鼠肝脏MDA含量和SOD活力极显著升高,GSH-Px活力极显著降低(P<0.01)。与模型组比较,TA组小鼠肝脏MDA含量和SOD活力极显著降低,GSH-Px活力极显著升高(P<0.01)。
2.6 唐古特白刺果实花色苷对高脂饮食小鼠肝匀浆中PPAR-α、LXR-α、CD36和ACC质量浓度的影响
如图5所示,与对照组比较,模型组小鼠肝匀浆中LXR-α、CD36和ACC质量浓度极显著升高(P<0.01),而PPAR-α质量浓度极显著降低(P<0.01)。与模型组比较,TA组小鼠肝匀浆中的LXR-α、CD36和ACC质量浓度极显著降低,PPAR-α质量浓度极显著升高(P<0.01)。
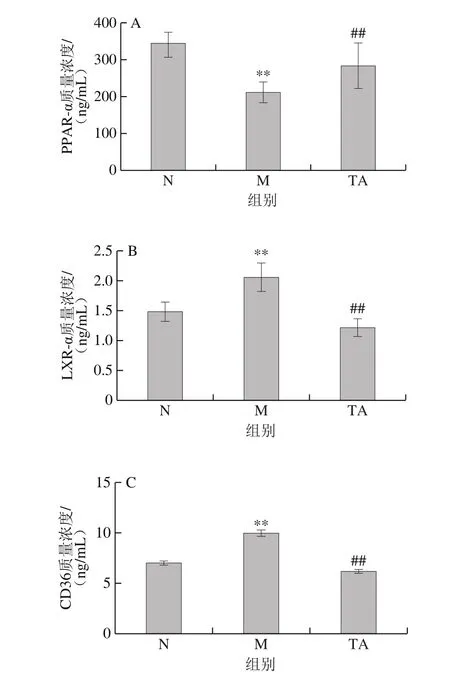

图5 唐古特白刺果实花色苷对C57BL/6J小鼠肝匀浆中PPAR-α(A)、LXR-α(B)、CD36(C)和ACC(D)质量浓度的影响Fig. 5 Effects of anthocyanins from N. tangutorun Bobr. on PPAR-α (A),LXR-α (B), CD36 (C) and ACC (D) levels in liver homogenate of C57BL/6J mice
3 讨 论
高脂饮食诱导的肥胖在动物模型中主要表现为体质量增加、体脂积累、肝脏损伤和血脂异常[17]。小鼠连续14 周摄入高脂饮食引起了其体质量、腹部脂肪质量、Lee’s指数、血清AST和ALT活力、TC和TG质量浓度显著增加,与已有报道的结果[17-18]一致,进一步证实了长期摄入高脂饮食会导致肥胖、肝脏损伤和高甘油三酯血症。高脂饮食诱导的血脂异常不仅与增加血清TC、TG质量浓度和LDL浓度有关,也与降低血清中的HDL浓度紧密相关[19]。与模型组相比,TA组小鼠体质量增长情况明显改善,脂体指数、内脏脂肪质量以及Lee’s指数显著降低,表示脂肪肝得到一定改善;血清中AST和ALT活力、TC和TG质量浓度、LDL浓度极显著降低,HDL浓度极显著升高,表明唐古特白刺果实花色苷能够改善肝损伤和肝脏脂肪代谢。
体质量异常与血脂代谢紊乱仅是高脂饮食诱导NAFLD的前期阶段,在脂质过氧化和氧化应激的作用下NAFLD将进一步恶化[20]。活性氧具有与脂质反应的巨大潜力,特别是与多种不饱和脂肪酸发生反应,从而导致细胞膜损伤。MDA被广泛用作脂质过氧化和氧化应激的标志物,其在机体内的水平会因为高脂饮食的摄入而显著提高[21]。SOD是自由基天然清除剂,当机体受到感染、创伤并出现一个或多个脏器功能衰竭时,体内SOD活力增高[22]。本研究发现,模型组小鼠肝脏MDA含量和SOD活力显著高于对照组,这表明高脂饮食引起了小鼠体内脂质过氧化程度的加深,且有肝脏功能衰竭迹象,与先前报道结果[22]一致。体内固有的抗氧化酶GSH-Px能通过清除活性氧和脂质过氧化产物而有效预防机体的氧化应激损伤[23],但高脂饮食的摄入降低了体内GSH-Px的活力,进而削弱机体的天然抗氧化防御系统。与模型组相比,TA组小鼠肝组织中MDA含量和SOD活力极显著降低,GSH-Px活力极显著升高,说明唐古特白刺果实花色苷通过调节肝脏氧化应激改善高脂饮食诱导的NAFLD损伤。
肝脏是脂肪合成和分解的重要场所[24]。脂肪酸合成起始于乙酰-CoA转化成丙二酸单酰-CoA,这步反应是在ACC作用下实现的。在脂肪合成途径中,ACC催化的反应不仅是第1步反应,同时也是限速步骤[25]。LXR-α激活后能增加脂肪酸合成相关基因的表达,提高血浆甘油三酯的水平[26]。LXR还能直接调节脂肪酸合成相关基因如脂肪酸合成酶、ACC和硬脂酰辅酶A去饱和酶1的表达[27]。Koonen等发现CD36主要通过促进TG的合成增加脂肪酸的摄取,从而加速NAFLD的形成[28]。本研究发现,模型组小鼠肝脏ACC、LXR-α和CD36质量浓度显著高于对照组,与先前报道结果[28]一致。PPAR-α是脂质代谢过程的关键因子[29],PPAR-α水平的降低会引起一系列与脂质代谢相关蛋白质和酶基因转录水平的降低,使肝脏线粒体内脂肪酸的β氧化能力减弱,引发脂质堆积。脂肪沉积的肝细胞可发生脂性改变,诱发和加剧胰岛素抵抗及炎症反应,促进NAFLD的发生[30]。本研究结果表明,与模型组相比,TA组小鼠肝组织中ACC、LXR-α和CD36质量浓度极显著降低,PPAR-α质量浓度极显著提高,说明唐古特白刺果实花色苷通过调节肝脏脂质代谢改善高脂饮食诱导的小鼠NAFLD损伤。
综上所述,唐古特白刺果实花色苷能明显降低高脂饮食小鼠的体质量、腹部脂肪质量、脂体指数、内脏脂肪质量、体长以及Lee’s指数,降低高脂小鼠血清AST和ALT活力、TC和TG质量浓度、LDL浓度,提高HDL浓度,通过降低肝组织匀浆中MDA含量、SOD活力并提高GSH-Px活力缓解高脂饮食导致的肝脏氧化应激损伤,并通过降低脂肪合成相关酶和受体(ACC、LXR-α和CD36)质量浓度、上调脂肪分解相关的转录因子(PPAR-α)质量浓度调节肝脏脂质代谢,最终改善高脂饮食诱导的NAFLD损伤。因此,唐古特白刺果实花色苷作为潜在的功能食品在NAFLD的治疗中具有重要的意义。
