超声-转谷氨酰胺酶改善红豆蛋白功能性质及结构
2019-10-30赵城彬尹欢欢刘景圣许秀颖吴玉柱齐宝坤
赵城彬,尹欢欢,刘景圣,许秀颖,张 浩,吴玉柱,曹 勇,齐宝坤*,吴 非*
(1.吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
红豆又叫红小豆、赤豆等,是我国重要的豆科植物,在我国种植和利用已有2 000多年的历史。作为淀粉质豆类,红豆中含有丰富的膳食纤维和一定量的钙、磷、铁以及B族维生素等。其中淀粉质量分数最高,为41.83%~59.89%,其次为蛋白质,其质量分数为16.33%~29.2%,氨基酸种类齐全且组成均衡,是一种潜在的优质豆类蛋白资源[1]。转谷氨酰胺酶(transglutaminase,TG)是一种由一个多肽链组成的蛋白质,其结构中含有331 个氨基酸。TG是一种对Ca2+不敏感的有益酶,并能在宽泛的pH值范围内发挥作用。TG可使许多蛋白质系统形成异肽键并发生交联反应,这些异肽键的形成表明TG处理可以修饰蛋白质结构,进而导致蛋白质功能性质的改变,甚至使蛋白质产生新特性[2]。Hwang等[3]研究表明红豆蛋白含有大量的赖氨酸,通过TG交联能够形成ε-(γ-谷氨酰胺)赖氨酸异肽键,利于改善蛋白质的乳液性质和凝胶的溶解度。
蛋白质的适当变性可以促进蛋白质对TG的敏感性,通过热处理或添加亚硫酸氢盐等还原剂使蛋白质变性可以增强TG催化蛋白质之间的交联反应[4]。近年来,超声技术由于具有空化效应、剪切作用以及湍流作用,广泛应用于食品蛋白的加工中,并成为国内外的研究热点。何秋实[5]研究超声处理对红豆蛋白功能性质影响,并采用拉曼光谱分析了红豆蛋白结构特征,发现超声处理能够修饰红豆蛋白二级结构,改善蛋白质溶解性、表面疏水性和乳化性。Xiong Ting等[6]发现采用低频(20 kHz)超声处理30 min能够引起豌豆蛋白的适当变性,诱导蛋白分子部分展开,同时改善蛋白质的功能性质。超声引起蛋白质变性的效率高,可为促进TG交联蛋白质提供可能,且在常温下就能实现,避免高温和化学变性剂对蛋白质产生不利影响。目前,对红豆蛋白的研究均是采用单独超声处理或单独TG处理,鲜见关于超声-TG联合作用于红豆蛋白结构修饰及功能性质改善的相关报道。
本实验的目的是考察超声是否能够改变红豆蛋白的致密结构,并提高蛋白质对TG的敏感性,从而促进TG对蛋白质的修饰和功能性质的改善作用。采用超声-TG联合处理红豆蛋白,对其乳化性、发泡性和凝胶性进行研究,并分析其表面疏水性、游离巯基含量、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)和热特性,以期探究其结构修饰与功能性质的构效关系,为研发高功能性红豆蛋白及阐明其相关机理提供理论依据。
1 材料与方法
1.1 材料与试剂
红豆品种为‘白红11号’(蛋白质量分数21.59%、淀粉质量分数56.82%、脂肪质量分数0.74%、纤维质量分数7.98%、水分质量分数8.12%、灰分质量分数3.43%),购自吉林省白城市。
TG、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonate,ANS)、溴化钾 美国Sigma公司;5,5’-二巯基-2-硝基苯甲酸(5,5’-dithiobis-2-nitrobenzoic acid,DTNB) 青岛捷世康生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JY92-2D超声探头发生器 宁波新芝生物科技股份有限公司;高速离心机 上海安亭科学仪器厂;Alpha1-4LDplus冷冻干燥机 德国Christ公司;DU800型紫外-可见分光光度计 美国贝克曼库尔特有限公司;台式扫描电子显微镜 荷兰Phenom公司;TA-XT2质构仪 英国Stable Micro Systems公司;F-4500荧光分光光度计 日本Hitachi公司;VERTEX 70 FTIR仪德国Bruker公司;PE Pyris 6差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司。
1.3 方法
1.3.1 红豆分离蛋白的制备
将红豆60 ℃烘干后脱皮,然后粉碎过60 目筛,采用正己烷以4∶1(m/V)的比例对红豆粉进行脱脂3 h,6 000×g离心20 min后,将沉淀风干得到脱脂红豆粉。将脱脂红豆粉与蒸馏水以1∶10(m/V)的比例混合,采用2 mol/L NaOH溶液调pH值至8.5,在50 ℃下搅拌提取2 h,然后在6 000×g条件下离心20 min,采用2 mol/L HCl溶液调节上清液pH值至4.5,然后以同样的条件离心,取沉淀水洗3 次,将沉淀复溶后调节pH值为7.0,然后冷冻干燥即得红豆分离蛋白(red bean protein isolate,RBPI)。采用凯氏定氮法(GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》)测定蛋白质量分数,得到RBPI中蛋白质量分数为90.86%。
1.3.2 超声-TG处理RBPI
将适量的RBPI溶解于蒸馏水中,室温下搅拌2 h,得到质量分数9%的蛋白溶液。实验分为单独超声(US)处理组和超声-TG(US-TG)组,对于US处理组:采用400 W、20 kHz条件下进行超声处理0、5、10 min,超声处理采用间歇式(超声2 s、间歇4 s),且样品置于冰浴中,保持温度为25~30 ℃。对于US-TG处理组:向超声处理后的蛋白溶液中添加20 U/g TG,1 000 r/min搅拌2 min确保酶在样品中均匀分散。将样品分为两部分,一部分在40 ℃下反应2 h,冷冻干燥,用于乳化性、发泡性及结构测定;另一部分在40 ℃下反应6 h,4 ℃冷藏过夜,用于凝胶微观结构和质构分析。对照组为未经超声及TG处理的RBPI,其他处理与实验组样品相同。
1.3.3 乳化性测定
将蛋白样品溶解于0.01 mol/L、pH 7.0的磷酸盐缓冲液中,使蛋白质量浓度为2 mg/mL。以1∶3的体积比添加大豆油,于22 000 r/min下均质2 min,分别在0 min和10 min时,从测试管底部取样50 µL,用0.1 g/100 mL SDS溶液稀释100 倍,测定500 nm波长处的吸光度,以0.1 g/100 mL SDS溶液为空白。乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)的计算分别见公式(1)、(2)。
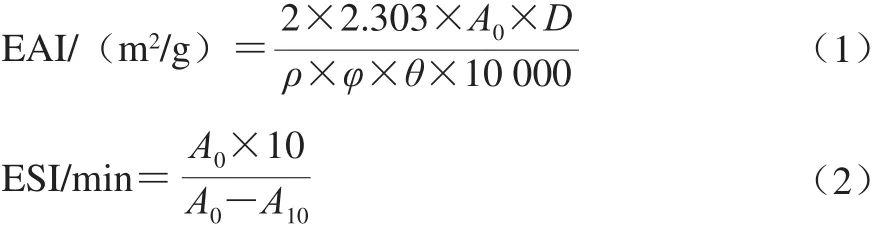
式中:D为稀释倍数(100);ρ为蛋白质量浓度/(g/mL),φ为比色皿光程(1 cm);θ为乳液中油相所占比例(0.25),A0和A10分别为0 min和10 min时的吸光度。
1.3.4 发泡性测定
将蛋白样品溶解于0.01 mol/L、pH 7.0的磷酸盐缓冲液中,配制成1 g/100 mL的蛋白溶液,在10 000 r/min下均质5 min,立即记录泡沫体积V0/mL。静置30 min后,再次记录泡沫体积V30/mL。发泡能力(foaming capacity,FC)及泡沫稳定性(foaming stability,FS)计算分别见公式(3)、(4)

式中:Vs为样品溶液体积/mL。
1.3.5 凝胶微观结构观察
采用扫描电子显微镜观察凝胶样品的微观结构。参照Xu Xiuying等[7]的方法,取一定量凝胶样品放于离心管中,迅速液氮冷冻,然后冷冻干燥脱水。将冻干样品置于铝箔上,用双面胶碳带固定,然后离子溅射喷金,置于扫描电子显微镜观察台上进行微观结构观察。设置加速电压为5 kV,放大500 倍。
1.3.6 凝胶质构特性测定
采用TA-XT2质构仪对凝胶质构特性进行测定。首先将凝胶样品在室温下静置一定时间,然后将样品放于测量台上,采用P/0.5的探头进行测定,模式选择TPA模式,设置压缩前速率3.0 mm/s,压缩中速率2.0 mm/s,压缩后速率3.0 mm/s,凝胶压缩比例为30%,两次下压间隔5 s,触发力为5 g。记录凝胶的硬度和黏附力。
1.3.7 凝胶脱水收缩作用测定
将凝胶样品(质量为mt/g)在室温下静置10 min以达到温度平衡,然后在室温下以5 000 r/min离心10 min,取上清液测定其质量(ms/g),并计算脱水收缩作用(公式(5))。
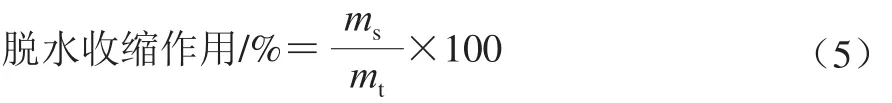
1.3.8 表面疏水性和游离巯基含量测定
蛋白质表面疏水性通过疏水荧光探针ANS测定,荧光激发波长和发射波长分别为390 nm和470 nm。蛋白样品溶液质量浓度为0.05~1.00 mg/mL,取8 mmol/L ANS溶液40 μL添加到4 mL的蛋白溶液中,混匀后测定荧光强度,蛋白质表面疏水性用荧光强度对蛋白浓度的斜率表示。
游离巯基含量采用Ellman’s试剂(10 mmol/L DTNB)测定,吸光度采用紫外-可见分光光度计在412 nm波长处测定,游离巯基含量采用摩尔消光系数13 600 L/(mol·cm)计算,以每克蛋白质中含有的巯基物质的量表示,单位为μmol/g。
1.3.9 FTIR测定
参照Zhao Chengbin等[8]的方法进行FTIR测定,将0.1 mg蛋白样品与4 mg溴化钾用研钵充分研磨成均匀粉末,压制成薄片,然后进行全波段扫描(4 000~400 cm-1),扫描次数为64 次,分辨率为4 cm-1,测定温度为25 ℃。采用红外光谱图分析软件Peak Fit 4.12对图谱的酰胺I带1 700~1 600 cm-1进行分析,计算蛋白质各二级结构含量。
1.3.10 热特性测定
参考赵城彬等[9]的方法,样品的热特性通过DSC仪测定。取3 mg蛋白样品于铝盘中,压片并以空铝盘为对照。以5 ℃/min的升温速率由20 ℃升至120 ℃,氮气流速为50 mL/min。记录此过程的起始温度(To)、峰值温度(Tp)、终止温度(Te)和热焓变(ΔH)。
1.4 数据统计与分析
每组实验重复3 次,采用Origin 8.0软件作图,采用SPSS 17.0软件进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同处理对RBPI乳化性的影响
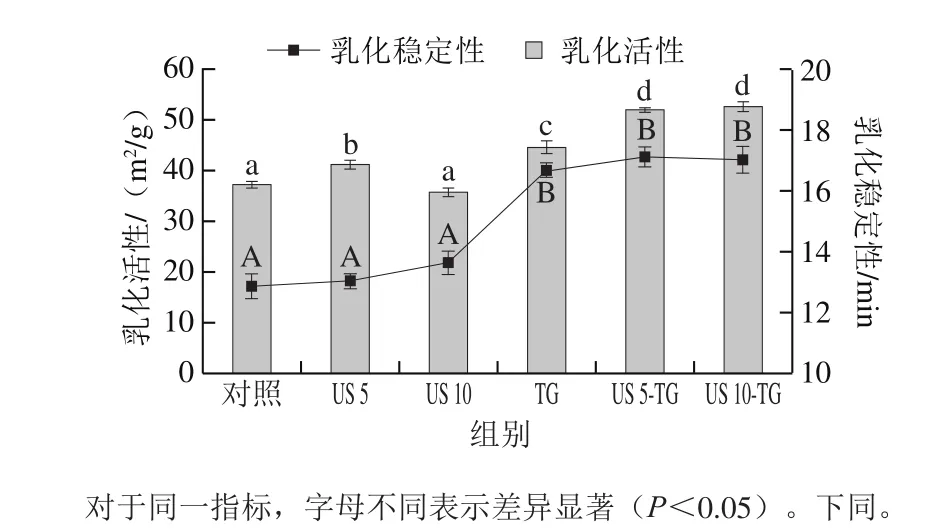
图1 超声-转谷氨酰胺酶处理对RBPI乳化性的影响Fig. 1 Effect of US-TG treatment on emulsifying properties of RBPI
如图1所示,超声和TG均对乳化活性具有很大的影响。与对照相比,超声处理5 min能够使RBPI的乳化活性显著增加(P<0.05),而超声处理10 min会使RBPI的乳化活性稍有降低,但影响不显著(P>0.05)。短时间超声处理能够使蛋白质部分展开,分子柔顺性增加,同时促进蛋白质溶解,利于乳化活性的改善;然而长时间超声处理会使水相中的蛋白质聚集,导致体系的乳化活性降低。Chandrapala等[10]也报道了超声处理α-乳白蛋白和β-乳球蛋白混合物能够提高蛋白质聚集,降低表面疏水性,从而影响其乳化性能。TG能够使RBPI的乳化活性提高,这是由于TG催化蛋白质相互交联,促进了蛋白粒子的两亲特性,并且增强了肽链-脂肪相互作用。因此,肽链更容易被吸附在水-脂肪界面上,导致乳化活性增强。在多肽形成过程中引起的静电排斥可能防止蛋白质积聚,从而减少蛋白质聚集[11]。Anuradha等[12]报道了TG处理β-乳球蛋白能使蛋白质乳化活性提高约30%。然而,超声-TG联合处理能够使RBPI的乳化活性进一步提高,这可能是因为超声处理使RBPI的分子链展开,暴露出更多的基团,导致TG交联蛋白质的能力提高。
无论是否添加TG,超声处理对乳液稳定性均没有显著影响(P>0.05),而TG处理的RBPI乳化稳定性显著提高(P<0.05)。Fraergemand等[13]也得到了相似的结果,他们发现TG处理的β-乳球蛋白与天然β-乳球蛋白形成的乳液相比,稳定性得到了改善。TG处理形成异肽键可能是改善蛋白质乳液稳定性的原因,如泡沫和乳液的稳定性。
2.2 不同处理对RBPI发泡性的影响
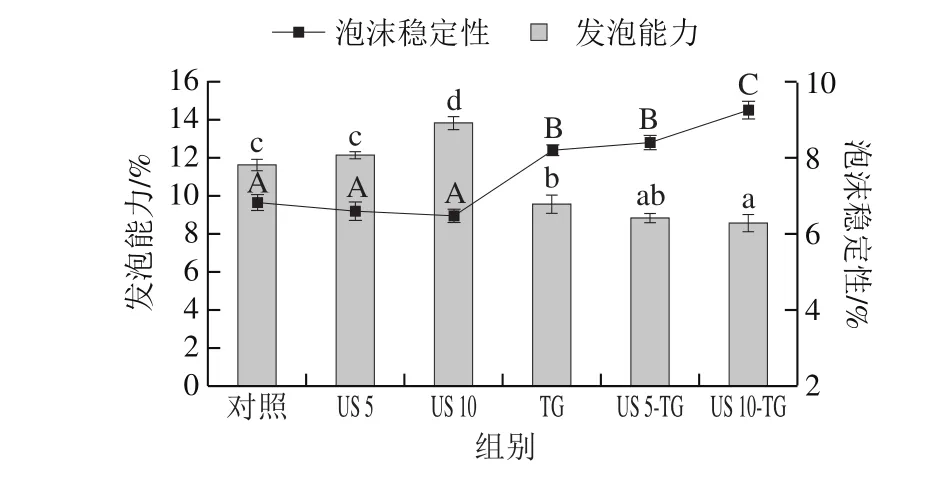
图2 超声-转谷氨酰胺酶处理对RBPI发泡性的影响Fig. 2 Effect of US-TG treatment on foaming properties of RBPI
由图2可知,超声处理显著提高了RBPI的发泡能力(P<0.05),且超声处理10 min的发泡能力显著高于超声处理5 min的样品。由此可以推断,超声通过均质化作用使脂肪和蛋白颗粒在溶液中分布得更加均匀,从而对样品发泡能力具有积极作用。此外,超声处理能够使蛋白分子尺寸减小,这利于蛋白质发泡能力的改善[14]。Jambrak等[15]报道了采用20 kHz和40 kHz的高强度超声处理15 min,乳清分离蛋白的发泡能力由132%分别增加至235%和220%。此外,还有研究也发现高强度(20 kHz和40 kHz)超声对α-乳白蛋白同样具有类似的影响,而低强度超声却不能改善样品的发泡特性[5]。相反,TG的添加会破坏乳清蛋白的发泡能力。蛋白质的发泡能力与它在空气-水界面上形成一层薄而坚固的液膜能力有关,并影响膜内气泡的形成[14]。TG降低发泡能力的一个合理解释是,TG的添加增强了蛋白质的交联和黏度,使蛋白质颗粒失去了吸附在空气-水界面上的能力,从而抑制泡沫的形成。此外,与TG相比,超声-TG联合处理使RBPI的发泡能力进一步降低。
泡沫稳定性也受超声和TG处理的影响。超声处理会降低样品的泡沫稳定性,超声处理10 min的样品与其他样品相比泡沫稳定性下降,但在整个超声处理过程中没有显著性变化(P>0.05)。然而,Jambrak等[15]发现400 W、20 kHz超声处理15 min对乳清分离蛋白的泡沫稳定性具有积极的作用,使泡沫稳定性由68.3 min增加至98.4 min。Tan等[16]也发现随着超声振幅的增加和超声时间的延长,乳清蛋白泡沫析水减少。这些研究结果与本实验得到的结果之间存在差异,这可能是植物蛋白(红豆蛋白)和动物蛋白(乳清蛋白)性质不同以及超声处理条件的不同等多方面因素的结果。TG对发泡能力和泡沫稳定性的影响是相反的。TG处理破坏了样品的发泡能力,却形成了更稳定的泡沫。这说明发挥蛋白质交联作用的共价键作为发泡能力的不良因素似乎是泡沫稳定性的促进剂。Agyare等[17]也报道了在不同pH值水平下,TG处理的小麦谷蛋白水解物的发泡能力与泡沫稳定性之间成反比关系。此外,超声10 min联合TG处理使RBPI的泡沫稳定性得到显著提高(P<0.05),这也说明了TG处理蛋白质之前的超声处理能够提高蛋白质的交联程度,从而改善泡沫稳定性。
2.3 不同处理对RBPI凝胶性质的影响
2.3.1 凝胶微观结构
许多学者对TG诱导的各种蛋白质凝胶微观结构做了大量研究[18],因此,本实验探究了超声和TG联合作用对RBPI凝胶微观结构的影响。如图3所示,未经超声处理的条件下,TG诱导的RBPI凝胶具有松散片状的微观结构,在蛋白凝胶网络中具有较大的孔隙,更少的交联,更不均匀的结构(图3A)。超声和TG的联合处理对凝胶微观结构具有很大的影响(图3B、C)。超声处理可使TG诱导凝胶的微观结构更加均匀致密,且孔隙度更小,超声处理5 min联合TG诱导的凝胶样品与其他样品相比微观结构更加均匀。Zhao等[19]也报道了山羊奶经超声处理后凝胶结构发生了显著变化,他们指出,超声预处理可以使山羊奶形成更紧凑的凝胶结构,导致孔隙更小。Riener等[20]在超声处理的酸奶凝胶中也得到了同样的结果,即超声处理促进了蛋白质分子之间的交联。研究发现超声的空化效应会导致蛋白分子部分展开并暴露出活性基团[21],这可能会促进TG催化的交联反应,导致凝胶微观结构出现差异。
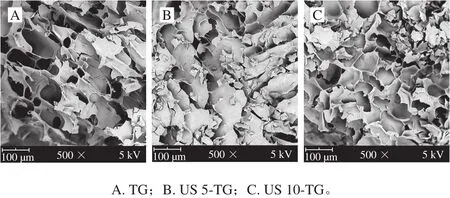
图3 超声-转谷氨酰胺酶诱导的RBPI凝胶扫描电子显微镜图(×500)Fig. 3 Scanning electron microscope (SEM) images of RBPI gel induced by US-TG treatment (× 500)
2.3.2 凝胶质构特性和脱水收缩作用
超声和TG处理对组分之间的相互关系和结构性质均具有重要影响,因此两者联合作用能够改善蛋白质凝胶的质构特性。如表1所示,质量分数9%的RBPI溶液经过TG处理能够形成具有一定硬度(965.9 g)和黏附力(11.65 g·s)的凝胶。Gauche等[22]研究发现向乳清蛋白中添加TG可以改善凝胶的质构特性,其硬度和黏附力均得到改善。超声处理能够使TG诱导的RBPI凝胶硬度和黏附力增加。Frydenberg等[23]也报道了超声处理对乳清蛋白凝胶的硬度具有相似的影响,他们发现由于二硫键含量的增加,非热条件下的超声处理显著提高了蛋白质的凝胶硬度。然而,当超声处理达到10 min时,TG诱导的凝胶样品硬度相比于超声处理5 min的样品硬度显著降低(P<0.05),这可能是由于超声促进了TG对蛋白质的交联作用,但过度交联会形成超长分子的蛋白质,不利于凝胶网络均匀结构的形成[14]。在相同条件下,超声处理5 min不会使TG诱导的RBPI凝胶黏附力发生显著改变,超声处理10 min才能使凝胶黏附力显著升高(P<0.05),这可能仅仅与样品表面特性的改变有关。由此可以推断,长时间超声处理促进了TG的交联作用,而交联过程中形成的共价键可能是蛋白凝胶黏附力增强的原因[24]。
TG诱导的RBPI凝胶的脱水收缩作用为4.08%,超声处理显著降低了TG诱导凝胶的脱水收缩作用(P<0.05)。与超声10 min联合TG处理的凝胶样品相比,超声5 min联合TG处理的凝胶样品具有更低的脱水收缩作用(表1)。可以推断,TG的交联作用使聚合度增加,从而降低了凝胶结构中的孔隙尺寸,形成更加均匀、一致的结构,此外超声处理也有助于样品中孔隙的均匀分布。然而,过长的超声时间会导致脱水收缩作用的增加,这可能是样品中过多聚集体形成导致的,超声10 min联合TG处理的凝胶样品就是最好证明。脱水收缩作用得到的结果与SEM结果一致,证实了超声和TG的联合作用是一个重建凝胶结构的可行方法,同时使凝胶结构更加均匀。Frydenberg等[23]报道在α-乳白蛋白与β-乳球蛋白质量比较高的溶液中,超声处理可以有效增加其凝胶持水性,这与本研究中降低脱水收缩作用的效果相同。这种脱水收缩作用下降可能是大量的解折叠和分子间二硫键数量增加从而形成更紧凑的凝胶结构导致的[25]。

表1 超声-转谷氨酰胺酶诱导的RBPI凝胶硬度、黏附力和脱水收缩作用Table 1 Hardness, adhesiveness and syneresis of RBPI gel induced by US-TG treatment
2.4 不同处理对RBPI表面疏水性和游离巯基含量的影响
表面疏水性用来表征在极性环境中蛋白质表面疏水残基的数量,可反映蛋白质构象变化。游离巯基是蛋白质中重要的官能团,它能参与弱次级键的形成,维持三级结构稳定,其含量能反映蛋白质的变性程度。表面疏水性和游离巯基含量均与蛋白质的功能性质密切相关。
如图4所示,与对照组相比,超声处理5 min的RBPI的表面疏水性显著增加(P<0.05),由507.43增加至562.75。超声处理会破坏蛋白质空间结构,使蛋白分子发生部分解折叠和展开,暴露出内部的疏水基团,导致表面疏水性增加[26]。然而,TG处理会使RBPI的表面疏水性显著降低(P<0.05),这可能是由于TG催化蛋白质交联,形成分子间和分子内共价键,蛋白质分子发生聚集,将疏水基团包裹在分子内部[17]。此外,Gauche等[27]报道采用TG处理乳清蛋白后,谷氨酰胺和ε-氨基发生部分脱酰胺反应,产生带负电的氨基酸,这也是导致表面疏水性降低的一个原因。超声-TG联合处理RBPI的表面疏水性进一步降低,这表明超声和TG联合处理具有协同作用,能够促进蛋白质的交联反应而发生聚集,造成疏水基团的内卷。
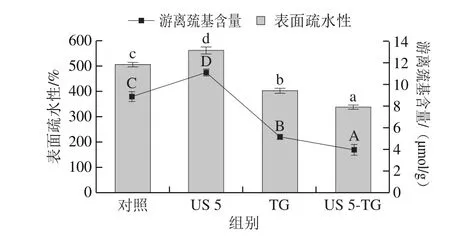
图4 超声-转谷氨酰胺酶处理对RBPI表面疏水性和游离巯基含量的影响Fig. 4 Effect of US-TG treatment on surface hydrophobicity and free sulfhydryl content of RBPI
游离巯基含量与表面疏水性变化趋势相似。超声处理会显著增加RBPI的游离巯基含量(P<0.05),这可能是由于超声产生的空化和微流束作用使蛋白质分子内和分子间的二硫键发生断裂,导致包埋于蛋白质内部的巯基基团暴露[28]。然而,经TG处理后RBPI的游离巯基含量显著下降(P<0.05),Stangierski等[29]采用TG处理肌原纤维蛋白也得到了类似的结果。TG通过交联作用使蛋白质形成高分子多聚体,在这个过程中游离巯基可转化为二硫键。经过超声-TG联合处理的RBPI具有更低的游离巯基含量,表明RBPI经过超声处理后更利于TG对蛋白质的交联作用。
2.5 不同处理RBPI的FTIR分析结果
蛋白质功能性质改善过程中其结构也发生改变,FTIR图谱能够有效提供蛋白质的结构信息。由图5可知,与未经处理的RBPI相比,超声处理后RBPI红外光谱的酰胺I带处吸收峰没有明显变化,而经TG处理和超声-TG联合处理后RBPI酰胺I带处吸收峰强度明显增加,这可能是由于TG催化蛋白质之间的交联作用,增加了氢键的形成[30]。此外,超声-TG联合处理的RBPI酰胺I带处吸收峰强度高于TG处理的RBPI,说明超声-TG联合处理进一步提高了TG的交联作用。
对FTIR光谱中的酰胺I带进行去卷积,然后进行二阶导数拟合,得到各子峰所对应的归属:1 650~1 660 cm-1为α-螺旋,1 618~1 640 cm-1和1670~1690 cm-1为β-折叠,1 660~1 670 cm-1和1 690~1 700 cm-1为β-转角,1 640~1 650 cm-1为无规卷曲[31]。通过峰面积计算得到各二级结构的含量,结果见表2。超声处理5 min后RBPI的α-螺旋和β-转角含量显著降低(P<0.05),无规卷曲含量显著增加(P<0.05),β-折叠含量变化不显著(P>0.05),这说明超声处理能够降低蛋白质二级结构的有序性,使二级结构变得更加无序。Hu Hao等[21]采用功率为200 W的超声处理大豆蛋白15 min,导致二级结构发生显著改变,无序结构含量大幅上升,这与本研究结果一致。与未经处理的RBPI相比,TG处理会导致RBPI的α-螺旋和无规卷曲含量显著降低(P<0.05),β-结构(β-折叠和β-转角)含量显著增加(P<0.05)。这可能是由于TG催化的酰基反应破坏了使α-螺旋结构规则排布的氢键的稳定性,而展开的多肽链暴露出更多的氢键以及疏水基团重新排列,导致在分子聚集过程中重新连接形成β-结构[32]。由此可以推断,TG处理后使RBPI分子二级结构变得更加有序,这也与TG催化蛋白质交联形成聚集体有关[33]。此外,超声5 min与TG联合处理会使更多的无规卷曲结构转变为β-折叠结构,这表明超声-TG联合处理能够促进蛋白质交联,是修饰蛋白质二级结构的有效手段。RBPI功能性质的改善可能与蛋白质二级结构的这种变化有关。
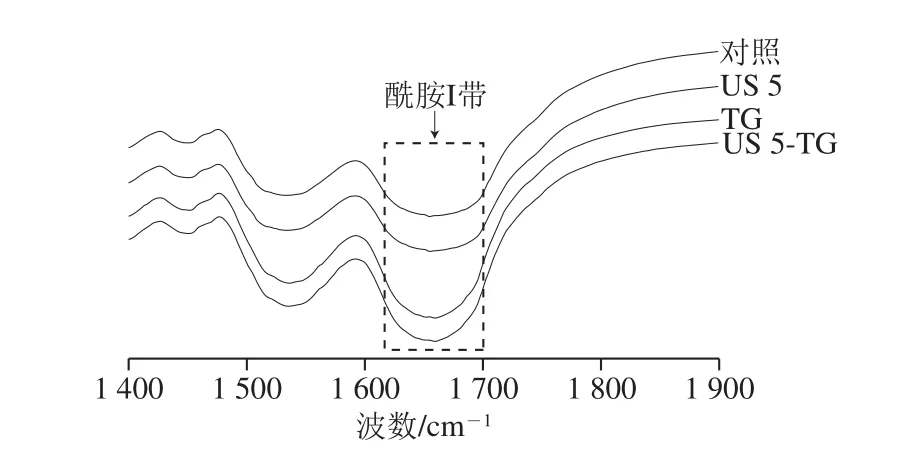
图5 超声-转谷氨酰胺酶处理的RBPI FTIR图Fig. 5 Fourier transform infrared spectra of RBPI treated by ultrasound and/or transglutaminase
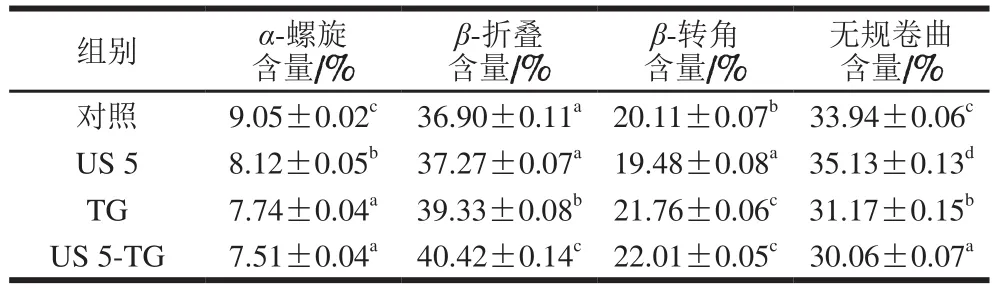
表2 超声-转谷氨酰胺酶处理的RBPI二级结构含量Table 2 Secondary structure content of RBPI treated by ultrasound and/or transglutaminase
2.6 不同处理对RBPI热特性的影响
热诱导蛋白质结构的变化伴随着热特性的改变,可通过DSC仪测定蛋白质变性过程中热量改变以及能量变化而分析蛋白质的热特性[34]。由图6可知,与未经处理的RBPI相比,超声处理5 min的RBPI反应吸收热降低,而TG处理和超声5 min联合TG处理的RBPI反应吸收热增加且向右偏移,说明蛋白质热稳定性发生改变。
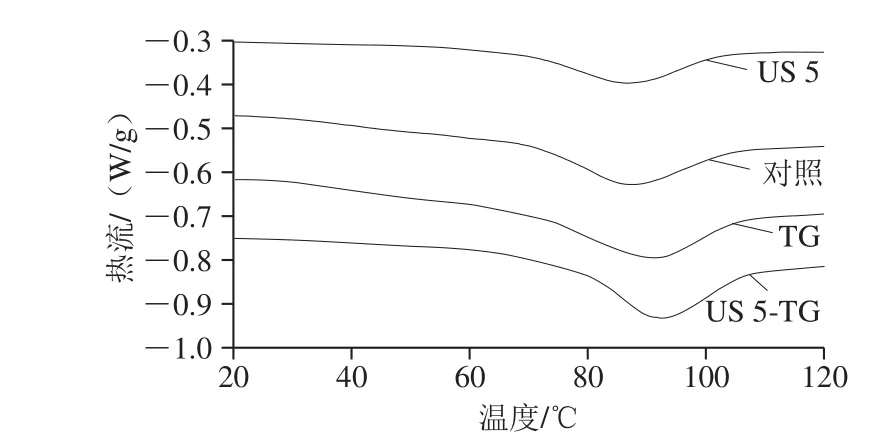
图6 超声-转谷氨酰胺酶处理的RBPI的DSC图Fig. 6 Differential scanning calorimetry (DSC) thermograms of RBPI treated by ultrasound and/or transglutaminase
在DSC结果中,峰值温度(Tp)即为蛋白质的变性温度,代表蛋白质的热稳定性;热焓变(ΔH)为蛋白质的有序结构,表征蛋白质分子的聚集程度[35]。由表3可知,与未经处理的RBPI相比,超声处理5 min的RBPI的Tp没有显著改变(P>0.05),均在87 ℃左右,而To和Te略有降低。然而,超声处理显著降低了RBPI的ΔH(P<0.05),这可能与蛋白质的折叠和聚集状态有关[36]。Dissanayake等[37]研究表明热焓变与有序的二级结构含量有关,有序结构的减少可能导致ΔH的降低,这可以由FTIR分析二级结构的结果中得到证实(表2)。TG处理组RBPI的Tp(91.41 ℃)显著高于未经处理RBPI的Tp(87.35 ℃)(P<0.05),这表明TG催化蛋白质之间的交联,有利于提高RBPI的热稳定性。TG的交联作用使蛋白质形成高分子质量聚合物,促进分子间与分子内相互作用,导致结构变的更加的紧凑而有序,因此增强了蛋白质的热稳定性[38]。经TG处理后RBPI的ΔH显著增加(P<0.05),这可能与TG促进无序的蛋白分子内、分子间疏水键的重新形成以及蛋白质交联形成聚集体有关[36]。此外,超声5 min与TG联合处理进一步增加了Tp和ΔH,由于超声引起的空化作用和微流束作用使蛋白质分子内部的基团暴露在分子表面[26],为TG的交联作用提供了更多的作用位点,利于蛋白质交联形成致密的空间结构,从而改善热稳定性或三级结构稳定性[39]。
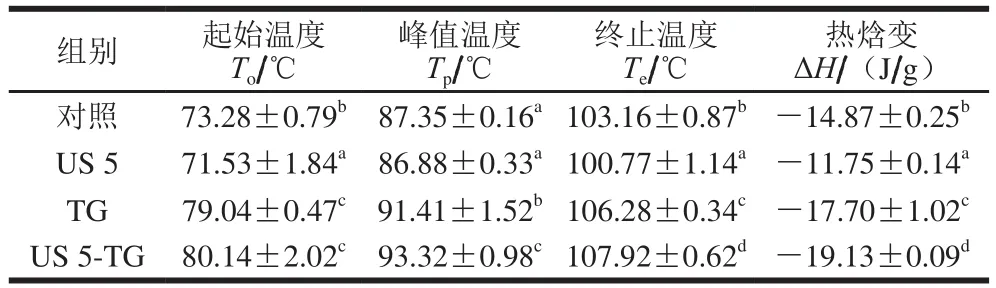
表3 超声-转谷氨酰胺酶处理的RBPI的DSC热力学参数Table 3 DSC thermodynamic parameters of RBPI treated by ultrasound and/or transglutaminase
3 结 论
超声处理能够使RBPI的乳化活性和发泡能力显著增加,但会降低泡沫稳定性。TG能够使RBPI的乳化活性和乳化稳定性提高,破坏样品的发泡能力,却形成了更稳定的泡沫。超声-TG联合处理能够进一步提高RBPI的乳化活性和泡沫稳定性。超声处理5 min联合TG诱导的RBPI凝胶微观结构更加均匀、致密,孔隙度更小,且凝胶硬度更大,脱水收缩作用更低,同时使蛋白质表面疏水性和游离巯基含量降低。FTIR和DSC分析表明,超声-TG联合处理能够使RBPI更多的无规卷曲结构转变为有序的β-折叠结构,且峰值温度和热焓变显著增加,有效改善蛋白质热稳定性,这表明RBPI经过超声处理后更利于TG催化蛋白质发生交联反应,超声-TG联合处理能促进蛋白质功能性质的发挥。
