不同来源红缘拟层孔菌粗多糖的抗氧化活性
2019-10-30聂琳然郝利民王滔滔张黎明鲁吉珂康彩彩韩培培贾士儒
聂琳然,郝利民,*,王滔滔,刘 阳,张黎明,鲁吉珂,3,康彩彩,崔 燕,韩培培,贾士儒,*
(1.天津科技大学 工业发酵微生物教育部重点实验室,天津 300457;2.军事科学院军需工程技术研究所,北京 100010;3.郑州大学生命科学学院,河南 郑州 450001)
机体长期处于辐射、高压、缺氧等应激环境时会产生大量自由基,过多的自由基会对机体造成严重的氧化损伤,进而引发癌症、糖尿病和动脉粥样硬化等多种疾病[1-2]。抗氧化剂能够有效改善氧化应激损伤,天然抗氧化剂具有来源广、毒性低、无副作用等优势,是当前研究的热点[3]。食药用真菌富含多糖、多酚、黄酮等多种抗氧化活性物质,不仅能有效清除多种自由基,还可与金属离子络合减少自由基的产生[4-5],其开发前景广阔。
红缘拟层孔菌(Fomitopsis pinicola)又名“红缘层孔菌”、“红缘多孔菌”、“红缘树舌”等,是一种药用价值较高的大型真菌,红缘拟层孔菌在我国分布较广,且以我国东北地区最为常见[6];其味微苦、性平,具补肺益肾、安神定志、扶正培本、滋补强壮和祛风除湿等作用,对肾炎、支气管炎、癌症、心脏病、糖尿病等有特效,民间常用于治疗“寒腿”病[7]。据报道,红缘拟层孔菌水提物具有抗肿瘤、抗菌抗炎、降血糖、免疫调节、抗氧化等作用[8]。多糖是红缘拟层孔菌的主要生物活性成分之一,具有抗氧化、抗肿瘤、保肝护肝等多种活性[9-12],在保健食品、功能性化妆品和抗肿瘤药物的开发方面具有很好的前景。近年,红缘拟层孔菌多糖抗氧化活性的主要研究对象为子实体多糖,对不同来源红缘拟层孔菌多糖抗氧化活性的对比研究报道甚少。不同来源的多糖在结构或组成上有明显差异,且对红缘拟层孔菌进行液态发酵培养,可有效解决其子实体生长周期长、自然资源少、培植难度大等问题。本实验对3 种不同产地(吉林、黑龙江、云南)红缘拟层孔菌子实体、菌丝体及其发酵液多糖的抗氧化活性进行比较研究,可为了解不同产地红缘拟层孔菌子实体、菌丝体及其发酵液多糖的抗氧化活性差异提供参考依据,有助于红缘拟层孔菌的开发利用。
1 材料与方法
1.1 菌株、材料与试剂
红缘拟层孔菌(Fomitopsis pinicola)菌种由军事科学院军需工程技术研究所提供;红缘拟层孔菌子实体分别购自吉林、黑龙江、云南,经军事科学院军需工程技术研究所鉴定。
酿酒酵母(Saccharomyces cerevisiae)A.S.2399由天津科技大学省部共建食品营养与安全国家重点实验室保藏。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、牛血清白蛋白 美国Sigma公司;其他试剂均为国产分析纯。
种子培养基:葡萄糖30 g/L、酵母粉5 g/L、KH2PO42 g/L、MgSO4·7H2O 10 g/L,pH 6;发酵培养基:蔗糖50 g/L、酵母粉10 g/L、KH2PO42 g/L、MgSO4·7H2O 10 g/L,pH 5;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20 g/L、酵母膏10 g/L、蛋白胨20 g/L,自然pH值。在液体培养基的基础上添加质量分数2%的琼脂制备固体培养基。
1.2 仪器与设备
JA12002型电子天平 上海精科天平仪器厂;PHSJ-4A型pH计 上海雷磁仪器厂;TDA-8002型恒温水浴锅天津市中环试验电炉有限公司;TGL16G型离心机 上海医用分析仪器厂;RE-3000型旋转蒸发仪 上海亚荣生化仪器厂;ALPHA 1-4/LD型冷冻干燥机 德国CHRIST公司;QL-902型漩涡振荡器 海门市其林贝尔仪器制造有限公司;UVmini-1240型紫外-可见分光光度计 岛津国际贸易(上海)有限公司。
1.3 方法
1.3.1 红缘拟层孔菌粗多糖的制备
将红缘拟层孔菌接种于液体发酵培养基中,在28 ℃、180 r/min下培养4.5 d,过滤分别得红缘拟层孔菌菌丝体(Fomitopsis pinicola mycelium,FPM)及其发酵液(F. pinicola fermentation broth,FPFB),FPM冷冻干燥。红缘拟层孔菌子实体(F. pinicola fruiting body,FPF)为自然风干,粉碎处理后,烘干至恒质量。
分别取FPM冻干粉及3 种不同产地(吉林、黑龙江、云南)FPF(分别记为JFPF、HFPF、YFPF)烘干粉各50 g,按料液比1∶25(m/V)加入蒸馏水,热水浸提(85 ℃、2 h)2 次,抽滤合并滤液,得多糖提取液。各多糖提取液和FPFB分别浓缩至原体积的1/5,加入3 倍体积95%(体积分数,下同)乙醇溶液,4 ℃醇沉12 h,离心(10 000 r/min、8 min)收集沉淀,沉淀用95%乙醇溶液洗2~3 次后冷冻干燥,得各样品粗多糖[13]。按式(1)计算粗多糖提取率。
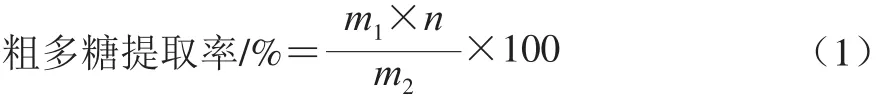
式中:m1为样品所得粗多糖质量/g;m2为样品质量/g;n为稀释倍数。
1.3.2 粗多糖中总糖和蛋白质量分数的测定
以葡萄糖为标准品,采用苯酚-硫酸法[14]测定粗多糖中总糖质量分数;以牛血清白蛋白为标准品,采用二喹啉甲酸(bicinchoninic acid,BCA)法[15]测定粗多糖中蛋白质量分数;以葡萄糖醛酸为标准品,采用咔唑-硫酸法[16]测定粗多糖中糖醛酸质量分数。
结合糖蛋白质量分数测定:分别将5 mg/mL、60 mL的JFPF、HFPF、YFPF、FPM、FPFB 5 种粗多糖溶液与20 mL Sevag试剂(氯仿、正丁醇体积比为4∶1)混合,磁力搅拌20 min,将溶液转移至分液漏斗,静置分层,去除蛋白层和氯仿相,收集水相,重复上述操作至蛋白层不再出现,真空浓缩,冷冻干燥,得脱蛋白粗多糖。采用BCA法[15]测定脱蛋白后粗多糖中蛋白质量分数,即结合糖蛋白质量分数。
1.3.3 分子质量分布的测定
待测多糖样品的制备:5 种粗多糖经AB-8大孔树脂脱色、Sevag法除蛋白、真空浓缩,冷冻干燥得待测样品。
采用高效凝胶渗透色谱法[17]对上述待测多糖样品的分子质量进行测定。色谱条件:色谱柱:TSK-GEL G4000 PW XL凝胶过滤柱(7.8 mm×30.0 cm,10 μm);流动相:超纯水;流速:0.5 mL/min;检测器:RI-101示差折光检测器;柱温:35 ℃;进样量:20 μL。
将已知分子质量的系列葡聚糖标准品在相同条件下测定,以分子质量对数为横坐标(X(lg Mw)),保留时间(Y/min)为纵坐标绘制标准曲线,得线性回归方程:Y=-0.274 3X+5.912 2(R2=0.998 8)。根据标准曲线计算红缘拟层孔菌多糖样品分子质量。
1.3.4 体外抗氧化活性的测定
1.3.4.1 DPPH自由基清除能力
分别将1 mL 1.0~5.0 mg/mL的5 种多糖样品溶液与0.5 mmol/L DPPH-乙醇溶液、60%乙醇按体积比1∶1∶10混合均匀,室温下避光反应30 min,于517 nm波长处测定吸光度(A517nm)。空白组和样品本底分别以等体积无水乙醇代替样品溶液和DPPH-乙醇溶液[18]。以VC为阳性对照。按式(2)计算DPPH自由基清除率。
式中:Ai为实验组A517nm;Aj为样品本底A517nm;A0为空白组A517nm。
1.3.4.2 ABTS阳离子自由基清除能力
将7.4 mmol/L ABTS和2.6 mmol/L过硫酸钾溶液等体积混合并于黑暗处静置12~16 h,用磷酸盐缓冲液(pH 7.4)稀释该混合液至其在734 nm波长处的吸光度为0.70±0.02,得ABTS工作液。分别取1 mL 1.0~5.0 mg/mL的5 种多糖样品溶液与ABTS工作液按体积比1∶6混合均匀,室温下反应6 min后于734 nm波长处测定吸光度(A734nm)。空白组和样品本底分别以等体积蒸馏水代替样品溶液和ABTS工作液[19]。以VC为阳性对照。按式(3)计算ABTS阳离子自由基清除率。
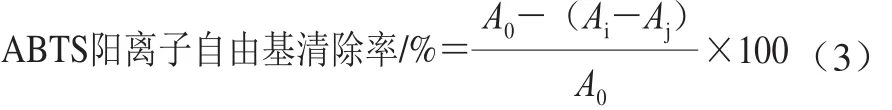
式中:Ai为实验组A734nm;Aj为样品本底A734nm;A0为空白组A734nm。
1.3.4.3 羟自由基清除能力
将1 mL 1.0~5.0 mg/mL的5 种多糖样品溶液中依次加入5 mmol/L H2O2溶液、5 mmol/L FeSO4溶液、蒸馏水各2 mL,最后加入2 mL 5 mmol/L水杨酸-乙醇溶液,混合均匀,室温反应30 min,于510 nm波长处测定吸光度(A510nm)。空白组和样品本底分别以等体积蒸馏水代替样品溶液和H2O2溶液[20]。以VC为阳性对照。按式(4)计算羟自由基清除率。
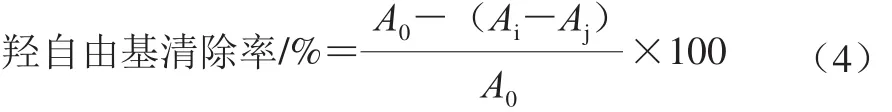
式中:Ai为实验组A510nm;Aj为样品本底A510nm;A0为空白组A510nm。
1.3.4.4 还原能力
采用铁氰化钾法测定样品的还原能力。分别将1 mL 1.0~5.0 mg/mL的5 种多糖样品溶液与1 g/100 mL铁氰化钾溶液、磷酸盐缓冲液(pH 6.6)按体积比1∶1∶1混合,50 ℃水浴20 min,加入2 mL 10 g/100 mL三氯乙酸溶液,3 000 r/min离心10 min,取1 mL上清液与等体积蒸馏水和0.2 mL 0.3 g/100 mL三氯化铁溶液混合,50 ℃水浴10 min,于700 nm波长处测定吸光度(A700nm)。样品本底以等体积蒸馏水代替三氯化铁溶液[21]。以VC为阳性对照。按式(5)计算还原能力。

式中:Ai为实验组A700nm;Aj为样品本底A700nm。
1.3.5 氧化损伤酵母细胞保护能力的测定
1.3.5.1 紫外损伤酵母细胞保护能力
将酵母菌在液体YEPD培养基中培养至对数期,4 000 r/min离心5 min,收集菌体。用磷酸盐缓冲液(pH 6.9)洗1~2 次,并悬浮其中得酵母菌悬液。将不同质量浓度(4.0、8.0、12.0、16.0、20.0 mg/mL)的5 种多糖样品溶液与菌悬液按体积比4∶1混合,然后在致死条件(20 W、距离30 cm,60 s)下进行紫外处理。将处理后各菌液梯度稀释涂布于固体YEPD培养基中,28 ℃倒置培养48 h,菌落计数。空白组以等体积磷酸盐缓冲液代替样品溶液,对照组以等体积磷酸盐缓冲液代替样品溶液且未经紫外照射[22]。以VC为阳性对照。按式(6)计算酵母细胞存活率。
式中:Ai为实验组酵母单菌落数;Aj为空白组酵母单菌落数;A0为对照组酵母单菌落数。
1.3.5.2 H2O2损伤酵母细胞保护能力测定
按1.3.5.1节的方法制得酵母菌悬液。分别将4 mL不同质量浓度(4.0、8.0、12.0、16.0、20.0 mg/mL)的5 种多糖样品溶液与1 mL菌悬液于试管中混合,加入致死剂量(体积分数2%)的H2O2溶液1 mL,37 ℃水浴振荡1 h。空白组以等体积磷酸盐缓冲液代替样品溶液,对照组以等体积磷酸盐缓冲液代替样品溶液且未经体积分数2%的H2O2溶液处理[22]。处理后的菌液按1.3.5.1节描述的方法培养后进行菌落计数,按式(6)计算酵母细胞存活率。
1.4 数据处理
采用Microsoft Office Excel软件进行数据处理,实验数据以平均值±标准差表示。采用Origin软件作图。
2 结果与分析
2.1 不同来源红缘拟层孔菌粗多糖的基本组分
不同来源红缘拟层孔菌粗多糖的基本组分见表1。FPM粗多糖得率为5.90%,明显高于3 种子实体;在3 种子实体中,HFPF和YFPF粗多糖得率接近,分别为2.91%和2.56%,JFPF粗多糖得率最低,仅为0.75%。5 种粗多糖的总糖质量分数存在差异,3 种子实体粗多糖的总糖质量分数高于菌丝体粗多糖,其中YFPF粗多糖的总糖质量分数最高,为71.65%,FPFB粗多糖的总糖质量分数同样较菌丝体粗多糖高,为56.04%。水提粗多糖中常含有部分游离蛋白质和结合糖蛋白,因此,蛋白质含量是粗多糖的重要检测指标之一[23]。由表1可知,5 种粗多糖的总蛋白质量分数均小于13%,其中FPFB、JFPF、HFPF的总蛋白质量分数接近,均在7%左右;FPM和YFPF的总蛋白质量分数较其他3 种粗多糖高,分别为10.08%和12.20%。对5 种粗多糖中结合糖蛋白质量分数进行测定发现,JFPF、YFPF和FPM 3 种粗多糖的结合糖蛋白质量分数较高,分别为1.08%、1.26%和2.23%。另外,5 种粗多糖样品中糖醛酸质量分数差异较大,HFPF和YFPF的糖醛酸质量分数较高,分别为14.54%和15.84%,JFPF、FPM和FPFB 3 种粗多糖的糖醛酸质量分数均在3%以下。这些粗多糖的基本组分对其抗氧化活性会有不同程度的影响。
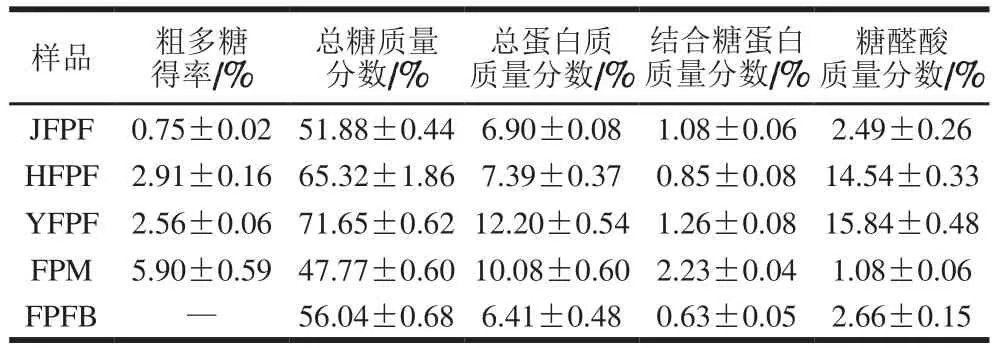
表1 红缘拟层孔菌粗多糖的基本组分Table 1 Basic components of crude polysaccharides from Fomitopsis pinicola
2.2 不同来源红缘拟层孔菌多糖的分子质量分布
有研究表明,多糖的分子质量与其抗氧化活性密切相关[24],因此测定多糖分子质量分布对其抗氧化活性的分析是十分必要的。脱蛋白后的JFPF、HFPF、YFPF、FPM和FPFB粗多糖的凝胶色谱图和分子质量分布分别见图1和表2。
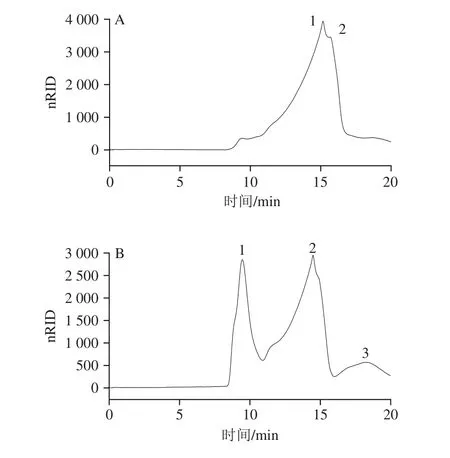
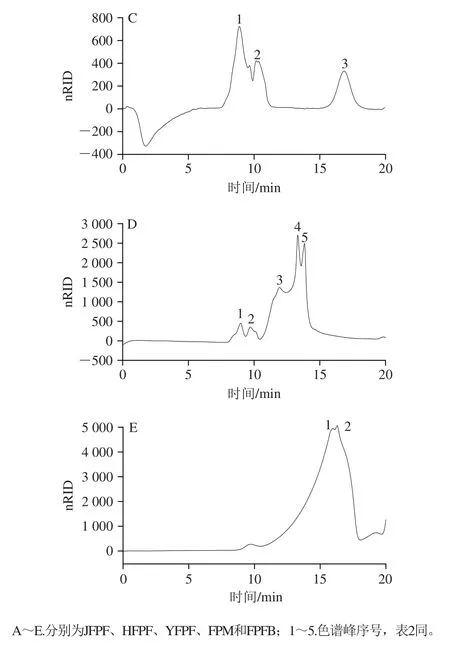
图1 脱蛋白后的5 种粗多糖的高效凝胶渗透色谱图Fig. 1 High performence gel permeation chromatograms of five crude polysaccharides after protein removal

表2 脱蛋白后5 种粗多糖的分子质量分布Table 2 Molecular mass distribution of five crude polysaccharides after protein removal
由图1可知,JFPF和FPFB粗多糖在色谱图中呈现2 个相近的峰,显示JFPF和FPFB粗多糖有2 种不同组分;HFPF和YFPF粗多糖在色谱图中呈现3 个主要峰,显示HFPF和YFPF粗多糖存在3 种不同组分;FPM粗多糖在色谱图中呈现5 个峰,显示该粗多糖有5 种不同组分。
从表2可知,JFPF粗多糖中峰1、2的保留时间接近,分别为15.174 min和15.690 min,说明JFPF粗多糖组分分子质量分布相对比较集中,其中峰1的峰面积占比为78.53%,分子质量为5.62×104Da,峰2的峰面积占比为21.47%,分子质量为4.06×104Da;HFPF粗多糖中峰1、2的峰面积占比分别为33.49%和55.81%,说明HFPF粗多糖主要由峰1和峰2组分组成,其中,峰1组分的分子质量较高为2.07×106Da,峰2组分的分子质量为8.63×104Da;YFPF粗多糖中有3 种不同组分,其中峰1、2的出峰时间早,分子质量高,分别为2.95×106Da和1.17×106Da,对应峰面积所占比例分别为43.72%、20.17%,表明YFPF中分子质量高的组分含量较高;FPM粗多糖中的组分较丰富,但其保留时间相对集中,主要在8.971~13.827 min范围内,其中,峰1和峰2组分的分子质量较高,分别为2.83×106、1.78×106Da,峰3、4和峰5为FPM的主要组分,分子质量在1.31×105~4.35×105Da范围内;FPFB中峰1、2的保留时间接近,对应组分的分子质量较低,分别为3.38×104、2.75×104Da。
通过对比可以发现,JFPF、HFPF、YFPF、FPM和FPFB 5 种粗多糖的分子质量构成差异明显,YFPF粗多糖中以2.95×106Da左右的高分子质量多糖为其主要成分;FPM粗多糖中以1.31×105~4.35×105Da范围的中等分子质量多糖为其主要成分;JFPF和FPFB粗多糖分别以5.62×104Da和2.75×104~3.38×104Da的低分子质量多糖为其主要成分;而HFPF粗多糖中高分子质量多糖和低分子质量多糖所占比例较均等。多糖的糖链与肽链结合,形成的糖肽或糖蛋白会增加多糖的分子质量[25],YFPF和FPM粗多糖中多糖较高的分子质量,可能与其较高的糖蛋白含量有关。文献[11]报道,培养35 d的FPM多糖主要有3 种不同分子质量的组分,即5.37×106(19.6%)、1.06×106Da(19.3%)的高分子质量组分和1.47×104Da(53.6%)的低分子质量组分,此结果与本实验有一定差异,推测可能与培养基成分、培养条件、培养时间等不同相关。本实验中红缘拟层孔菌多糖分子质量分布与已报道的红缘拟层孔菌子实体与菌丝体多糖的分子质量远高于其发酵液多糖分子质量[9,11]基本吻合。
2.3 不同来源红缘拟层孔菌粗多糖的抗氧化活性
2.3.1 DPPH自由基清除能力
DPPH自由基的醇溶液呈紫色,具有自由基清除能力的样品,可与之结合使溶液颜色变浅,吸光度减小,因此可根据吸光度变化快速判断样品的DPPH自由基清除能力[26]。
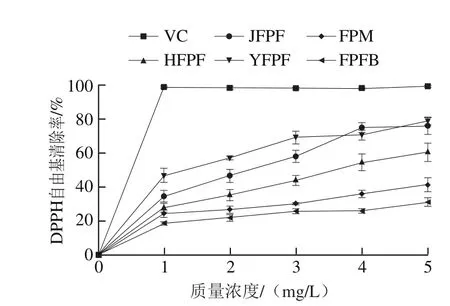
图2 JFPF、HFPF、YFPF、FPM和FPFB粗多糖对DPPH自由基的清除作用Fig. 2 DPPH radical scavenging activity of crude polysaccharides from JFPF, HFPF, YFPF, FPM and FPFB
由图2可知,5 种粗多糖对DPPH自由基均具有一定的清除作用,且存在一定的剂量依赖关系。当质量浓度为1 mg/mL时,YFPF、JFPF、HFPF、FPM和FPFB粗多糖对DPPH自由基的清除率分别为47.01%、34.73%、27.94%、24.44%、18.75%;当质量浓度增加到5 mg/mL时,上述5 种多糖对DPPH自由基清除率分别为78.78%、75.92%、60.47%、41.41%、31.32%。在0~5 mg/mL质量浓度范围内,5 种红缘拟层孔菌粗多糖和VC对DPPH自由基的清除能力由大到小依次为VC>YFPF>JFPF>HFPF>FPM>FPFB。上述结果表明,5 种粗多糖可能作为电子或氢供体清除DPPH自由基。子实体粗多糖(JFPF、HFPF和YFPF)对DPPH自由基的清除作用均高于菌丝体和发酵液所得粗多糖(FPM和FPFB)。在5 种粗多糖中,以子实体中的YFPF粗多糖对DPPH自由基清除作用最强,且YFPF粗多糖的杂质蛋白和糖醛酸含量最高。当蛋白质和糖醛酸含量增加时,多糖具有较高的自由基清除活性,这与已有研究结果吻合,认为多糖分子中蛋白质和糖醛酸物质的存在增强了其自由基清除活性[27]。此外,多糖的分子质量在抗氧化活性中起着重要的作用,分子质量较低的多糖在提取过程中其主要分子结构可能被破坏,如糖基类型、取代基和糖苷键的构型等[9],因此分子质量高的YFPF粗多糖比其他4 种粗多糖具有更高的抗氧化活性。
2.3.2 ABTS阳离子自由基清除能力
ABTS经氧化后会形成在734 nm波长处有最大吸收的蓝绿色水溶性ABTS阳离子自由基,抗氧化剂可与其反应使之褪色,且抗氧化能力与反应速率呈正相关,可根据褪色情况直接判断样品抗氧化能力[19]。
由图3可知,JFPF、HFPF、YFPF、FPM和FPFB粗多糖对ABTS阳离子自由基都有较强的清除作用,清除率随多糖质量浓度的上升而增大。在质量浓度大于1 mg/mL时,JFPF、HFPF、YFPF和FPM 4 种粗多糖对ABTS阳离子自由基的清除效果接近阳性对照VC,且均明显高于FPFB。当质量浓度为5 mg/mL时,JFPF、HFPF、YFPF和FPM粗多糖对ABTS阳离子自由基的清除率均大于98%;而FPFB粗多糖对ABTS阳离子自由基的清除率只有72%。这可能是由于其多糖、杂质蛋白、糖蛋白和糖醛酸含量相对较少。FPFB属于胞外多糖,其组成、结构和理化性质(包括主要多糖组分的分子质量)与其他多糖差异也较大,因此,影响其对ABTS阳离子自由基的清除能力。
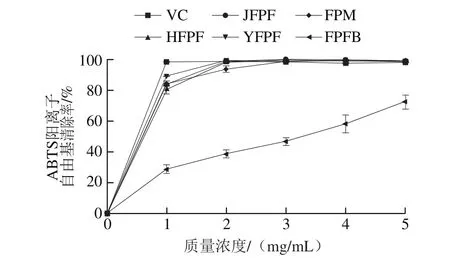
图3 JFPF、HFPF、YFPF、FPM和FPFB粗多糖对ABTS阳离子自由基的清除作用Fig. 3 ABTS radical scavenging activity of crude polysaccharides from JFPF, HFPF, YFPF, FPM and FPFB
2.3.3 羟自由基清除能力
羟自由基是目前已知的机体新陈代谢过程中产生的对机体毒性最强、危害最大的一种活性氧自由基,是机体氧化损伤的主要因素。抗氧化剂能有效清除或减少羟自由基的产生,从而抑制氧化发生,羟自由基清除率是反映物质抗氧化作用的重要指标[13,28]。
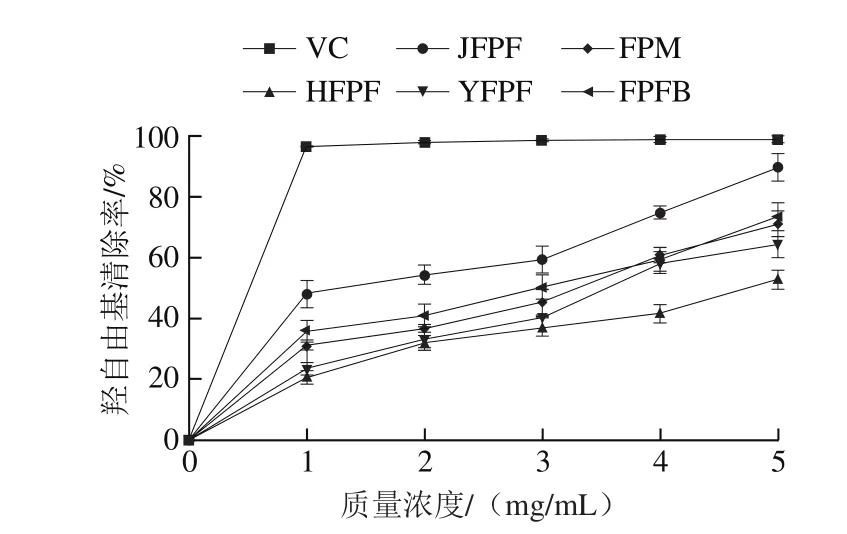
图4 JFPF、HFPF、YFPF、FPM及FPFB粗多糖对羟自由基的清除作用Fig. 4 Hydroxyl radical scavenging activity of crude polysaccharides from JFPF, HFPF, YFPF, FPM and FPFB
由图4可知,5 种粗多糖对羟自由基均具有较好的清除作用,当质量浓度为1 mg/mL时,JFPF、FPFB、FPM、YFPF和HFPF粗多糖对羟自由基的清除率依次为47.91%、36.03%、30.84%、23.35%、20.51%;当质量浓度增大至5 mg/mL时,JFPF、HFPF、YFPF、FPM和FPFB对羟基自由基的清除率分别为89.71%、52.68%、64.38%、71.05%、73.44%。在0~5 mg/mL质量浓度范围内各样品对羟自由基的清除能力呈现明显的剂量依赖关系。5 种红缘拟层孔菌粗多糖对羟自由基清除作用最强的是JFPF,然后依次为FPFB>FPM>YFPF>HFPF。这可能与多糖、杂质蛋白、糖蛋白和糖醛酸质量分数有关。FPFB属于胞外多糖,它对羟自由基也具有较强的清除作用。研究表明,多糖可以作为电子或氢供体来清除羟自由基,清除羟自由基生成是一种抗氧化机制[29]。另外,JFPF和FPFB较高的羟自由基清除活性可能与它们相对较低的分子质量有关,低分子质量多糖活性位点容易暴露,利于和自由基接触并清除。
2.3.4 还原能力
还原能力是衡量物质潜在抗氧化能力的重要指标,具有还原性的物质可以通过自身的还原作用提供电子清除自由基,从而达到抗氧化的目的。当还原性物质存在时,铁氰化钾可被还原为亚铁氰化钾,与三氯化铁在酸性条件下反应并生成700 nm波长处有特征吸收峰的普鲁士蓝[30]。

图5 JFPF、HFPF、YFPF、FPM和FPFB粗多糖的还原能力Fig. 5 Reducing power of crude polysaccharides from JFPF, HFPF,YFPF, FPM and FPFB
由图5可知,5 种粗多糖(JFPF、HFPF、YFPF、FPM和FPFB)均具有一定的还原能力,且在0~5 mg/mL质量浓度范围内还原能力呈一定的剂量依赖关系。当质量浓度为5 mg/mL时,YFPF粗多糖的还原能力为0.84,其余4 种粗多糖(HFPF、JFPF、FPM、FPFB)的还原能力分别为0.34、0.32、0.25、0.10。5 种粗多糖还原能力从大到小依次为:YFPF>HFPF>JFPF>FPM>FPFB。子实体YFPF粗多糖的还原能力最高,这可能与其多糖、杂质蛋白、糖蛋白和糖醛酸含量相对较高有关。FPFB属于胞外多糖,其单糖组成、结构和理化性质(包括主要多糖组分的分子质量)与其他多糖差异也较大,其还原能力最差。多糖的分子质量也是影响其抗氧化活性的主要因素之一,分子质量较低的多糖在提取过程中其主要分子结构可能被破坏,YFPF中分子质量高的组分含量较高,因此,较其他粗多糖具有更高的抗氧化活性。研究表明,还原能力通常与还原酶的存在有关,还原酶通过提供氢原子破坏自由基链,从而发挥抗氧化作用,此外,还原剂还可通过与H2O2的某些前体发生反应防止H2O2形成,从而发挥抗氧化作用[29]。
2.3.5 氧化损伤酵母细胞保护能力
酵母细胞是与人体细胞接近的真核细胞,其与人体细胞的抗氧化机制相似,且生命周期短,是抗氧化活性研究的模式生物[9]。为深入考察红缘拟层孔菌粗多糖的抗氧化活性,实验采用氧化损伤(紫外线和H2O2)酵母细胞保护作用实验模型,对5 种粗多糖对氧化损伤酵母细胞的保护作用进行评价。
2.3.5.1 紫外损伤酵母细胞保护实验结果
紫外线辐射是造成皮肤氧化损伤的主要原因,紫外线辐射产生的活性氧自由基会引发细胞损伤和凋亡,进而引起动脉粥样硬化和癌症等相关疾病[31-32]。抗氧化剂具有清除自由基的作用,可有效减缓紫外辐射对细胞造成的损伤[33]。
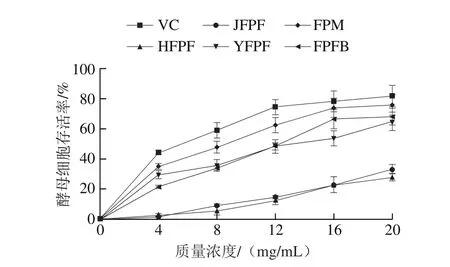
图6 JFPF、HFPF、YFPF、FPM和FPFB粗多糖对紫外损伤酵母细胞保护能力Fig. 6 Protective effects of crude polysaccharides from JFPF, HFPF,YFPF, FPM and FPFB against UV-induced oxidative damage in yeast cells
5 种不同来源红缘拟层孔菌粗多糖对紫外损伤酵母细胞的保护作用结果如图6所示。当质量浓度为4 mg/mL时,JFPF、HFPF、YFPF、FPM、FPFB对应的酵母细胞存活率均较低,分别为1.53%、2.72%、29.43%、34.84%、21.43%,表明5 种粗多糖在较低质量浓度时对紫外损伤酵母细胞的保护作用较弱;质量浓度增大至20 mg/mL时,上述5 种粗多糖对应的酵母细胞存活率分别为33.14%、27.57%、64.64%、75.48%、67.71%。因此,5 种粗多糖在较高质量浓度时对紫外损伤酵母具有较好的保护作用,且呈现明显的剂量依赖关系。源于菌丝体和发酵液的粗多糖对紫外损伤酵母细胞的保护作用优于子实体粗多糖,YFPF粗多糖对紫外损伤酵母细胞也具有较强保护作用。多糖的抗氧化活性与其杂蛋白和结合糖蛋白含量密切相关,研究显示,未脱蛋白多糖的抗氧化活性优于脱蛋白多糖的抗氧化活性[34],Sevag法脱蛋白多糖的抗氧化活性强于蛋白酶法脱蛋白多糖[35],故推测FPM和YFPF较强的紫外损伤酵母细胞保护作用可能与其蛋白质量分数尤其是结合糖蛋白质量分数高有关。
2.3.5.2 H2O2氧化损伤酵母细胞保护实验
H2O2是一种常用的细胞氧化应激诱导剂,广泛用于诱导细胞建立氧化应激损伤模型。H2O2能在细胞内产生活性高、破坏力强的羟自由基,从而对机体造成伤害。抗氧化剂可通过直接与H2O2、H2O2中间产物反应或抑制过氧化物酶与H2O2结合等来降低H2O2对细胞的损伤[36]。
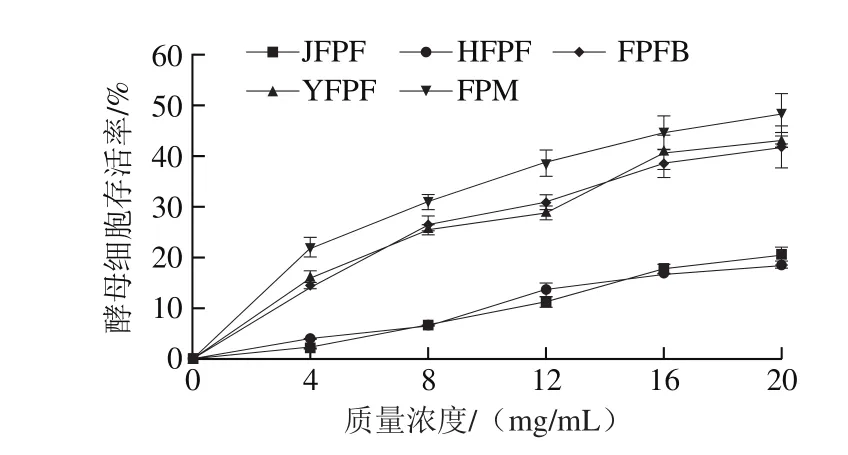
图7 JFPF、HFPF、YFPF、FPM和FPFB粗多糖对H2O2损伤酵母细胞保护能力Fig. 7 Protective effects of crude polysaccharides from JFPF, HFPF,YFPF, FPM and FPFB against H2O2-induced oxidative damage in yeast cells
5 种不同来源的红缘拟层孔菌粗多糖对H2O2氧化损伤酵母细胞的保护作用结果见图7。当质量浓度为20 mg/mL时,FPM、YFPF、FPFB、JFPF和HFPF 5 种粗多糖对酵母细胞的存活率分别为48.38%、43.12%、41.74%、20.35%和18.63%。这些多糖对H2O2氧化损伤酵母细胞具有不同程度的保护作用。此结果表明,FPM粗多糖对H2O2氧化损伤酵母细胞保护作用最强,YFPF、FPFB粗多糖次之,这与紫外损伤酵母细胞保护作用实验结果相似。FPM粗多糖对紫外和H2O2氧化损伤酵母细胞的保护作用均强于其他4 种,推测可能与色素、杂质蛋白、糖蛋白和糖醛酸等物质的存在及其之间的协同作用有关,这些物质也参与了抗氧化作用。多糖抗氧化的构效关系受多种因素影响,包括蛋白质含量、糖醛酸含量、硫酸基含量、分子质量、单糖组成、活性羟基数量以及分子构象等,红缘拟层孔菌多糖的结构特征有待于进一步系统解析。H2O2在细胞内产生的羟自由基破坏力很强,故其存活率总体上均低于紫外处理组,这与已有研究结果[37]吻合。
3 结 论
本实验分别采用4 种体外抗氧化活性评价方法以及紫外和H2O2氧化损伤酵母细胞保护实验模型,对JFPF、HFPF、YFPF、FPM及FPFB粗多糖的抗氧化活性进行对比研究。结果表明,5 种不同来源红缘拟层孔菌粗多糖对DPPH自由基、ABTS阳离子自由基、羟自由基均有较好的清除能力,且对氧化损伤酵母细胞均表现出较好的保护作用,表明5 种红缘拟层孔菌粗多糖具有较好的抗氧化活性,提示这5 种粗多糖作为抗氧化功能因子在保健功能食品中具有良好的应用前景。本研究还发现5 种红缘拟层孔菌粗多糖虽然都具有较好的抗氧化活性,但作用效果差异明显,其中,YFPF粗多糖对DPPH和ABTS阳离子自由基的清除作用及还原能力强于其他4 种粗多糖;FPM粗多糖对紫外和H2O2诱发的氧化损伤酵母细胞的保护作用均最强,原因可能与YFPF和FPM粗多糖的分子质量较高及糖蛋白含量较高相关。多糖的结构是其生物活性的基础,因此进一步分离纯化、结构表征以及构效关系等方面的研究工作有待进行。不同来源红缘拟层孔菌多糖的抗氧化活性存在一定差异,液体深层发酵是制备红缘拟层孔菌活性多糖的一种有效方法,这为红缘拟层孔菌多糖在食品和医药等领域开发应用提供了参考依据。
