光声显微成像技术的研究进展
2019-10-30张建辉陈宁波王柏权刘成波龚小竞
张建辉 陈宁波, 王柏权, 刘成波 龚小竞
(1.广州大学机械与电气工程学院,广州,510006;2.中国科学院深圳先进技术研究院生物医学光学与分子影像研究室,深圳,518055)
引 言
早在1880年,Bell[1]就发现了光声转换现象,并在给美国科学进展协会的报告中将这种物理现象称为“光声效应”,即光吸收体吸收经调制的光或脉冲光后,进行光热转换,热弹性效应使吸收体介质周期性的胀缩从而产生超声波。然而,直到20世纪90年代,随着固体光声理论的完善,在激光、计算机和超声探测等技术的推动下,光声效应在散射介质和生物组织中应用取得重大突破,光声成像(Photoacoustic imaging,PAI)才被正式提出,在过去20余年间获得空前快速的发展,并正在成为生命科学研究和临床医学应用中的新型生物医学影像技术之一。光声成像主要包括以下过程:纳秒激光脉冲照射生物组织—组织中光吸收体吸收光能量—组织热膨胀—周期性的振动产生超声波—宽带超声换能器探测超声波—根据探测的信号完成图像重建。
目前,国内外针对光声成像技术开展的研究正处于快速发展阶段,主要分为以下3个方向:光声显微成像(Photoacoustic microscopy,PAM)、光声计算层析成像(Photoacoustic computed tomography,PACT)、光声内窥成像(Photoacoustic endoscopy,PAE),每个研究方向又衍生出不同的研究分支[2,3]。其中,PAM可实现亚微米至亚毫米级的空间分辨率,成像深度达百微米至数毫米,和依赖于重建算法的PACT相比,PAM仅依靠逐点光栅扫描的方式来获取光声信号,无需复杂算法即可完成图像重建,且PAM能够实现活体结构、分子与功能的多参量高分辨成像,故成为当前生物医学成像领域的研究热点。本文首先按不同的结构形式对PAM技术进行了分类,并回顾其发展起源;其次,重点阐述了新型PAM技术的研究进展,主要包括PAM的新型扫描方法和手持式PAM设备的研究进展;再次,针对PAM技术焦深(Depth of focus,DoF)受限的问题,分析了PAM的DoF延拓的新技术;然后,从多角度展示了PAM技术的生物医学应用研究;最后,总结了PAM技术发展面临的挑战,并展望了PAM技术未来的发展方向。
1 PAM技术的分类及其起源
PAM是一种聚焦型扫描成像技术,根据激发光和超声探测聚焦方式的不同,可以分为光学分辨率PAM(Optical-resolution PAM,OR-PAM)和声学分辨率PAM(Acoustic-resolution PAM,AR-PAM)[4],二者聚焦方式如图1所示,其中,OR-PAM的光学聚焦比声学聚焦更加紧密,光学焦点比声探测焦点小,如图1(a)所示,其横向分辨率取决于光学焦点的大小,可以达到从百纳米到数微米的亚细胞或细胞尺度,但是受光在生物组织中的散射限制,活体成像深度1~2 mm。在超过光学扩散极限的几毫米甚至几十毫米深的组织处,AR-PAM则可以利用超声的低散射特性,采用更加紧密的声学聚焦方式,实现从几十微米到几百微米的横向分辨率,此时,横向分辨率取决于超声焦点的大小,如图1(b)所示。

图1 PAM聚焦方式对比Fig.1 Comparison of focusing modes of PAM
目前,常见的PAM实现形式如图2所示,为了最大化成像系统的探测灵敏度,通常将激发光和超声探测共轴共焦设置[5]。图2(a,b)分别为典型的透射式和反射式ORPAM,透射式OR-PAM利用较高数值孔径(Numerical aperture,NA)的物镜将激光光斑聚焦到衍射极限,可以实现亚微米级分辨率,但是,值得注意的是其工作距离也会随着物镜NA增大而减小,如聚焦物镜NA为1.2时,工作距离仅有约200 μm,且聚焦物镜和超声换能器置于样本两侧的结构形式,使其只能对厚度较薄的样品成像,而反射式ORPAM使用光声耦合棱镜将换能器和光聚焦物镜配置在同侧来实现光声共轴共焦,利用稍低NA的物镜进行光学聚焦可延长其工作距离,分辨率仍能到微米级,应用范围更加灵活。图2(c)为暗场照明的AR-PAM,激光透过锥透镜后呈环形,经过聚光镜反射后在样本表面弱聚焦,高频超声换能器进行更紧密的声学聚焦,该结构形式可提高显微成像的深度。

图2 常见PAM形式[5]Fig.2 Representative implementations of PAM[5]
2005年,美国圣路易斯华盛顿大学的Wang教授[6]课题组利用暗场激光照明和高频超声探测设计了最早的光声显微镜,该系统实现了小鼠皮下血管的无创成像,横向分辨率达到45 μm,成像深度大于 3 mm,属于AR-PAM,如图3(a)所示。2008年,该课题组在AR-PAM基础上通过光学强聚焦的方式开发出第1代OR-PAM[7],其光声耦合方式如图3(b)实线框中所示,光声耦合棱镜由两个直角石英棱镜组成,其间填充与石英光学折射率接近但声阻抗相差较大的硅酮油,用作透光反声,超声信号由侧面放置的换能器完成探测。虽然该系统分辨率达到5 μm,成像深度大于0.7 mm,实现了小鼠微血管的活体成像,但是系统灵敏度依然不高,究其原因是超声波的反射使大部分纵波转换为横波,而换能器对横波探测灵敏度较低。因此,该课题组的Hu等[8]对光声耦合棱镜进行了重新设计,如图3(b)虚线框所示,将其中一个直角棱镜替换成菱形棱镜,使超声在空气-玻璃界面重新由横波转换为纵波,相比第1代系统,成像灵敏度提高了约18.4 dB。
2 新型PAM技术的研究进展
PAM技术凭借高性能的空间分辨率和特有的高光学对比度受到越来越多生物医学研究者的青睐,经过十余年的发展,在国内外众多研究小组的共同努力下,PAM技术已经在探测灵敏度、成像分辨率和成像速度等方面取得了长足进步。为了解决传统电机机械扫描方式成像速度受限的问题,各种新型扫描方法的PAM相继问世;为了使系统形式更加紧凑、便携,小型化的手持式PAM系统成为了另一热门研究方向。下文将重点介绍新型PAM扫描方法和手持式PAM系统的研究进展。
2.1 新型PAM扫描方法
成像速度的提升对高动态、时间敏感的生物学现象研究至关重要,如何在不牺牲成像灵敏度和成像视场的情况下提高PAM速度,成为众多研究者思索的一大问题。近年来,针对扫描速度提升,各种新型扫描方法的PAM相继被研发。
Zhang等[9]提出了一种基于扫描振镜的PAM来提高成像速度,如图4(a)所示。成像过程中,超声换能器保持固定,通过检流计驱动的二维扫描振镜反射激光在样本表面扫描,使用重复频率为1024 Hz激光扫描一个256像素×256像素大小的区域耗时不超过2 min。该系统的缺点是成像视场取决于非聚焦型超声换能器探测范围的大小,受到一定限制,并且视场内探测灵敏度分布不均匀,有效视场直径为6 mm。随后Rao等[10]将检流计驱动的扫描振镜作为扫描快轴,电机机械轴作为扫描慢轴,同时采用线聚焦型换能器,改进提出一种混合扫描方式的PAM,如图4(b)所示,一定程度上解决了成像视场较小的问题,成像信噪比也得到了提高。
Song等[11]采用微透镜阵列聚焦激光,阵列式换能器探测超声的方式首次提出了一种透射式多焦点扫描模式的PAM,如图5(a)所示,与传统逐点扫描方法相比,较大提高了扫描速度,1000像素×500像素×200像素的体数据扫描时间不超过4 min,分辨率可达到10 μm。为了突破透射式对成像样品厚度的局限,Li等[12]在此基础上,采用阵列式微型反射棱镜,开发出反射式多焦点PAM,如图5(b)所示,系统横向分辨率达到16 μm,扫描6 mm×5 mm×2.5 mm大小的区域用时不超过2.5 min。
Wang等[13]将PAM扫描探头集成到高速音圈线性平移台(Voice-coil stage)上,在1 mm扫描范围实现最快40帧/s的B-scan扫描速度,其横向分辨率达到3.4 μm,高分辨率的快速扫描性能,使其在血流速度和血氧饱和度等高动态过程的实时成像方面具有潜在应用价值,系统结构如图6所示,其扫描速度一定程度受到探头的重量和激光重复频率限制。
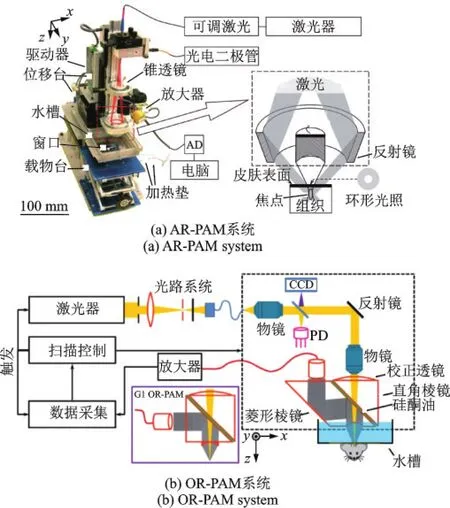
图3 Wang课题组早期设计的PAM系统图[6,7]Fig.3 Early design of PAM system diagram of Wang’s research group[6,7]
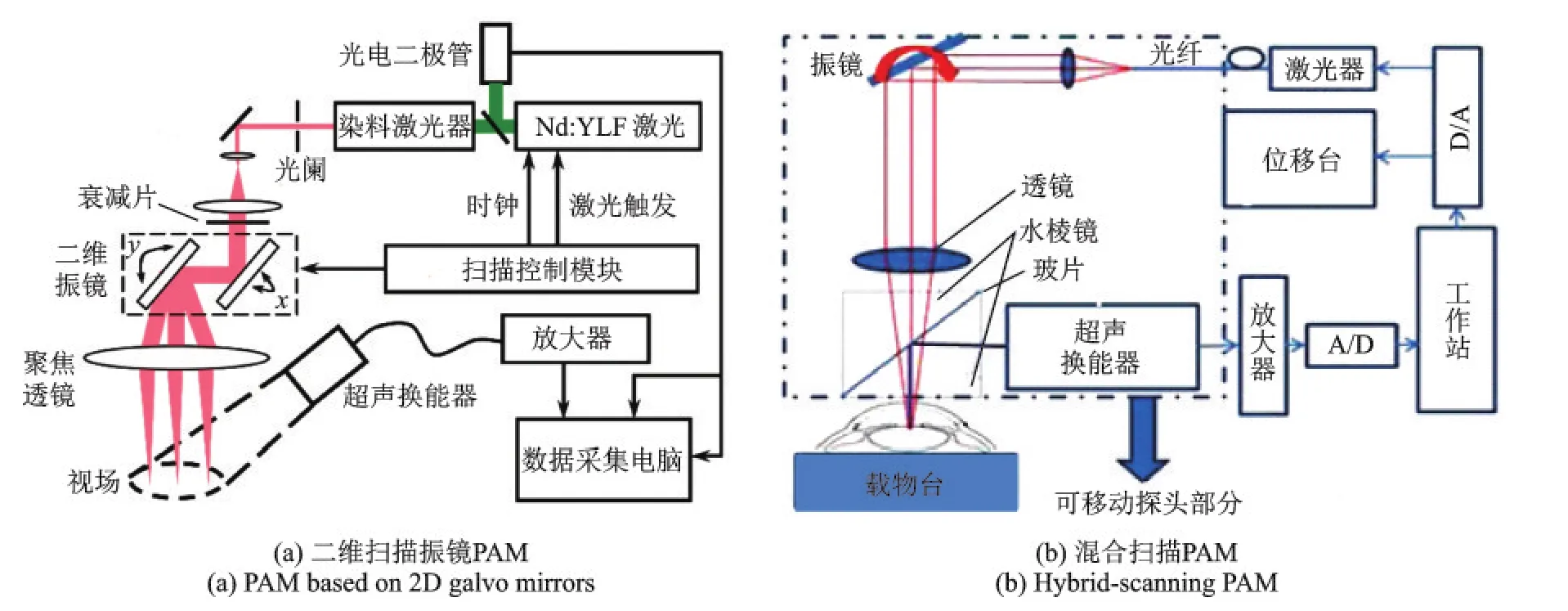
图4 基于扫描振镜的PAM系统[9,10]Fig.4 PAM systems based on galvo mirrors[9,10]
为了进一步提升PAM的成像速度和灵敏度,Yao等[14]采用水浸式微机电系统(Micro-electro-mechanical system,MEMS)振镜作为扫描快轴,机械电机作为扫描慢轴,开发出一种高灵敏度宽视场快速扫描PAM系统,如图7所示。成像过程中,水浸式MEMS振镜可以同时反射激光和超声,使激发光和超声探测在较大视场内保持共焦性能,保证了视场内探测灵敏度的一致性。该系统在3 mm范围内的线扫描速度达到400帧/s,相同的扫描范围下,比Hu提出的第2代机械扫描系统[8]快了约400倍,比Wang提出的快速音圈扫描系统[13]快了约20倍,极大提升了PAM的成像速度。此后,众多基于MEMS振镜的PAM研究工作相继开展[15-17]。
近期,Lan等[18]首次将多面转镜(Polygonal scanners)应用于 PAM系统,提出了一种基于六面转镜的高速宽视场PAM成像系统,系统原理如 图 8(a)所 示 。多面转镜由电机与多面棱镜组成,多面棱镜具有多个反射面,安装在电动机的旋转轴上,通过电机的旋转实现大范围、超高速、高精度与高重复性的光束扫描,六面转镜结构如图8(b,c)所示。相比MEMS振镜扫描,多面转镜具有更快的扫描速度和更高的损伤阈值,12 mm范围内B-scan扫描速率可高达900 Hz,相同大小区域下的成像速度比基于MEMS振镜的PAM[17]快约10倍,比音圈扫描系统[13]快约300倍,比机械扫描系统[8]快约3900倍,多面转镜很好地解决了现有PAM系统成像速度慢和视场局限的问题,具备较高的应用价值。
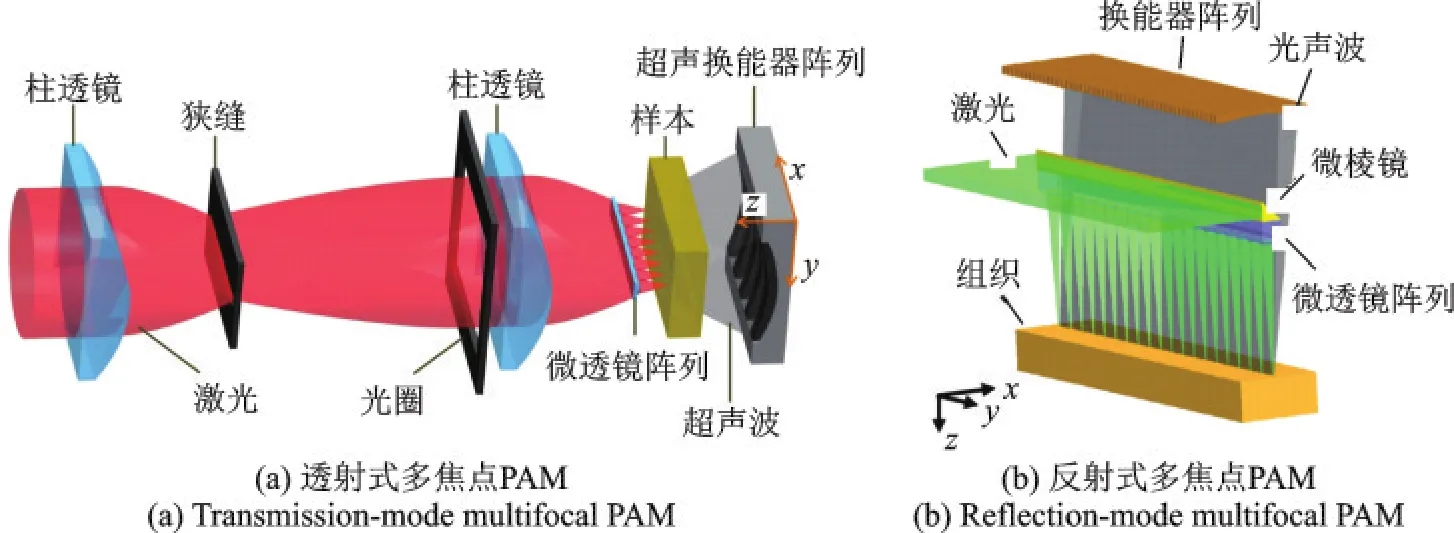
图5 多焦点扫描PAM系统[11,12]Fig.5 Multifocus scanning PAM systems[11,12]

图6 快速音圈扫描PAM[13]Fig.6 Fast voice-coil scanning PAM[13]
2.2 手持式PAM系统
近年来,为了更好地适应临床应用需求,PAM系统的小型化、集成化和便携性成了另外一个热门研究方向,和外观笨重而庞大的传统台式成像系统相比,各类装配紧凑型手持式PAM系统的应用更加灵活和方便。其中,以下课题组开发的手持式PAM具有一定代表性。
美国圣路易斯华盛顿大学Wang教授课题组的Lin等[19]采用双轴水浸式MEMS振镜,使激发光和超声通过同一镜面反射同时快速扫描,在2.5 mm×2.0 mm×0.5 mm的范围下获得2 Hz的三维成像速率,分辨率达到5 μm。整个手持系统大小80 mm×115 mm×150 mm,内部充满水用于超声耦合,系统结构如图9所示。

图7 基于水浸MEMS振镜的PAM[14]Fig.7 PAM system basedona water-immersible MEMS scanning mirror[14]
韩国浦项科技大学Kim教授课题组的Park等[20]采用自制的双轴水浸式MEMS振镜,将所有的声学、光学和机械部件集成到直径为17 mm和质量为162 g的探头中,提出了系统结构更加紧凑的手持式PAM系统,其中光声耦合方式为透光反声式,与Lin的反光透声式系统有所区别。通过增大驱动电压可以增大MEMS机械转角,最大视场可以达到4.1 mm×2.9 mm,结合步进电机移动可以进一步扩展成像范围,从实验方面论证了该系统在检测人体黑色素瘤等临床应用的潜力,系统结构如图10所示。
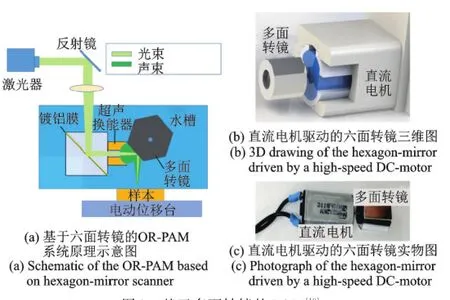
图8 基于多面转镜的PAM[18]Fig.8 PAM system based on polygonal scanners[18]
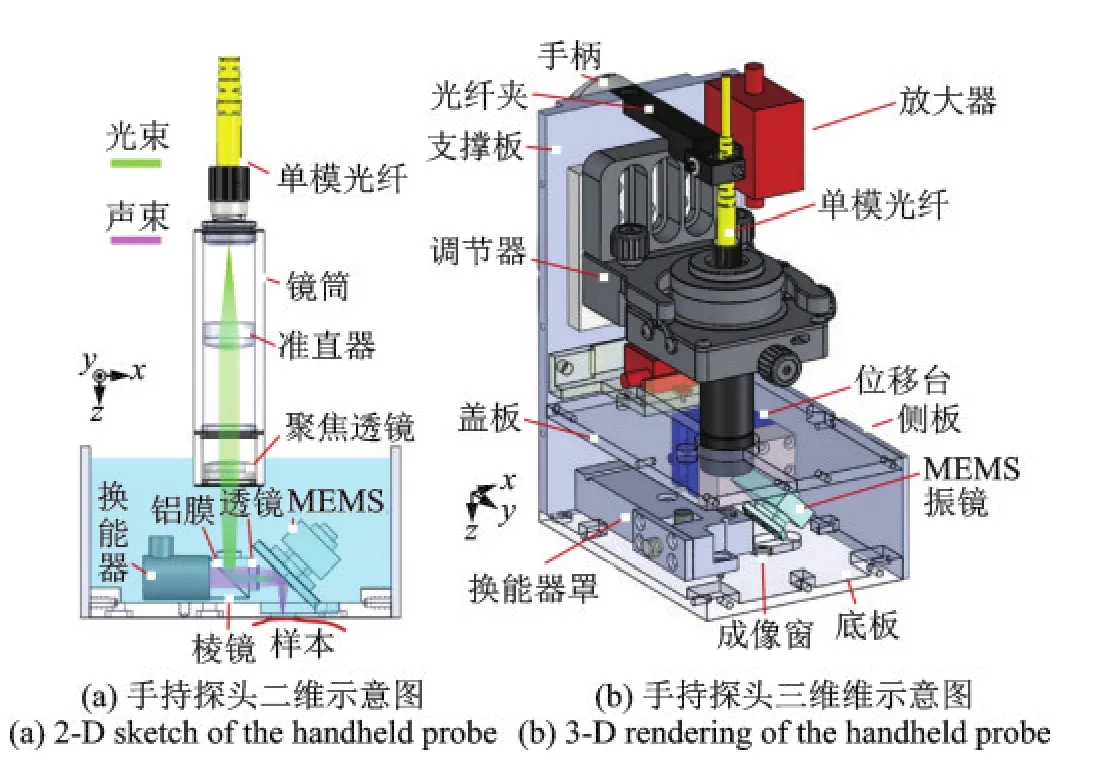
图9 Wang课题组的手持式PAM[19]Fig.9 Hand held PAM of Wang’s research group[19]
南方科技大学的Xi教授课题组在手持式PAM系统的研究也较为深入,2018年,该课题组的Chen等[21]设计了一款紧凑型OR-PAM。将非水浸式MEMS振镜置于光声棱镜前端,单独用作激光扫描。由于该方案采用聚焦超声的探测方案无法实现光、声焦点的同步共焦,所以设计中采用了非聚焦换能器进行超声探测,和基于水浸式MEMS的探测方案相比,非聚焦的超声探测一定程度上会降低探测灵敏度,但是该设计创新性地采用水代替玻璃材质作为光声耦合,减少了横纵波转换带来的超声损失,仍然获得了较高的探测灵敏度。系统横向分辨率达到3.2 μm,2 mm×2 mm范围成像速度达到3.2 Hz,具有良好的便携操作性能,利用该系统在人体口腔各部位血管进行成像实验,获得了较好的成像效果。系统结构如图11所示,整个探头约20 g,外形尺寸仅22 mm×30 mm×13 mm。
3 PAM的DoF延拓技术的研究进展
OR-PAM依靠紧密的光学聚焦可以实现高分辨率的成像效果,然而,传统OR-PAM通常依靠高NA的物镜进行激光聚焦,在获取较高横向分辨率的同时会限制成像系统的DoF大小,使得OR-PAM在三维成像和获取不同深度方向信息方面存在局限,并且,离焦区域空间分辨率和信噪比的急剧下降也将影响组织形态结构量化分析的准确性。为了解决短DoF带来的问题,通常需要在二维光栅扫描的基础上,附加多次不同聚焦位置的深度扫描,进行三维扫描成像,该方法耗时较长;轮廓扫描成像[22]是另一种解决方案,首先根据粗略扫描拟合出兴趣目标深度方向的轮廓,然后将轮廓曲面作为正式扫描时深度方向的参考,由外部软件控制电机沿深度方向运动的轨迹,本质上是简化的三维扫描成像;另外,对于厚度较薄样本,采取样本上下两侧双激发光照明[23]的成像方式也能一定程度扩展显微成像DoF。当前2种新PAM的DoF延拓技术分别为:基于贝塞尔光束的PAM和基于变焦透镜的PAM。
3.1 基于贝塞尔光束的PAM
Durnin等[24,25]于1987年提出了一种无衍射光束——贝塞尔(Bessel)光束,随后在光学界引起研究热潮。和光声成像中常用的高斯光束相比,无衍射的贝塞尔光束中心光斑的大小和光强可以在某一距离范围内基本保持不变,目前,已经在多种光学成像模式中开展应用,如光学相干层析成像(Optical coherence tomography,OCT)和双光子荧光显 微 成 像(Two-photon fluorescence,TPF)等[26-28]。近年来,一些课题组尝试将贝塞尔光束用于PAM以拓展其成像DoF,提高焦区外成像分辨率。Jiang等[29]通过轴棱镜(AX)和环形掩模(AM)产生贝塞尔光束,提出了一种反射式贝塞尔光束PAM系统(BB-PAM),并且将盲解卷积技术用于抑制贝塞尔光束旁瓣造成的成像伪影,提高分辨率。BB-PAM系统原理如图12(a)所示,横向分辨率达到1.6 μm,成像DoF达483 μm,是基于传统高斯光束PAM系统(GB-PAM)的7倍左右,对开颅小鼠脑血管成像结果如图12(b—d),分别为GB-PAM、BB-PAM和盲解卷积处理后的BB-PAM图像结果。

图10 Kim课题组手持式PAM[20]Fig.10 Hand held PAM of Kim’s research group[20]

图11 Xi课题组手持式PAM[21]Fig.11 Hand held PAM of Xi’s research group[21]
同样,为了减小贝塞尔光束旁瓣对PAM效果的影响,Shi等[30]基于热力学中的Grueneisen弛豫效应,在透射式PAM系统中使用连续激光作为加热光源,纳秒脉冲激光作为成像光源,利用加热后光声信号非线性增强的效应,对加热前后的成像结果进行差分,有效抑制了贝塞尔光束旁瓣造成的伪影信号,成功将透射式PAM的DoF拓展到约1 mm,此时横向分辨率约7 μm。近期,Park等[31]采用高NA(NA=1.0)的聚焦物镜和微型超声换能器,提出了一种贝塞尔光束和高斯光束成像模式自由切换的反射式PAM系统,贝塞尔光束成像模式下可实现亚波长级分辨率(300 nm),DoF达229 μm,是高斯光束成像模式下的7倍,成像过程同样采用盲解卷积算法来减小贝塞尔光束旁瓣的伪影。
3.2 基于变焦透镜的PAM
电动位移台驱动的深度扫描虽然可以在一定程度弥补传统PAM的DoF不足,但是三维成像速度受限。近年来,同样为了提升PAM的DoF,一些课题组提出将快速变焦透镜用于PAM的变焦点扫描,其较快的响应速度、较长而连续的变焦范围为PAM的DoF延拓提供了另一种有效的方法。

图12 反射式贝塞尔光束PAM系统和脑血管成像结果[29]Fig.12 Reflection-mode Bessel-beam PAM and imaging results of cerebral vasculature[29]
Li等[32]将电动变焦透镜(ETL)用于PAM系统,通过电动变焦透镜快速连续调节聚焦激光束的扩张角,使激光透过平场显微物镜(POL)后实现不同深度的聚焦。系统原理图如图13(a)所示,图13(b)为变焦过程示意图,采用NA=0.3的平场物镜可以实现1 μm的变焦点调节精度,调节范围可达2.82 mm,小鼠耳部和脑部血管活体成像实验结果验证了该方法用于深度扫描的可行性。该方法不足之处在于电动变焦响应时间还不够快,10 μm变焦距离耗时约15 ms,当采用较高重复频率激光(>1000 Hz)作为激发光源时,变焦速度有待进一步提高。
为实现PAM更加快速的变焦扫描,拓展成像DoF,Yang等[33,34]将一种可调谐声学梯度(TAG)指数透镜用于PAM。TAG透镜是由充满折射液体的圆柱形压电腔体构成,通过压电驱动器产生超声波来改变液体的密度和折射率,达到高速变焦的目的,稳态状态下,变焦时间在1 μs以内[35,36]。系统原理如图14(a)所示,通过一定长度光纤将单个激光脉冲延时获取3个间隔120 ns的激光脉冲序列,结合TAG透镜的变焦点扫描,可以获取同一位置处3个不同聚DoF度处信号,成像系统DoF达到360 μm,较之前提高了大约3倍,图14(b,c)分别为TAG透镜开启和关闭时小鼠脑血管的成像结果,虚线框处可以看出TAG透镜对成像DoF的提高效果显著。
4 PAM技术的生物医学应用
PAM技术在生物医学领域具有广泛的应用前景。首先,依靠血红蛋白作为内源性对比剂,可以对生物微血管结构进行高分辨成像,实现肿瘤等以血管变化为病理特征疾病的连续无标记监测;然后,PAM可结合光声光谱技术,对血氧饱和度、血流速度、氧代谢率等生理参数进行多参量光声功能成像;最后,结合高特异性的外源性对比剂进行高灵敏度分子成像,可弥补组织内源性对比剂在疾病诊断或生物过程示踪中特异性不足的问题。下文将从血管生物学结构成像、多参量功能成像和外源性分子成像3个应用方向介绍PAM技术的生物医学应用研究进展。

图13 采用电动可调透镜的快速变焦PAM[32]Fig.13 Fast variable focus PAM using an electrically tunable lens[32]

图14 采用TAG透镜的多焦点PAM[33]Fig.14 Multifocus PAM using TAG lens[33]
4.1 血管生物学结构成像
生物组织中微血管的直径范围一般在2~100 μm[37],是负责氧气、营养物质和代谢废物交换的通道,微血管结构成像可以为众多疾病的诊断提供生理和病理信息,如糖尿病、尿毒症和类风湿性关节炎等[38]。PAM可以实现微血管结构的非侵入性成像,如图15所示为OR-PAM用于血管生物学结构高分辨成像的结果,微米级的分辨率使其在微血管结构成像中具有独特优势。小鼠耳部毛细血管网络丰富,且厚度较薄(约300 μm),是用于肿瘤血管生成和其它微血管疾病研究的理想模型[39],Hu等[8]基于PAM技术率先实现了小鼠耳部微血管的成像(图15(a));Li等[40]通过PAM技术首次获取了猫脑初级视觉皮层的完整微血管网络(图15(b)),结合创新性血管提取算法为神经血管偶联及脑疾病的应用研究提供了新的方法;Zhao等[41]结合三维Hessian矩阵血管增强算法实现了大鼠虹膜血管结构的高精度提取(图15(c)),与此同时,Zhao等[42]还提出一种创新的运动校正算法,对活体PAM过程中的运动伪影进行校正,实现了高精度图像配准,首次获取了小鼠背部微血管结构的大视场光声显微图像(图15(d))。此外,PAM还被广泛用于小鼠穴位微循环[43]、大鼠肠系[44]、人体皮肤[45]和口腔[46]等组织的血管生物学结构的成像研究,正在成为生命科学研究和临床应用中一项重要的新型成像技术。

图15 OR-PAM的血管生物学结构成像结果[8,40-42]Fig.15 OR-PAM imaging of vascular biological structure[8,40-42]
由于PAM技术出色的微血管结构成像性能,使肿瘤等以微血管变化为病理特征疾病的无标记监测成为可能。近年来,涌现出大量利用PAM技术进行肿瘤诊断和监测的应用研究[47-51],Jin等[52]通 过 手 持 式PAM系统对LS174T癌细胞肿瘤的微血管生成过程进行了连续多天监测,如图16所示,随着肿瘤的生长,新生血管不断生成,其形成开始于肿瘤的边界,并随着血管密度的增加逐渐向肿瘤中心扩散。由于口腔内存在着高密度的血管网络,其结构的改变与口腔的早期癌变密切相关,Jin等还通过对人体嘴唇和舌头部位血管成像,进一步证明了该显微成像系统临床应用的可能性。

图16 肿瘤血管生成的PAM监测[52]Fig.16 In vivo PAM monitoring of mouse LS174T tumor angiogenesis[52]
4.2 多参量功能成像
光声信号的产生是基于样本中光吸收物质对光能量的吸收,生物组织中不同物质成分存在不同的光吸收谱,即不同的物质成分对不同波长的光吸收强度有所区别[23],图17所示为生物组织中常见内源性分子的光吸收谱[53]。根据物质的吸收谱,采用多波长激发光的多光谱PAM技术可以解析出特定目标成分的相对含量[54],以此来获取生物组织结构信息以外的多参量生理功能信息,如通过解析含氧血红蛋白(HbO2)和脱氧血红蛋白(HbR)在血液中的相对含量可以计算血氧饱和度(sO2)。
Zhang等[55,56]首次提出了光声功能显微成像(fPAM)的概念,基于AR-PAM系统,采用578、584、590和596 nm 4个波长对小鼠背部皮下血管进行血氧饱和度功能成像,在微血管水平上实现了高氧、常氧和缺氧状态下血氧饱和度变化的测量,此后,众多PAM测量血氧饱和度的研究被报道[57-60]。由于多数疾病的发生都会对血液流动产生不良影响,破坏细胞正常的氧代谢活动,结合血流速度测量则可进一步获取组织的氧代谢率(MRO2)功能参数。Yao等[61]在此基础上提出基于电机双向扫描的光声多普勒频带展宽血液流速测量方法,实现了小鼠胶质瘤血氧饱和度和氧代谢率的监测,如图18所示,图18(a)为耳部血氧饱和度测量结果;图18(b)为血流速度测量结果,红色箭头所示为正向;图18(c)为小鼠耳部胶质瘤生长第7天的光声显微图像;图18(d)结果表明肿瘤具有高代谢特征,第7天的氧代谢率较第0天增加了1倍;并且,肿瘤内部的平均血氧饱和度水平高于肿瘤外部,如图18(e)所示。

图17 生物组织中主要内源性对比剂的吸收谱[53]Fig.17 Absorption spectra of major endogenous contrast agents in biological tissue[53]

图18 无标记活体氧代谢PAM[61]Fig.18 Label-free oxygen-metabolic PAM in vivo[61]
此外,脑功能成像对于神经科学研究和包括阿尔兹海默症、抑郁症、癫痫等脑疾病的研究至关重要[62-64],是多参量光声显微功能成像的另一个热门应用方向。传统成像技术中,正电子发射层析成像(PET)能够量化脑氧代谢率绝对值,但空间分辨率较差[65];激光散斑成像只能在介观水平上定性测量脑氧代谢[66];功能超声成像能够对啮齿动物全脑血流进行高分辨率成像,但无法获取血氧饱和度的功能信息[67]。PAM能够解决以上弊端,在同一时空尺度下测量脑血红蛋白质量浓度(CHb)、血氧饱和度(sO2)和脑血流速度(CBF),进而获取微观尺度下的脑氧代谢率(CMRO2)[68],如图19所示。
同时,结合高时间和空间分辨率的PAM还可以从细胞水平研究脑功能变化。Wang等[69]采用双激发波长(532和560 nm)快速扫描(20 Hz),实现了小鼠脑血管单个红细胞的氧释放速率的测量,图20(a,b)分别为脑血管血氧饱和度结果和单个红细胞的氧释放过程。该研究对于理解大脑神经活动和氧代谢之间的联系,从细胞水平揭示大脑的工作机制具有重大意义。

图19 多参量小鼠脑功能PAM[61]Fig.19 Multi-parametric functional PAM of mouse brain[61]
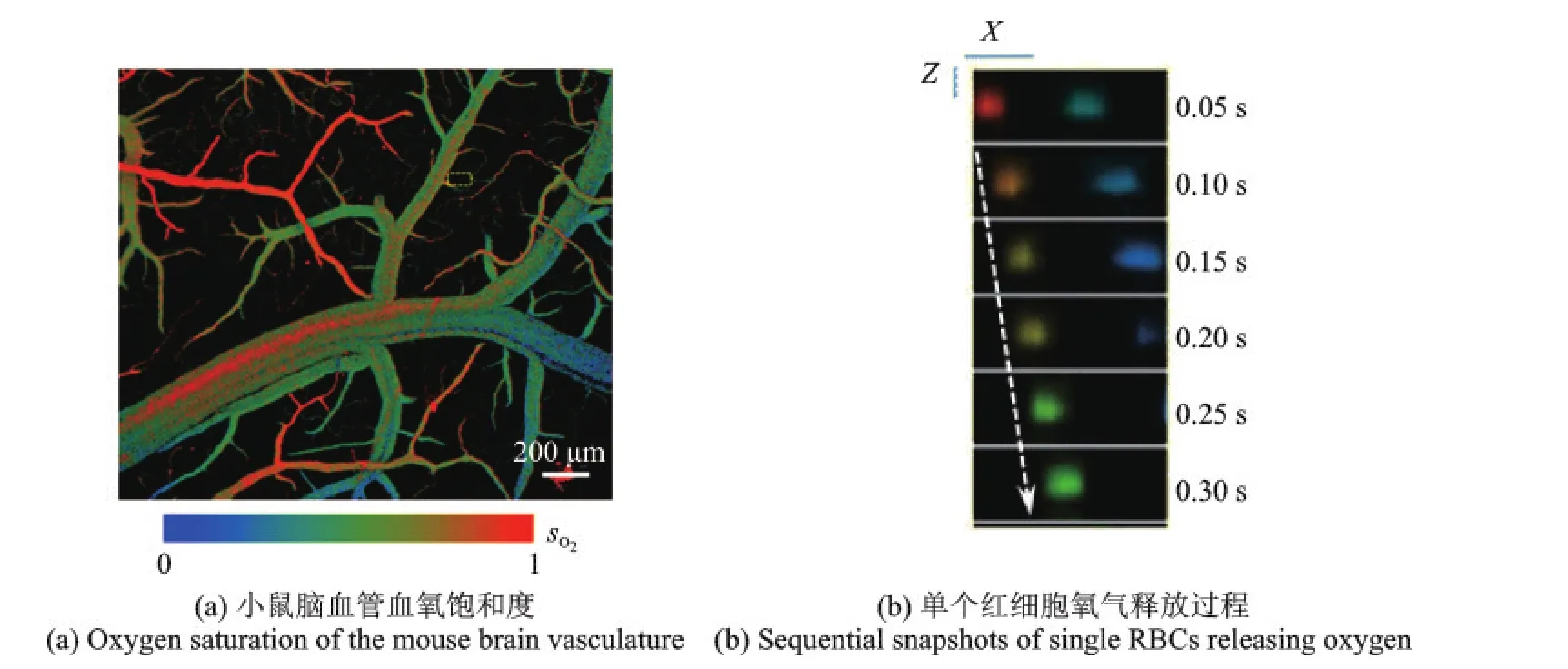
图20 脑血管单细胞氧代谢率PAM[69]Fig.20 Single cell oxygen metabolism PAM ofcerebral vessels[69]
4.3 外源性分子成像
虽然PAM具有无标记和高分辨的成像性能,但是生物内源性对比剂在肿瘤细胞受体的表达等生物过程的示踪上特异性不足,因此,大量外源性对比剂被开发用于提高PAM的特异性和灵敏度[70,71]。外源性对比剂有以下两方面优势,首先,可以通过特殊的设计来提升其化学和光学吸收特性,从而提高光声探测的灵敏度;其次,可以修饰不同的靶向分子(如抗体),使其具有与疾病特异性细胞表面受体选择性结合性能,实现特定标靶的分子成像。目前,基于PAM技术的外源性分子成像已被应用于肿瘤和炎症等生理病理过程研究。
金纳米笼(AuNCs)被认为是一种有效的光声分子成像对比剂,Kim等[72]开展了主动靶向和被动靶向的金纳米笼对B16黑色素瘤光声增强的量化研究。如图21所示为金纳米笼偶联[Nle4,D-Phe7]-α-黑素细胞刺激素的分子探针主动靶向黑色素瘤的PAM结果,其中利用570 nm波长激光用于微血管显微成像,778 nm波长激光用于金纳米笼探针成像,结果显示黑色素瘤的光声信号随时间递增,6 h达到最强,主动靶向黑色素瘤的分子探针为黑色素瘤的特异性PAM提供了较高的对比度,为肿瘤诊疗研究提供了便利。
近年来,随着纳米技术的发展,不同类型的纳米材料,如半导体聚合物纳米颗粒[73-75]、碳纳米管[76,77]和二硫化钼纳米片[78,79]等作为探针被用于PAM特异性和灵敏度增强。Chen等[79]首次开发了基于层数依赖的具有光声放大效应的二硫化钼(MoS2)纳米片,用于大深度原位脑胶质瘤的精准PAM,如图22所示为单层二硫化钼纳米片作为对比剂的原位脑胶质瘤成像结果,小鼠全脑光声显微图像中可以清楚地观察到位于颅骨以下约1.5 mm深处肿瘤,在注射探针24 h后,肿瘤区信号约为注射前的36倍,增强效果显著。借助于功能化纳米材料的独特优势,外源性分子成像已在脑胶质瘤等肿瘤精准诊疗中显示出巨大优势。
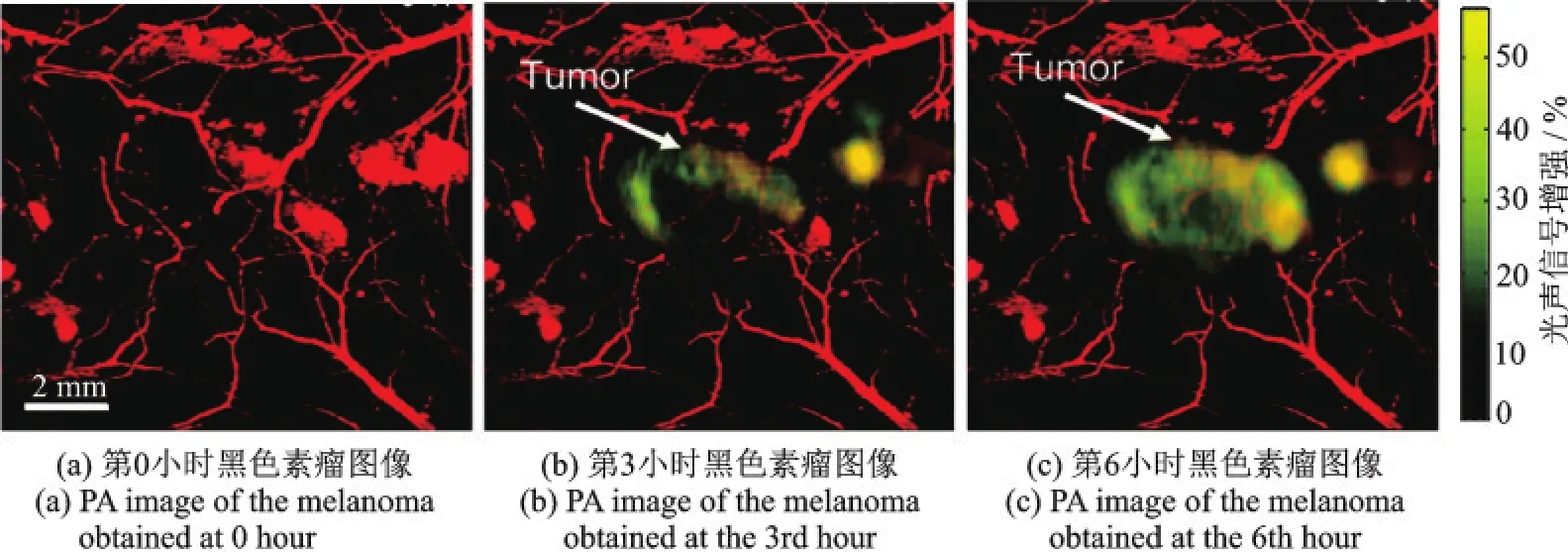
图21 主动靶向B16黑色素瘤的金纳米笼分子成像[72]Fig.21 Molecular imaging of B16 melanoma targeted by bioconjugate gold nanocages[72]
5 总结与展望
经过10余年的发展,PAM已成为生命科学基础研究和临床研究中重要的影像学手段,本文从原理及分类、新型技术的发展和生物医学应用等方面介绍了PAM技术的研究进展。结合各种新型扫描方法,PAM速度得以突破传统电机扫描速度限制,在高动态的生物过程成像上具有应用潜力,同时,小型化和轻量化光声显微系统的研制可满足临床应用需求;针对PAM的DoF限制,基于贝塞尔光束和变焦透镜的DoF延拓技术在获取大DoF三维信息方面具有独特优势。生物医学应用中,PAM依靠组织内源性对比剂可以实现血管生物学结构高分辨成像,用于肿瘤血管生成等疾病的无标记监测和诊断;结合功能成像,还可以为肿瘤代谢和脑科学研究提供多参量信息;基于外源性对比剂的分子成像可以对肿瘤等疾病进行高灵敏度、高特异性成像,为肿瘤诊疗研究提供便利。
虽然PAM依靠高分辨的成像性能以及灵活的成像模式,在血管生物学结构成像、光声分子与功能成像中广泛应用,但是仍有诸多不足之处有待解决。传统PAM采用光学聚焦或者声学聚焦的方式难以在单一系统上实现从微观到宏观的跨尺度成像,因此多尺度成像分辨率和成像深度的整合是未来发展的方向;另外,单一模态的PAM方式难以胜任复杂的临床应用实际需求,多种成像模式的集成化成为另一种新的发展趋势,如光声/超声成像、光声/荧光共聚焦成像、光声/OCT成像等双模态或多模态的成像形式,能够为特定的应用研究开展提供便利;最后,光声分子成像则有助于疾病的精准诊断,而目前可用于光声成像的分子探针仍然有限,开发新型光声成像/治疗一体化的外源性分子探针,可为肿瘤等疾病的诊疗一体化提供新的思路。
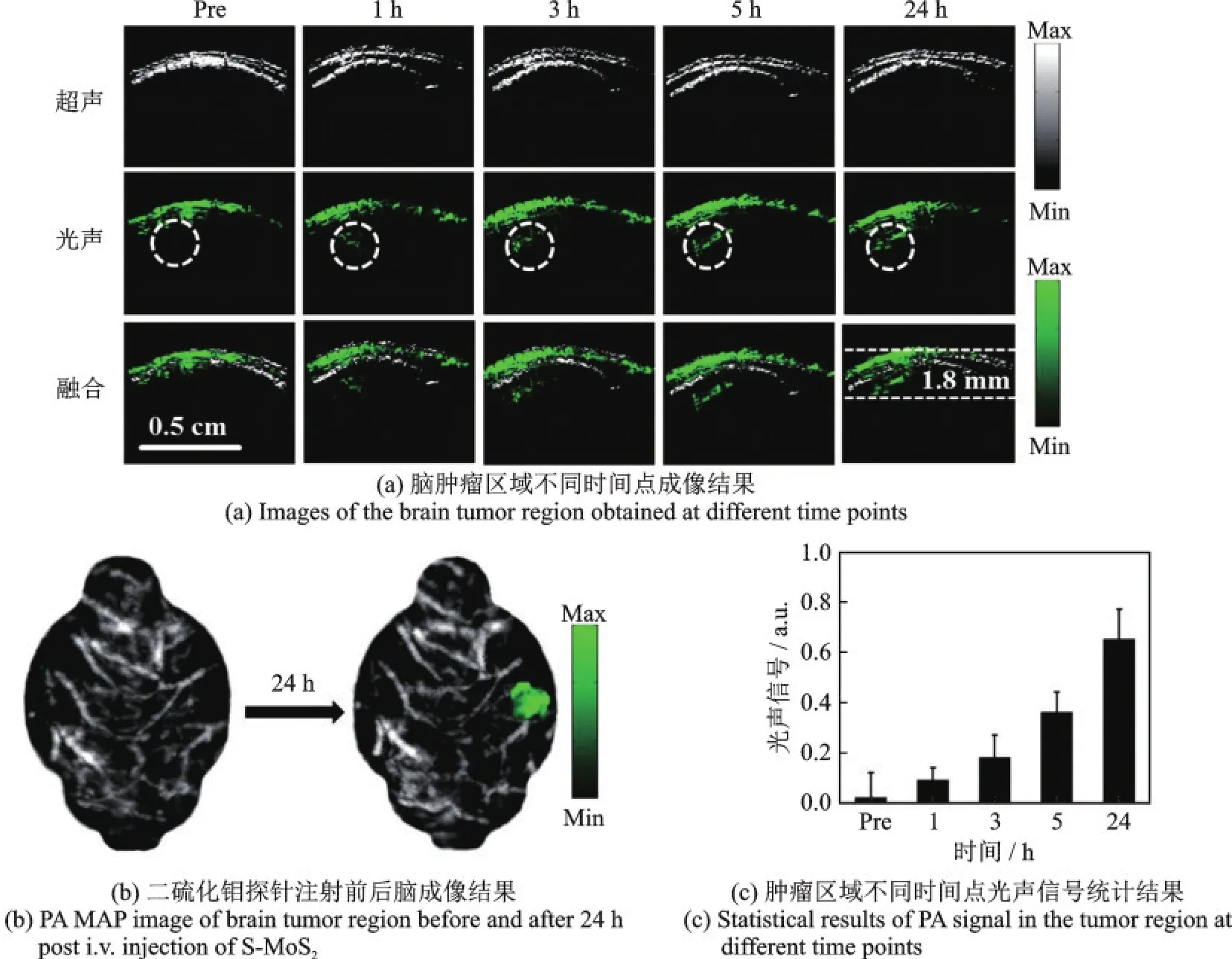
图22 原位脑瘤模型的单层二硫化钼分子成像[79]Fig.22 Molecular imaging of single-layer MoS2in an orthotopic brain tumor model[79]
