猴头菌粉对结肠炎小鼠肠道菌群的影响
2019-10-30任怡琳史劲松许正宏
李 望, 耿 燕*, 任怡琳, 史劲松, 许正宏
(1.江南大学 药学院,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
研究证明,肠道微生物的群落组成和多样性改变会影响肠道内环境的稳态,促进结肠炎的发展[1-4]。猴头菌(Hericium erinaceus)是著名的药食用真菌,具有良好的抗氧化活性[5],并对结肠炎的治疗[6]、胃黏膜的保护[7]等具有重要作用。鉴于猴头菌对消化系统的保护作用,作者初步考察猴头菌粉对DSS诱导小鼠结肠炎的治疗效果,并利用变性梯度凝胶电泳技术从肠道微生物的角度探讨猴头菌粉对结肠炎小鼠的影响。
1 材料与方法
1.1 实验动物
SPF级C57BL/6雄性小鼠:6周龄,购自上海斯莱克实验动物有限公司。
1.2 实验器材
1.2.1 材料与试剂猴头菌粉:江苏省神华制药有限公司提供;粪便隐血试剂盒:南京森贝伽公司产品;H&E染色试剂盒:上海碧云天公司产品;蛋白酶K:美国Thermo公司产品;PCR产物纯化回收试剂盒:上海捷瑞公司产品;DNA测序和引物合成服务:上海生工提供。
1.2.2 仪器倒置显微镜:日本Nikon公司产品;低温高速离心机:德国Epperdorf公司产品;振荡恒温金属浴:上海一恒公司产品;核酸浓度测定仪:美国Thermo公司产品;PCR仪、凝胶成像系统和变性梯度凝胶电泳仪:美国Bio-Rad公司产品。
1.3 实验方法
1.3.1 动物模型的建立和给药方法参照文献方法[8]建立DSS小鼠结肠炎模型。C57BL/6雄性小鼠于实验环境适应一周后随机分为4组,每组8只。正常对照组(NC):饮食饮水为正常饲养条件;DSS模型组(MC):2%DSS溶液替代饮用水,饮食条件不变;HE低剂量组(HEL):小鼠自由摄取2%DSS溶液,同时每天灌胃猴头菌粉溶液,剂量为250 mg/kg;HE 高剂量治疗组(HEH):饮用 DSS溶液,同时每天灌胃猴头菌粉溶液,剂量为500 mg/kg。具体分组和实验步骤如图1所示。
1.3.2 小鼠病活动指数评分(Disease activity index,DAI) 记录各组小鼠的体重并监测小鼠粪便形状和隐血情况,参照文献[9]进行DAI评分。小鼠同时接受猴头菌粉和2%DSS小鼠作用7 d后牺牲,分离结肠组织,记录结肠长度并收集肠道内容物。

图1 猴头菌粉对DSS诱导小鼠结肠炎的治疗方法Fig.1 ProcedureofDSS-induced colitisin miceadministrated with Hericium erinaceus
1.3.3 小鼠结肠病理检查解剖取新鲜的结肠组织固定于福尔马林溶液,制作病理组织切片,在显微镜下观察结肠组织炎症细胞浸润、腺体和隐窝结构等情况。
1.3.4 结肠内微生物总DNA的提取样品中加入500 μL 的裂解缓冲液 (50 nmol/L Tris-HCl,100 nmol/L EDTA,100 nmol/L NaCl,1 g/dL SDS)和2.5 μL蛋白酶K,55℃恒温振荡器震荡3 h后,与500 μL水饱和酚—三氯甲烷—异戊醇 (体积比为25∶24∶1)混匀离心取上清,两倍体积乙醇与上清混匀后离心取沉淀DNA,用体积分数70%乙醇洗涤DNA,挥发干乙醇后加入TE缓冲液 (10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0)溶解 DNA,测定DNA浓度。
1.3.5 16S rDNA V3区PCR扩增将16S rDNA V3区基因采用通用引物进行扩增,引物序列如下:上游引物5'-CGC CCG CCG CGC GCC GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3';下游引物 5'-ATT ACC GCG GCT GCT GG-3'。 Touch-down PCR 程序:94 ℃,3 min;94 ℃,1 min;65 ℃,1 min;72 ℃,1 min;从第二次循环开始,每个循环退火温度降低1℃,退火温度达到55℃后,72℃延伸6 min;4℃,∞。Touchdown PCR产物进行Recondition PCR,程序为:94℃,3 min,94 ℃,1 min;55 ℃,1 min;72 ℃,1 min,6次循环后,72℃延伸6 min;4℃,∞。
1.3.6 变形梯度凝胶电泳 (PCR-DGGE)采用变形梯度凝胶电泳仪进行DGGE,凝胶浓度为30~50 g/dL,60℃下200 V电泳4 h。SYBR GreenⅠ染料对凝胶进行染色,凝胶成像系统拍照,采用Quantity one软件分析图谱,构建PCR-DGGE的聚类分析图。
1.3.7 DGGE条带分析切下含有目的DNA片段的凝胶,加入20 μL无菌ddH2O于灭菌离心管中捣碎,4℃过夜。取进行方法1.2.5中的Touch-down PCR,其中上游引物5'-CCT ACG GGA GGC AGC AG-3';下游引物5'-ATT ACC GCG GCT GCT GG-3'。PCR产物进行胶回收,连接,转化到PMD19-T感受态细胞中,在添加氨苄的平板上随机挑取转化子接入含有氨苄的LB摇瓶培养基中,37℃培养12~16 h后进行菌落PCR验证,通用引物序列为M13-47和 RV-M,PCR程序同上述 Recondition PCR程序方法,选取含有目的基因的转化子菌液,送样由上海生工进行测序,序列在Gen Bank数据库中进行同源性比较分析。
2 结果与分析
2.1 猴头菌粉对小鼠结肠炎的治疗效果
2.1.1 猴头菌粉对小鼠体质量的影响观察小鼠的活动状况可以发现,正常小鼠饮食饮水及活动均正常,无便血;模型组小鼠出现便血、弓背、活动减少等现象。检测小鼠实验期间的体重变化,由图2所示,正常组小鼠的体质量变化不大,而模型组小鼠的体重在0~3 d时波动不大,但从第4天开始,体质量变化呈现急剧下降的趋势;与正常组相比,猴头菌粉低、高剂量两组的小鼠体质量整体也呈下降趋势,但是变化趋势较DSS模型组有所减缓。
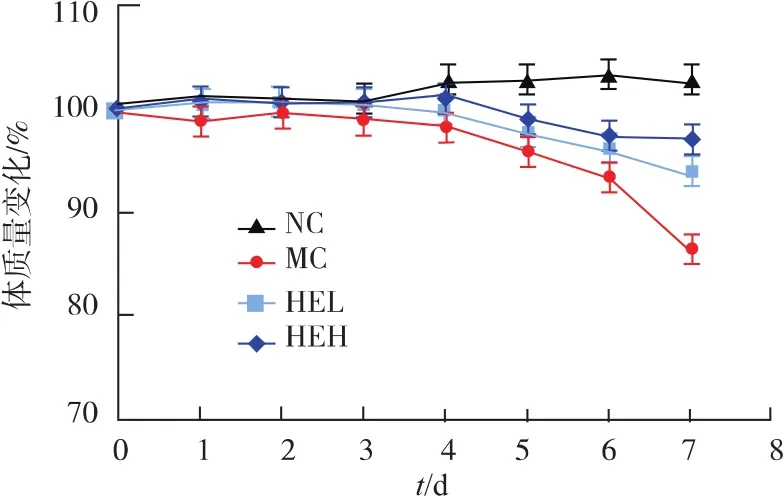
图2 猴头菌粉对DSS诱导的结肠炎小鼠体质量的影响Fig.2 Effect of Hericium erinaceus on body weight of mice with colitis
2.1.2 猴头菌粉对小鼠结肠长度的影响如图3所示,正常小鼠的结肠长度在6.7~7.3 cm,当小鼠接受DSS刺激后,引发溃疡性结肠炎,其结肠长度为4.1~4.8 cm,较正常组明显缩短(###p< 0.001);接受猴头菌粉低剂量治疗的小鼠,其结肠长度增长至5.5~5.9 cm,猴头菌粉高剂量组小鼠的结肠长度为6.1~6.4cm,两组的结肠长度较模型组均明显增加(**p< 0.001,***p< 0.001),且高剂量猴头菌粉治疗效果更佳。
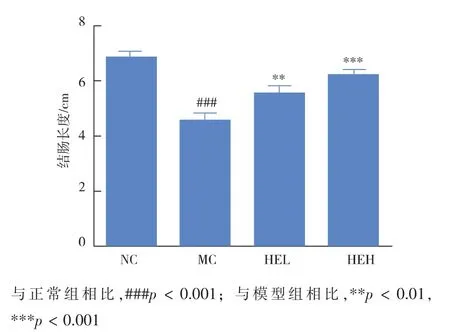
图3 猴头对DSS诱导的结肠炎小鼠结肠长度的影响Fig.3 Effect of Hericium erinaceus on colon length of mice with DSS-induced colitis
2.1.3 猴头菌粉对小鼠DAI的影响如图4所示,正常组小鼠体质量波动不大,偶有稀便,而模型组小鼠的体质量急剧下降,粪便出现肉眼可见的含血情况,因此其DAI评分极显著增加(###p<0.001);与模型组小鼠相比,HEL和HEH两组小鼠的粪便含血情况得到明显改善,且体质量下降趋势得到减缓,两组的DAI评分明显降低(**p<0.001,***p<0.001)。这说明,猴头能改善DSS诱导小鼠结肠炎的临床症状,对结肠炎有良好的治疗效果。

图4 猴头菌粉对DSS诱导的结肠炎小鼠DAI评分的影响Fig.4 Effect of Hericium erinaceus on DAI score of mice with DSS-induced colitis
2.1.4 小鼠结肠组织病理切片观察由病理切片图5可以看出,正常组小鼠基本没有出现炎性细胞浸润的情况,黏膜没有糜烂且无溃疡形成,隐窝和腺体结构保持完整且排列规则;由于DSS的刺激作用,在模型组小鼠的结肠组织中,隐窝和腺体的正常结构被破坏,观察发现大量炎性细胞浸润到黏膜层;与模型组相比,HEL和HEH两组的黏膜损伤程度小,腺体结构破坏较轻,炎性细胞的数量和浸润深度都显著减少。这表明,猴头菌粉可以修复DSS诱导的结肠黏膜损伤,减轻肠道炎症反应,保护结肠组织。
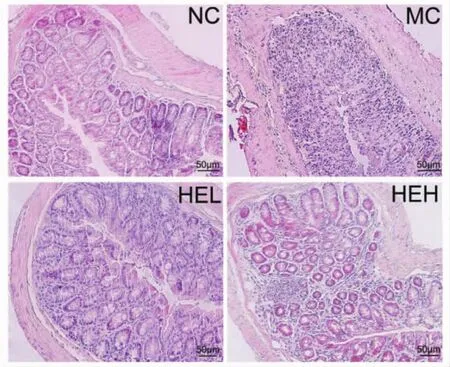
图5 小鼠结肠组织病理切片(H&E染色,×200)Fig.5 Histopathological sections of colon (H&E staining,×200)
2.2 猴头菌粉对小鼠肠道菌群的影响
2.2.1 肠道微生物16S rDNA V3区PCR-DGGE图谱分析PCR-DGGE技术是分析复杂微生物组成的简便手段,在DGGE图谱中,每一个条带代表一类细菌,条带的数量及其灰度分别代表细菌的多样性和相对丰度[10]。由图6可以看出,DGGE技术可以有效反应肠道菌群的多样性,与正常组相比,模型组条带数量没有明显减少,说明肠道菌群的多样性没有明显变化,但是条带的整体灰度明显降低,说明其肠道菌群的丰度减少。模型组中条带A的灰度明显增加,条带B和C的灰度减少,说明在结肠炎小鼠的肠道菌群中,条带A代表的微生物相对丰度增加,条带B和C代表的微生物相对丰度减少,而与模型组相比,HEL和HEH两组中条带A的灰度降低,条带B和C的灰度整体呈增加趋势,猴头菌粉能调节由结肠炎引起的肠道菌群失调,维持肠道内环境的稳态。

图6 肠道微生物16S rDNA V3区PCR-DGGE指纹图谱Fig.6 DGGE profiles of intestinal microbiota in V3 region
2.2.2 PCR-DGGE图谱聚类分析如图7显示,采用非加权成对算术平均法UPGMA分析肠道微生物PCR-DGGE图谱时发现,各组样本都能够有效的聚为一类,由于个体差异,个别样品出现不同。正常组和模型组的相似性降低为50%,说明发生结肠炎小鼠的肠道微生物群落结构与正常组小鼠存在显著差异;HEL和HEH两组能够与模型组区分,并与正常组聚类,相似性可达到64%,说明接受猴头菌粉治疗的小鼠,其肠道微生物群落向正常组接近。
2.2.3 微生物特异性分析根据DGGE图谱发现,条带A、B和C的灰度与正常组相比,发生显著变化,于是将3个条带测序并在GenBank中进行同源性比对分析,结果显示条带A为Clostridium cocleatum(99%), 条 带 B 为Akkermansia muciniphila(100%), 条带 C 为Barnesiella intestinihominis(99%)。

图7 肠道微生物16S rDNA V3区DGGE图谱聚类分析Fig.7 UPGMA analysis on DGGE profiles of intestinal microbiota in C57BL/6 mice
3 讨论
溃疡性结肠炎的发病原因及相关机制还未有确切结论,但是越来越多的研究发现其发生、发展与肠道微生物的作用密不可分[11]。作者初步考察了猴头菌粉对小鼠结肠炎的治疗效果,并利用PCRDGGE技术,分析猴头菌粉对结肠炎小鼠肠道微生物的影响。研究结果发现,猴头菌粉对结肠炎具有良好的治疗效果。经过治疗的小鼠饮食和活动情况得到改善,体重下降趋势减缓,DAI评分降低。观察结肠的病理组织切片可以发现,发生结肠炎的小鼠结肠中出现大量炎性细胞的浸润和杯状细胞缺失的现象,隐窝腺体严重变形或消失,治疗组的小鼠结肠隐窝结构清晰可见,腺体排列整齐,但是仍然有不少炎性细胞浸润。陈敏等[12]人研究发现猴头提取物颗粒可以改善机体自由基水平来修复三硝基苯磺酸诱发的大鼠溃疡性结肠炎。李桂珍[13]、周中银[14]等人也在临床水平上证实了猴头菌提取物对溃疡性结肠炎具有良好的治疗效果。
通过分析PCR-DGGE指纹图谱发现,结肠炎小鼠与正常组小鼠的肠道微生物相似性为50%,且图谱中大部分条带灰度降低,说明结肠炎小鼠的肠道菌群结构发生一定改变,菌群丰度降低,这与Zhang等[15]报道的结果一致。经过测序并在Gen Bank中进行比对发现,结肠炎小鼠肠道菌群中Clostridium cocleatum含量高于正常水平,治疗组中该菌的生长繁殖能够得到有效抑制。Erja Malinen[16]等研究发现肠易激综合症 (IBS)患者胃肠内C.cocleatum的含量明显高于健康人群。Bibiloni等[17]利用PCR-DGGE技术分析肠炎小鼠粪便样品,研究结肠炎发生过程中小鼠肠道微生物的变化,研究结果显示,小鼠肠道内C.cocleatum含量显著高于普通小鼠。这说明C.cocleatum与肠道疾病的发生相关,经DSS诱导引发肠炎疾病后的小鼠,其肠道内环境发生了变化,促进C.cocleatum快速繁殖。Akkermansia muciniphila在结肠炎小鼠内的含量降低,治疗组中该菌的相对丰度增加。Everard等[18]研究发现当肠道粘液层的A.muciniphila含量增加时,其对维持肠道内平衡,抑制饮食诱导的黏膜屏障厚度减少等具有重要作用。同时,A.muciniphila能够增强肠上皮细胞的单层完整性,从而对受损肠道屏障起到一定的增强和保护作用[19]。Zhang等[15]研究发现DSS诱导后的小鼠肠道中A.muciniphila含量下降,促进了结肠炎的发展。A.muciniphila含量减少,影响了炎症肠道粘膜和屏障的修复,加剧了结肠炎的发展,而猴头菌粉的治疗可以促进A.muciniphila生长繁殖,使其发挥保护肠道粘膜的功能,改善肠道炎症症状。Sasso等[20]研究发现Barnesiella intestinihominis存在于人类和小鼠肠道中,其含量在IBD患者肠道中显著减少。Zhao等[21]发现在抗生素处理后的肠道微生物中B.intestinihominis含量减少,短链脂肪酸、初级胆汁酸的代谢水平也出现显著降低。治疗组小鼠肠道中由DSS摄入引起B.Intestinihominis含量降低情况有所改善,说明猴头菌粉能缓解肠道细菌紊乱的情况,维持机体代谢平衡。
4 结 语
猴头菌粉对DSS诱导的小鼠结肠炎具有良好的治疗效果,同时在一定程度上改善结肠炎小鼠肠道菌群紊乱的情况。DSS的摄入扰乱了肠道细菌的群落结构,使得结肠炎小鼠肠道的菌群丰度低于正常水平,C.cocleatum菌群相对含量增加,猴头菌粉促进了A.muciniphila等有益微生物的生长,减轻肠道炎症反应,从而在炎症性肠病的预防和治疗中发挥功效。猴头可以作为一种保健食品发挥改善溃疡性结肠炎的作用,但是具体的作用机制仍待进一步研究。
