基于非靶向代谢组学分析假单胞菌P1解磷作用
2019-10-29张淋淋左湘煕张亚玉
孙 海,张淋淋,金 桥,李 乐,左湘煕,吕 林,张亚玉
(1.中国农业科学院 特产研究所,长春 130112;2.中国农业科学院 兰州兽医研究所,兰州 730046)
磷是植物生长的必需元素之一,也是农业生产中最重要的养分限制因子[1]。土壤中磷以有机态和无机态两种形式存在。最常见的原生磷矿物为磷灰石,次生磷矿石包括各种磷酸钙和非晶态铝和铁的磷酸盐[2]。土壤有机磷主要是正磷酸盐单酯,包括肌醇磷酸盐、正磷酸盐二酯、有机聚磷酸盐和磷酸酯[3]。成土过程中岩石及不同形态磷的相对比例发生改变,主要体现在磷酸钙的减少,有机磷、非封闭磷 (表面磷)和封闭磷 (次生矿物磷)的逐渐积累[4]。研究发现微生物量磷在总磷含量中占比高达40%,由此可见,研究微生物解磷作用对于提高土壤中磷的利用率至关重要[5]。
土壤中磷(有机态和无机态)的生物有效性不仅与土壤中全磷含量有关,与其有效性更有关,在一定条件下二者相互转化,其中微生物在磷的活化和固化中起着推动作用[6]。土壤中磷的生态循环转化过程,包括吸附-解吸、矿化-固化及无机磷形态转化过程,土壤微生物主要参加土壤磷的矿化-固化过程,参与土壤无机态磷和有机态磷之间的互相转变,而解磷微生物代谢产生的磷酸酶、根系分泌物等在此过程起催化作用。鉴于解磷微生物良好的促生效果,越来越多的工作者聚焦在解磷菌株的筛选上,目前解磷微生物包括根瘤菌属、芽孢杆菌属、肠杆菌属、假单胞菌属、固氮螺旋菌属及固氮菌属等微生物[7-11]。
土壤磷循环以微生物活动为中心,有机磷在微生物的作用下转变成无机磷形态才能被植物吸收利用,这一过程取决于解磷微生物(Phosphate solubilizing microorganisms,PSMs) 的种群结构和数量以及磷酸酶的活性[12]。假单胞菌属是解磷微生物之一,能够明显提高土壤中可溶性磷的含量,增加植物对磷元素的吸收,从而促进植物的生长[13-15]。微生物解磷机理主要包括以下三方面:一是微生物之所以能够溶解难溶性磷酸盐, 主要是由于其在代谢过程中分泌多种有机酸,一方面降低了培养介质的pH,另一方面有机酸与Ca2+、Fe3+、Fe2+、Al3+等离子螯合而使难溶性磷酸盐溶解[16];二是微生物的解磷作用主要是由于在其代谢过程中分泌质子的缘故,使培养介质的酸度提高,即介质的pH降低,从而使磷矿粉溶解[17];三是解磷微生物在以难溶的无机磷为磷源的培养基上生长,培养过程中随着有效磷含量的降低和有机酸的形成,培养基中形成了新的难溶性有机磷。由于有效磷的缺乏迫使微生物进一步利用有机磷,这一动态过程中有机磷和pH发生多次变化,直至由于营养缺乏导致微生物死亡[18]。
笔者前期分离得到一株假单胞菌,经鉴定是一株新的菌株(PseudomonasP1),进一步在人参上开展盆栽促生试验,不仅可以提高人参株高、增加须根数量,同时能够提高人参皂苷含量,促生效果明显[19]。但是,假单胞菌繁育过程中代谢产物是什么?其解磷机理目前尚不清楚,而非靶向代谢组学是对生物体小分子(相对分子量小于1000)进行定性和半定量分析的组学技术,可以实现对目标样本小分子代谢物的初步筛选[20]。鉴于此,本研究拟在已有研究的基础上,利用液体摇瓶方式进一步开展假单胞菌胞外代谢物非靶向代谢组学研究,挖掘与无机磷RP(Rock phosphate)分解相关差异代谢物,为该微生物溶磷机理研究及推进微生物肥料开发应用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌种 假单胞菌PseudomonasP1由中国农业科学院特产研究所从野山参根区土壤分离得到,保藏于中国农业微生物菌种保藏管理中心(ACCC60363)。
1.1.2 培养基 牛肉膏蛋白胨培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,蒸馏水1 L, pH 7.2~7.4;无机磷液体培养基( 以下简记为PKO 培养基) : 葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g, Ca3(PO4)23 g,FeSO4·7H2O 0.03 g, MnSO4·4H2O 0.03 g,蒸馏水1 L,pH 7.0。
1.1.3 胞外代谢物准备 利用无机磷培养基对活化后的P1菌种进行液体培养,利用平板稀释涂布法培养计数,最后筛选得到菌液浓度为 2.0×106~20.0×106cfu/mL的6瓶菌悬液作为目标代谢物, 4 ℃、3 000 r/min离心5 min,弃去沉淀,重复3次后,过0.22 μm微孔滤膜过滤。部分将上清液转入2 mL冻存管并在-80 ℃冰箱保存,作为处理组供试样品,另一部分用于有效磷的测定(24 h内测定)。
1.2 分析方法
1.2.1 代谢组学检测 分析取等量细胞样品加入400 μL冷甲醇[V(甲醇)∶V(水)=4∶1],低温下高通量组织破碎仪破碎,加入100 μL超纯水,旋涡混匀后,冰上超声10 min,3次。4 ℃、 12 000 r/min 离心15 min,取上清液抽干,加V(乙腈)∶V(水)=1∶1 100 μL复溶,利用AB SCIEX公司的超高效液相色谱串联飞行时间质谱(UPLC-TripleTOF MS)进行检测。
色谱条件:色谱柱为BEHC18柱(100 mm×2.1 mm,内径1.7 μm;Waters,Milford,USA);流动相A为水(含φ=0.1%甲醇),流动相B为V(乙腈)∶V(异丙醇)=1∶1,异丙醇含φ= 0.1%甲酸;流速为0.40 mL/min,进样量为 20 μL,柱温为40 ℃。
质谱条件:样品质谱信号采集分别采用正负离子扫描模式,电喷雾毛细管电压,进样电压和碰撞电压分别为:1.0 kV、40 V和6 eV。离子源温度和去溶剂温度分别为:120 ℃和500 ℃,载气流量为900 L/h,质谱扫描范围50~1 000m/z,分辨率为30 000。
质控:为了评价在上机过程中分析系统的稳定性,试验过程中会绘制一个质控(Quality control,QC)样品。QC样品由所有检测样品混合而成,在一起分析的过程中,每6个分析样品插入一个QC样品,在样品分析时,可通过QC样本的重复性以考察整个分析过程中仪器稳定性,同时也可用于发现在分析系统中变异大的变量,保证结果的可靠性。
1.2.2 有效磷测定 取5 mL收集的胞外代谢菌悬液,按照钼锑抗比色法测定培养液中的有效磷[21]。
1.3 数据分析
利用 LECO 公司的Chroma TOF4.3X 软件和LECO-Fiehn Rtx5 数据库对采集得到的谱图进行过滤噪音、解卷积、峰强度校正、峰定性和定量等分析。数据预处理后,利用Simca-P v13.0软件(Umetrics AB,Umea,Sweden)进行正交最小偏二乘判别分析[Orthogonal partial least squares discriminant analysis(OPLS-DA)]、利用R 语言软件包进行OPLS-DA及维恩图的分析绘制,根据变量权重重要性排序(Variable importance in projection,VIP>1),结合t检验 (P<0.05)来寻找差异性表达代谢物;采用皮尔森相关分析,设r≥0.9,P<0.05 为相关性化合物,对差异化合物进一步利用GraphPad Prism 5进行柱状图绘制。
有效磷及差异代谢物采用Excel 2016和SAS 9.1进行相关数据统计分析。
2 结果与分析
2.1 有效磷质量浓度
利用液体药瓶和钼锑抗比色法测定P1对无机磷的溶磷效果的结果发现,以不接菌为对照(CK),培养达到指数期后,对照培养液中可溶性磷的质量浓度仅为4.44 μg/mL,接种P1处理可溶性磷的质量浓度为461.36 μg/mL,是CK的103.9倍,由此表明P1菌株具有高效溶磷能力。
2.2 代谢组学结果分析
2.2.1 多元统计分析 OPLS-DA结果如图1,PseudomonasP1和对照组代谢产物分别聚为一类,明显分离,表明处理组和对照组存在明显差异,且样本全部处于95% 置信区间。PLS-DA正负离子模式的模型参数分别为R2X=0.719,Q2=0.994,R2和Q2为协方差模型R2Y、Q2Y线性回归直线与相关度的截距值,用来衡量模型是否过拟合,Q在纵轴上的截距等于或小于0,表明试验所建立的模型有效。总的来说,模型不存在过度拟合现象,稳健性良好,结果可用于后续的差异成分分析。

图1 Pseudomonas P1的OPLS-DA模型和置换检验Fig.1 OPLS-DA model and permutation test results of Pseudomonas P1
2.2.2 潜在生物代谢物筛选 将PseudomonasP1与对照的代谢物绘制韦恩图,寻找处理和对照差异代谢物。结果显示PseudomonasP1代谢产物共有418种,对照代谢产物有367种,二者共有代谢产物为354种(图2)。根据OPLS-DA模型获得的特征变量VIP值,共筛选出VIP>1.0且t检验P<0.05的差异代谢物共23种(表1)。并对其相对含量进行统计分析(图3)。结果表明尿石酸B-3-O-葡糖苷酸、m-香豆酸、磷脂酰乙醇胺(18∶1(9Z)/15∶0)、磷酯酰乙醇胺(17∶1(92)/18∶0)、磷脂酰乙醇胺(16∶0/16∶1(9Z))、磷脂酰乙醇胺 (16∶1(9Z)/19∶1(9Z))、磷脂酰乙醇胺 (16∶1(9Z)/20∶1(11Z))、磷脂酰乙醇胺 (17∶0/15∶0)[U]、1-棕榈酰-2-亚油酰基磷脂酰乙醇胺、D-(+)-3-苯基乳酸、C16鞘氨醇、磷脂酰乙醇胺 (19∶1(9Z)/0∶0)、3-O-咖啡酰莽草酸、植物鞘氨醇、鞘氨醇和磷脂酰乙醇胺共16种差异代谢物在PseudomonasP1处理组中相对含量明显升高。而β-D-乳糖、肌醇、3-羟基-3-甲基-戊二酸、雷尼替丁、4-羟基-2-丁烯酸 γ-内酯以、(z-4′,6-二羟基壬酮-6-葡萄糖苷及双(2-乙基己基)领苯二甲酸酯共7种差异代谢物在PseudomonasP1处理组中相对含量明显下降。
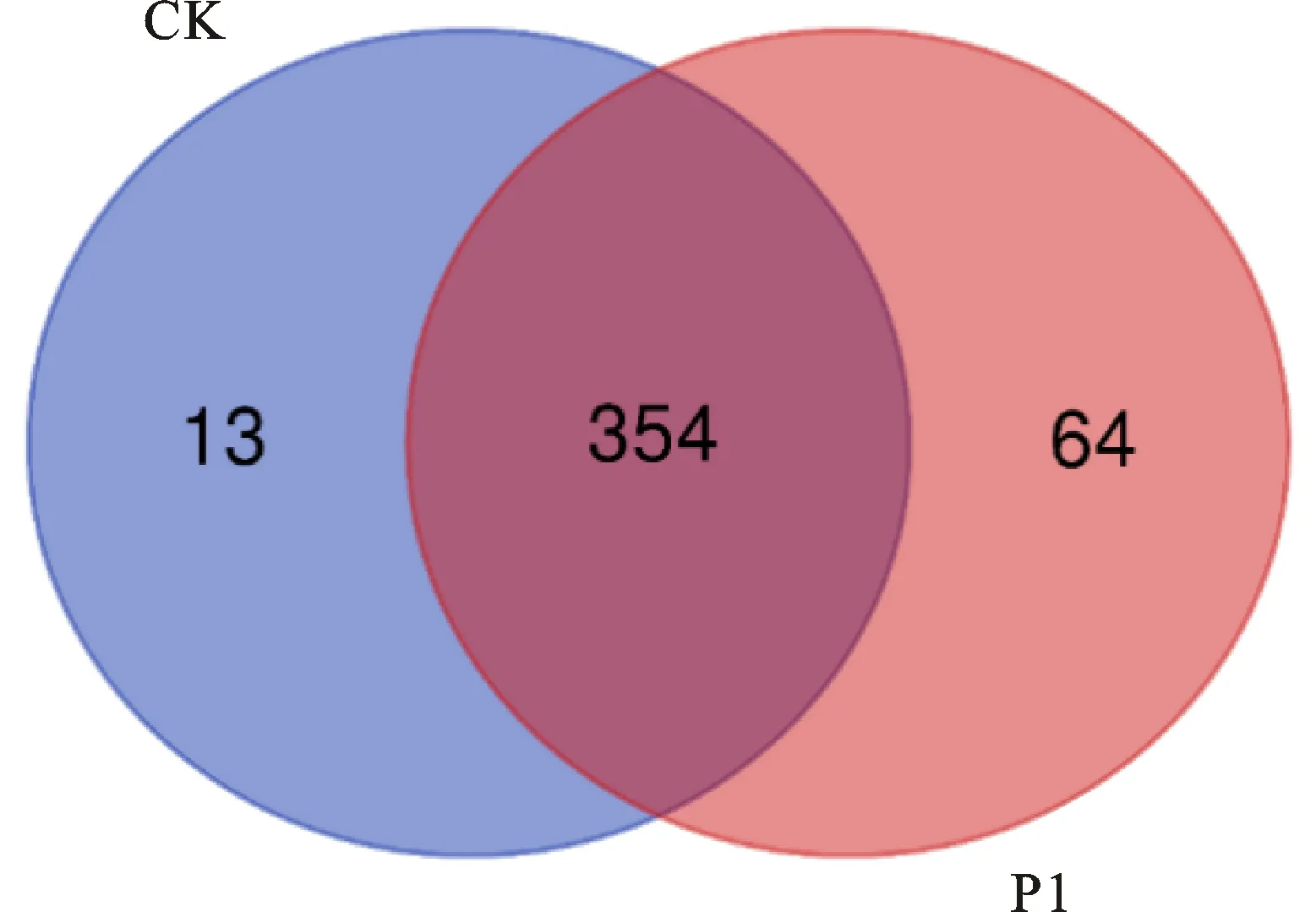
图2 Pseudomonas P1与对照代谢物韦恩图Fig.2 Venn diagram of differentially expressed metabolites in Pseudomonas P1 and control
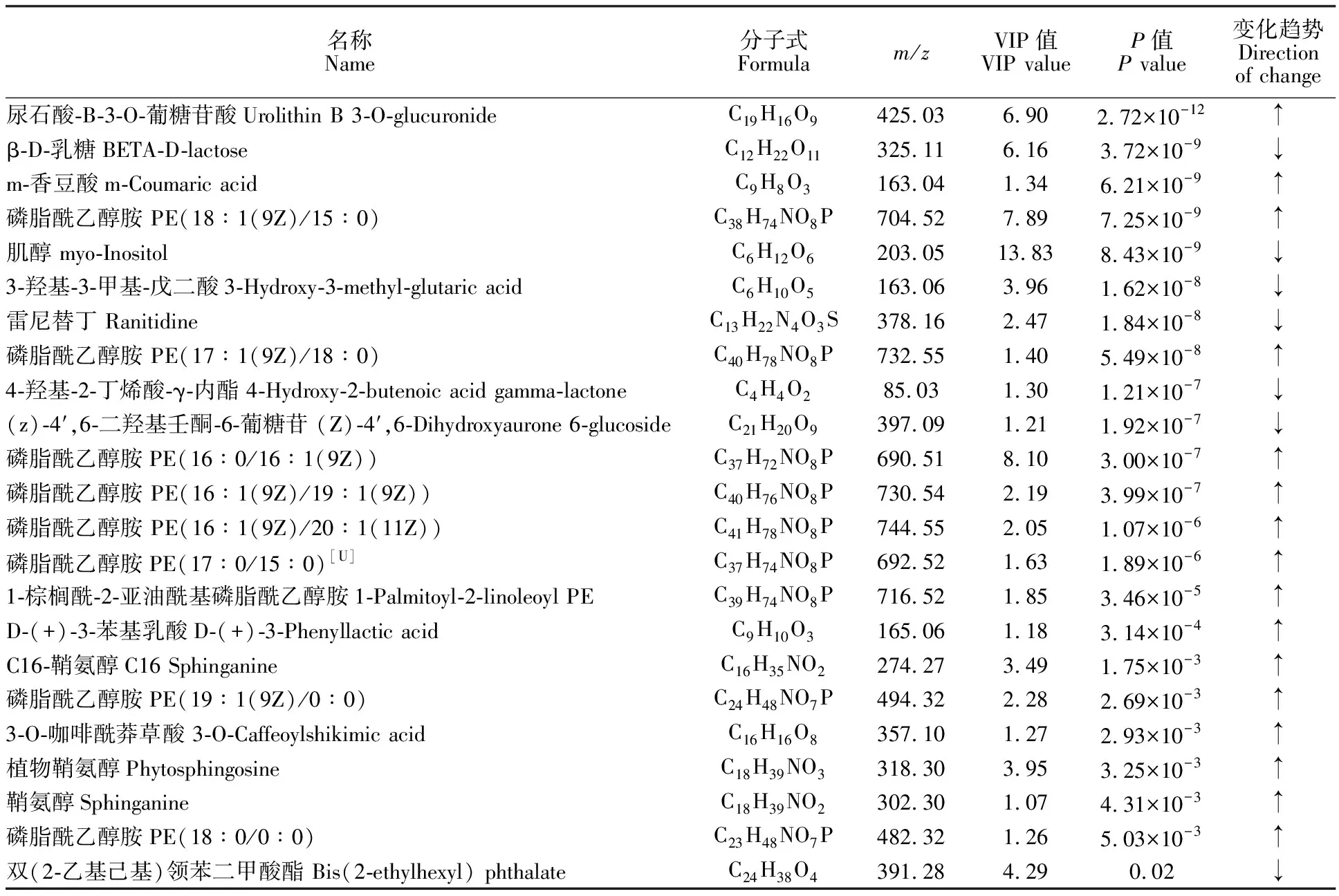
表1 Pseudomonas P1与对照差异代谢物Table 1 Differentially expressed metabolites in Pseudomonas P1 and control
注:↑表示在PseudomonasP1中差异代谢物水平上升,↓表示在PseudomonasP1中差异代谢物水平下降。
Note: ↑means that the level of differentially expressed metabolites increased in P1 group,while ↓ means that the level of differentially expressed metabolites decreased in P1 group.
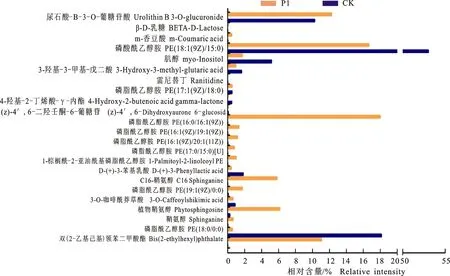
图3 Pseudomonas P1与对照代谢物相对含量变化Fig.3 Relative intensity changes of the differentially expressed metabolites in Pseudomonas P1 and control
2.2.3 KEGG代谢通路分析 将处理组和对照组比较分析得到的全部差异代谢物提交至KEGG网站,进行通路分析。结果显示,PseudomonasP1与对照组之间代谢物共参与22条代谢通路,其中参与3条以上的代谢通路10条,结果见表2。其中磷脂酰乙醇胺(18∶1(9Z)/15∶0)、磷脂酰乙醇胺(16∶1(9Z)/19∶1(9Z))、磷脂酰乙醇胺(16∶1(9Z)/20∶1(11Z)) 3种代谢物共同参与10条代谢通路,肌醇参与9调代谢通路,鞘氨醇和植物鞘氨醇共同参与2条代谢通路, m-香豆酸共同参与3条代谢通路。

表2 差异代谢物代谢通路分析Table 2 Metabolic pathway of the differentially expressed metabolites in Pseudomonas P1 and control
注:√表示差异代谢物参与该代谢通道。
Note: √ means that the differentially expressed metabolite sparticipate in the metabolic pathway.
3 讨 论
磷是植物生长发育过程中三大要素之一。通常土壤中磷的含量相当高,但大部分磷是以不溶的形式存在,因此不能满足植物的生长需要。这些不溶的磷以磷灰石的无机态形式或者以肌醇磷酸盐、磷酸三脂等有机态存在[22]。而植物根际促生菌可以通过释放有机酸或分泌胞外磷酸酶,溶解土壤中不溶性磷,从而使磷被有效的吸收和利用。已有研究表明在植物根围普遍存在着能溶磷和解磷的细菌,包括固氮菌、芽孢杆菌、肠杆菌、假单胞菌、曲霉菌和青霉菌等。课题组前期研究得到一株高效溶磷菌(PseudomonasP1),液体摇瓶试验表明处理组可溶性磷含量是对照的103.9倍,表明P1菌株具有良好的溶磷能力。
细胞代谢根据研究对象不同又可以分为胞内代谢组和胞外代谢组,二者具有高度的信息互补性[23],其中胞外代谢组能直接反映细胞与胞外环境间的能量物质交换模式。P1菌株属于假单胞菌的新种,为了揭示该菌株高效溶磷机理,本研究成功建立了P1菌株胞外代谢UPLC-Triple TOF非靶向代谢组学分析方法,科学建立模型是非靶向代谢组学后续挖掘差异代谢物的前提,而判别其是否科学通常根据OPLS-DA和Q检验结果确定[24]。P1菌株的胞外OPLS-DA正负离子模式的模型有效,且Q在纵轴上截距小于0,表明模型建立不存在过度拟合,有利于进一步对差异代谢物的识别和分析。OPLS-DA模型显示P1与对照的代谢存在明显差异,并筛选得到23种差异代谢物,主要包括小分子有机酸、脂类物质、配糖体及其他物质(表1)。
小分子有机酸主要包括尿石酸-B-3-O-葡糖苷酸、m-香豆酸、D-(+)-苯基乳酸、3-O-咖啡莽草酸,这些物质在P1处理中相对含量显著高于对照(图3),表明PseudomonasP1溶磷极有可能与这些有机酸含量有关。原因之一是这些有机酸降低培养基pH,增加难溶磷的溶解度[25]。另一方面能够与培养液中Fe3+、Ca2+、Mg2+等离子螯合,进而使难溶性磷酸盐转化为可溶性磷[26]。
脂类物质主要包括磷脂酰乙醇胺、肌醇、C16-鞘氨醇、植物鞘氨醇以及鞘氨醇,其中磷脂酰乙醇胺参与多条代谢途径(表2),磷酸肌醇代谢途径(Inositol phosphate metabolism)下游产物磷脂酰-1D-肌醇,进一步参与糖基磷脂酰肌醇(GPI)-锚生物合成途径(Glycosylphosphatidyl inositol (GPI)-anchor biosynthesis),而磷脂酰乙醇胺则是该代谢途径的中间产物,同时甘油磷脂代谢途径(Glycerophospholipid metabolism)代谢发生变化,该途径主要的中间产物是磷脂酰乙醇胺(Phosphatidyl ethanolamine)和磷脂酰胆碱(Phosphatidylcholine),P1菌株处理下磷脂酰乙醇胺在这些代谢途径中含量均高于对照,有利于细菌生存。磷脂酰乙醇胺属于膜脂类化合物,是膜细胞的重要组成部分,在细胞功能发挥具有重要作用,包括调控细胞膜转运功能、蛋白质功能和信号转导功能[27]。同时磷脂酰乙醇胺也是甘氨酸、丝氨酸和苏氨酸代谢途径(Glycine,serine,and threonine metabolism)下游产物,很可能是P1菌株在有效磷不足逆境下进行适应性生长和修复的一种补偿性调节途径[28]。此外,P1菌株细胞膜本身含有磷,主要包括核酸和磷脂等易矿化的有机磷和部分无机磷,约占微生物干物质量的1.4%~4.7%,随着微生物凋亡增加了可溶磷的含量。肌醇在本研究中主要参与半乳糖代谢(Galactose metabolism)和链霉素生物合成途径(Streptomycin biosynthesis),是两条代谢途径的中间产物。其中链霉素生物合成途径是以葡萄糖为起始物质,肌醇为中间产物,最后通过一系列代谢途径形成链霉素。而本研究中P1处理下肌醇含量低于对照,原因可能是取样时间点为P1培养指数期进行取样,处理组由于P1自身繁衍大量消耗葡萄糖,最终导致中间产物肌醇含量低于对照。本研究中还发现了其他一些差异代谢物,如4-羟基-2-丁烯酸-γ-内酯、(z)-4′,6-二羟基壬酮-6-葡糖苷等,在P1代谢产物中出现下调表达,但其机理尚不明确。
4 结 论
利用液体摇瓶与钼锑抗比色法进一步确定PseudomonasP1菌株具有高效溶磷作用,同时利用非靶向代谢组学从整体上水平上反映P1菌株内源性小分子代谢变化,有助于深入研究其解磷机理。初步推断P1菌株溶磷机理由两方面导致:一是由于其繁衍过程中产生小分子有机酸降低培养基中pH,促进有效磷的溶解。二是微生物细胞膜含有磷,凋亡过程中引入培养基大量有机磷和无机磷,增加磷含量。通过差异代谢物和代谢通路的分析,为P1菌株溶磷机理解析提供参考和借鉴。明确微生物解磷机理还需进一步结合差异微生物开展靶向代谢组学和验证试验,阐明P1菌株解磷机理并推进微生物肥料开发应用。
