胰岛素样生长因子-1(IGF-1)对小鼠卵丘细胞自噬与胞吞相关因子表达的影响
2019-10-29潘阳阳何翃闳胡学权王靖雷余四九
马 睿,潘阳阳,王 萌,李 秦,何翃闳,胡学权,赵 凌,王靖雷,崔 燕,余四九
(甘肃农业大学 动物医学院/甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
卵丘细胞在卵母细胞发育过程中扮演重要角色,与卵母细胞形成卵丘—卵母细胞复合体(Cumulus oocyte complexes, COCs),通过缝隙连接方式与卵母细胞进行物质交换,为卵母细胞发育提供营养物质[1-2]。相关研究表明,卵丘细胞的自噬活动可作为影响卵母细胞质量的因素之一,对卵母细胞的发育和胚胎的形成至关重要[3]。mTOR信号通路是细胞自噬调控的关键使者[4],mTOR信号通路受到抑制可降低卵母细胞的质量[5-7],影响卵母细胞发育。胞吞作为细胞生长的又一关键生理程序,可通过小窝蛋白与胰岛素受体(Ins-R)、表皮生长因子受体(EGFR)、G蛋白α亚基、蛋白激酶C(PKC)、内皮一氧化氮合酶(eNOS)及Src家族等多种蛋白相互作用,参与细胞物质运输、脂质代谢、细胞信号转导等生物事件,维持细胞的正常生长与质量[8]。
哺乳动物细胞受到外界刺激时可启动细胞自噬维持细胞内的稳定,也可清除细胞内的异常组分[9]。自噬正常生理功能的发挥需要自噬蛋白与多种活性酶的结合,从而消化降解异常物质,更新胞内物质,传递能量,维持胞内稳态。自噬过程中自噬相关基因5(Autophagyrelated gene 5,Atg5)可与Atg12蛋白结合, Atg12-Atg5和Atg16蛋白连接形成一个Atg12-Atg5-Atg16L复合物,在自噬体形成早期起重要作用[10]。Beclin1可与 3-磷酸磷脂酰肌醇激酶(PI3K)形成Beclin1/PI3K复合物,募集Atg8,最终促进自噬体膜的生成。而微管相关蛋白1轻链3(LC3)可靶向定位于自噬体膜,促进自噬体的形成,对细胞自噬的完成具有重要调控作用[11-12]。胞吞主要是细胞与外界物质交换的主要模式,通过Caveolin1(Cav1)和Caveolin2(Cav2)蛋白在细胞膜形成细胞膜穴样内陷,通过细胞膜脂质双层融合包裹外源成分,形成独立的囊泡后完成物质运输以摄取外界营养[13-14]。综上,Atg5、Beclin1、LC3、Cav1和Cav2表达的检测可作为细胞自噬与胞吞调控的重要指标。最新研究发现,在人小梁网细胞和人类乳腺癌细胞及组织的基底细胞中,Cav1蛋白可调节细胞内吞和自噬活动,敲除Cav1蛋白可促进细胞的自噬[15]。另有研究发现在人类T淋巴细胞中自噬蛋白也可调节受体Amyloid precursor protein(APP)的内吞作用[16]。这些发现说明自噬相关蛋白和胞吞相关蛋白的功能之间存在紧密联系,研究它们的作用方式十分必要。
胰岛素样生长因子-1(Insulin-like growth factor,IGF-1)作为细胞生长、卵母细胞成熟、胚胎发育的重要调控因子,广泛分布于卵巢、输卵管、子宫内膜和胎盘等组织[17]。在裸鼠心肌细胞中发现,IGF-1可抑制由于血清缺乏及营养匮乏等不利因素所导致的细胞自噬和细胞死亡,并且证明IGF-1是通过作用于AKT通路影响细胞自噬[18]。IGF-1可在多种类型的组织细胞中调控细胞自噬,如骨肿瘤细胞和血管细胞等。有研究表明,胰岛素受体-1(IRS-1)与Cav1蛋白之间有很重要的互作[19],说明IGF-1对细胞自噬和胞吞都有重要的作用,但目前未见IGF-1对哺乳动物卵丘细胞自噬和胞吞调控的报道。
本研究在小鼠卵丘细胞体外培养过程中分别添加0、50、100、150和200 ng/mL IGF-1,通过实时荧光定量PCR(qPCR)和蛋白免疫印迹(Western-blot,WB)等方法分别从基因和蛋白水平检测IGF-1对Atg5、Beclin1、LC3、Cav1和Cav2表达的影响,探索IGF-1参与小鼠卵丘细胞自噬和胞吞的调控机制,为进一步研究生长因子参与动物生殖相关细胞自噬与胞吞作用,及其对卵母细胞成熟和胚胎发育的作用机制提供理论依据。
1 材料与方法
1.1 主要材料
雌性昆明小鼠购于中国农业科学院兰州兽医研究所。在饲养和试验过程中,遵守清洁级动物管理规定,控制环境温度在26 ℃,注意通风,定期更换垫料和笼具,自由采食和饮水。
1.2 主要试剂
DMEM F12基础培养基,胎牛血清(FBS),青、链霉素,磷酸缓冲盐溶液(PBS)均购于美国Gibco公司;IGF-1、透明质酸酶、胰蛋白酶等购自美国Sigma 公司。微量RNA 提取试剂盒(Promega, 美国)、两步法反转录试剂盒(Promega, 美国)、SYBR GreenⅡ荧光定量PCR 试剂盒(宝生物,大连),免疫荧光检测及蛋白免疫印迹所用试剂均购买于南京碧云天生物公司,蛋白免疫印迹所用抗体均购于博奥森公司(北京),其他试剂均为国产分析纯,包括PBS(索莱宝,北京)和甲醇(大茂,天津)等。
1.3 主要方法
1.3.1 小鼠卵丘细胞的收集及培养 选取发育正常且健康状况良好的6~8周龄雌性昆明(KM)小鼠,于18:00每只注射PMSG 8 IU,间隔24 h后腹腔注射HCG 10 IU,12 h后,将小鼠脱颈处死,分离输卵管,在体式显微镜下用镊子撕开输卵管膨大部,使卵丘-卵母细胞复合体游离于生理盐水中,在体视显微镜下挑选有至少3 层致密卵丘细胞包裹卵母细胞的复合体,透明质酸酶消化(1 min),然后用自制玻璃吸管均匀用力反复吹打卵丘-卵母细胞复合体,使卵丘细胞与卵母细胞分离。将分散的卵丘细胞收集到提前配制好的细胞培养液中,1 000 r/min 离心 5 min,弃上清,重复2次后再用培养液重悬细胞,接种于 25 cm2的培养瓶中进行培养及传代。培养液为:DMEM/F12培养基+100 U/mL青霉素+100 μg/mL链霉素+150 g/L FBS。
1.3.2 免疫荧光检测Atg5、Beclin1、LC3、Cav1和Cav2蛋白 待细胞生长稳定后,取第3代细胞培养至对数生长期,使用2.5 g/L的胰蛋白酶消化制成细胞悬液,吹打均匀并调至合适密度(1×104mL-1),取200 μL悬液滴加于六孔板中的无菌盖玻片上,于37 ℃、φ=5% CO2培养箱静置20 min后加入2 mL培养液培养。待细胞长至铺满六孔板中无菌玻片的80%左右时,PBS洗3遍(每次5 min);每孔加入1 mL的4 g/L多聚甲醛,室温固定1 h,PBS清洗3遍(每次5 min);每孔细胞加入1 mL 0.05 g/L的Triton X- 100,室温孵育1 h,PBS精洗3遍(每次5 min);每孔加入1 mL 10 g/L的BSA,室温封闭2 h,PBS清洗3遍(每次5 min);一抗(Rabbit Anti-Atg5,Rabbit Anti-Beclin1,Rabbit Anti-LC3,Rabbit Anti-Cav1,Rabbit Anti-Cav2)4 ℃孵育过夜,PBS 清洗3遍(每次5 min);二抗(Goat Anti-rabbit IgG/HRP)室温避光孵育2 h,PBS清洗3遍(每次5 min);1 μg/mL 4′,6-二脒基-2-苯基吲哚(4′- 6- diamidino- 2- phenylin-dole, DAPI)染色3 min,PBS清洗3遍(每次5 min);抗荧光猝灭剂封片,在奥林巴斯荧光倒置显微镜下观察并照相。
1.3.3 IGF-1处理小鼠卵丘细胞 待细胞生长状态稳定后,取第4 代细胞培养至对数生长期,使用2.5 g/L的胰蛋白酶消化成细胞悬液,调至合适密度(1×105mL-1)后接种至六孔板,分别加入质量浓度为0、50、100、150和200 ng/mL 的培养液。放入恒温箱培养48 h后处理细胞,备用。
1.3.4 总RNA提取,反转录及PCR反应 细胞培养48 h后,PBS清洗3遍,用微量RNA 提取试剂盒提取总RNA,使用两步法反转录试剂盒合成cDNA。
1.3.5Atg5、Beclin1、LC3、Cav1和Cav2基因表达检测 使用实时荧光PCR仪检测Atg5、Beclin1、LC3、Cav1和Cav2mRNA的表达。反应体系为20 μL:cDNA 2 μL,上、下游引物各0.8 μL,2×SYBR Premix ExTaqⅡ 10 μL, Nuclease-Free 水 6.4 μL。反应条件:95 ℃预变性10 s; 95 ℃变性10 s,退火10 s,72 ℃延伸10 s,40个循环,每个样品设置4个重复。引物信息见表1。

表1 qRT-PCR引物信息Table 1 Information of primers used in qRT-PCR
1.3.6 Atg5、Beclin1、LC3、Cav1和Cav2蛋白表达检测 用PBS清洗卵丘细胞3次,加入蛋白裂解液充分裂解细胞,10 000 r/min离心15 min,收集上清,置于-80 ℃冰箱保存。沉淀中加入4×SDS上样缓冲液,100 ℃金属浴15 min使蛋白充分变性。以10 μL上样量进行电泳,电泳后通过湿转方法将蛋白转至PVDF膜。室温封闭3 h,一抗4 ℃过夜,PBST(PBS + tween-20)清洗 5 min,重复6次,二抗室温孵育1 h,PBST清洗3遍,电化学发光(ECL)试剂盒曝光2~5 min,待蛋白条带清晰时拍照分析。
1.3.7 数据分析 实时荧光定量结果采用2-△△Ct公式计算目的基因的相对表达量,WB结果利用Image Pro Plus软件测定蛋白条带的IOD值,根据IOD值分析蛋白的相对表达量(蛋白表达量=目的IOD/内参IOD)。
采用SPSS 19.0统计软件对数据进行单因素方差分析,每组至少重复3次,P<0.05表示差异显著,P<0.01表示差异极显著。结果以“平均值±标准误”表示,使用Graphpad prism 5.0绘图。
2 结果与分析
2.1 小鼠卵丘细胞的分离培养
卵丘细胞采用直接接种贴壁法进行培养。原代培养的卵丘细胞以1×105mL-1的初始密度被接种到25 cm2培养瓶中,8 h后,部分细胞由圆形向两头伸展成梭形贴壁生长,细胞之间有丝状联系。1 d后,细胞表面出现数个不规则的突起,突起部分相互接触并开始汇合,此时细胞间有大片间隙。2 d后细胞间空隙大幅减少,细胞呈多边形大量贴壁生长。3 d后细胞呈不规则的多边形,汇合成单层将瓶底铺满,之后出现接触抑制。培养过程中细胞铺满瓶底80%左右即可传代, 3~4 d传代1 次。培养过程中可在培养液的颜色变黄后给细胞换液。传代培养的细胞在含150 g/L FBS血清的DMEM/F12培养液中生长旺盛,6 h即可见到细胞贴壁。传代细胞在早期也呈长梭形,后期出现不规则多边形(图1)。
图1 第3代小鼠卵丘细胞的生长形态(100×)Fig.1 Growth pattern of mouse cumulus cells of the third generation (100×)
2.2 卵丘细胞中Atg5、Beclin1、LC3、Cav1和Cav2蛋白的分布
对小鼠卵丘细胞进行Atg5、Beclin1、LC3、Cav1和Cav2蛋白免疫荧光检测,结果显示,正常生长的小鼠卵丘细胞内Atg5、Beclin1、LC3、Cav1和Cav2蛋白均有表达,主要表达部位为细胞质(图2)。
2.3 IGF-1对小鼠卵丘细胞 Atg5、 Beclin1、 LC3、 Cav1和 Cav2基因表达的影响
研究结果显示(图3),与对照组相比,各处理组自噬相关基因Atg5mRNA的表达量均增大,当IGF-1质量浓度为150 ng/mL时,Atg5mRNA表达水平最高,与其他处理组差异显著;50和150 ng/mL IGF-1显著抑制Beclin1、LC3mRNA的表达,但100和200 ng/mL IGF-1对Beclin1、LC3mRNA的表达无显著影响;50和200 ng/mL IGF-1显著抑制胞吞基因Cav1和Cav2的表达;与50 ng/mL处理组相比,100和150 ng/mL处理组Cav1、Cav2mRNA的表达量有回升趋势。
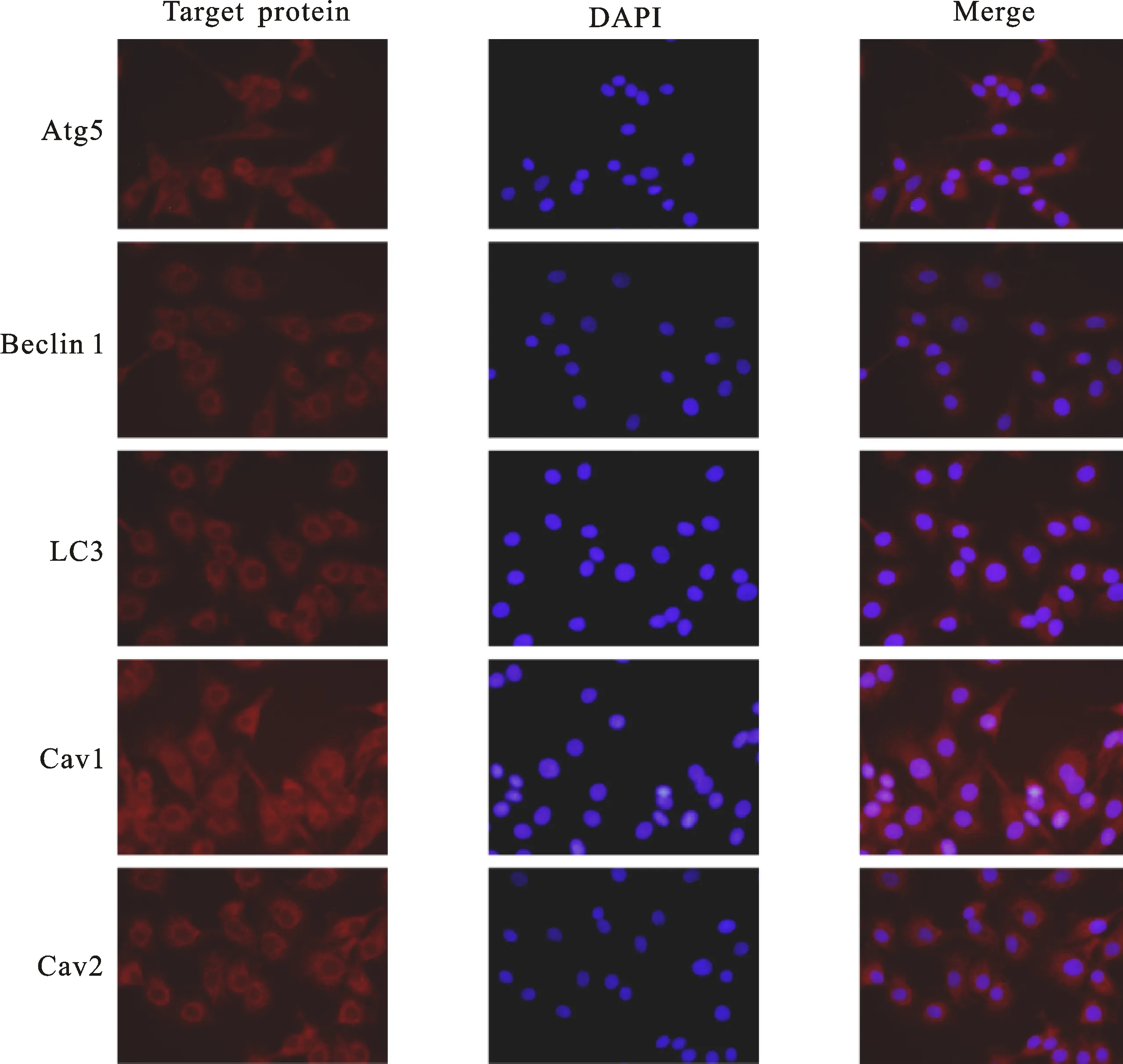
红色荧光为Atg5、Beclin1、LC3、Cav1和Cav2蛋白 Red fluorescence: Atg5,Beclin1,LC3,Cav1 and Cav2 protein respectively;蓝色荧光为细胞核 Blue fluorescence: cell nucleus
图2 细胞自噬与胞吞相关蛋白在小鼠卵丘细胞的定位
Fig.2 Localization of autophagy and endocytosis-associated proteins in cells of mouse cumulus
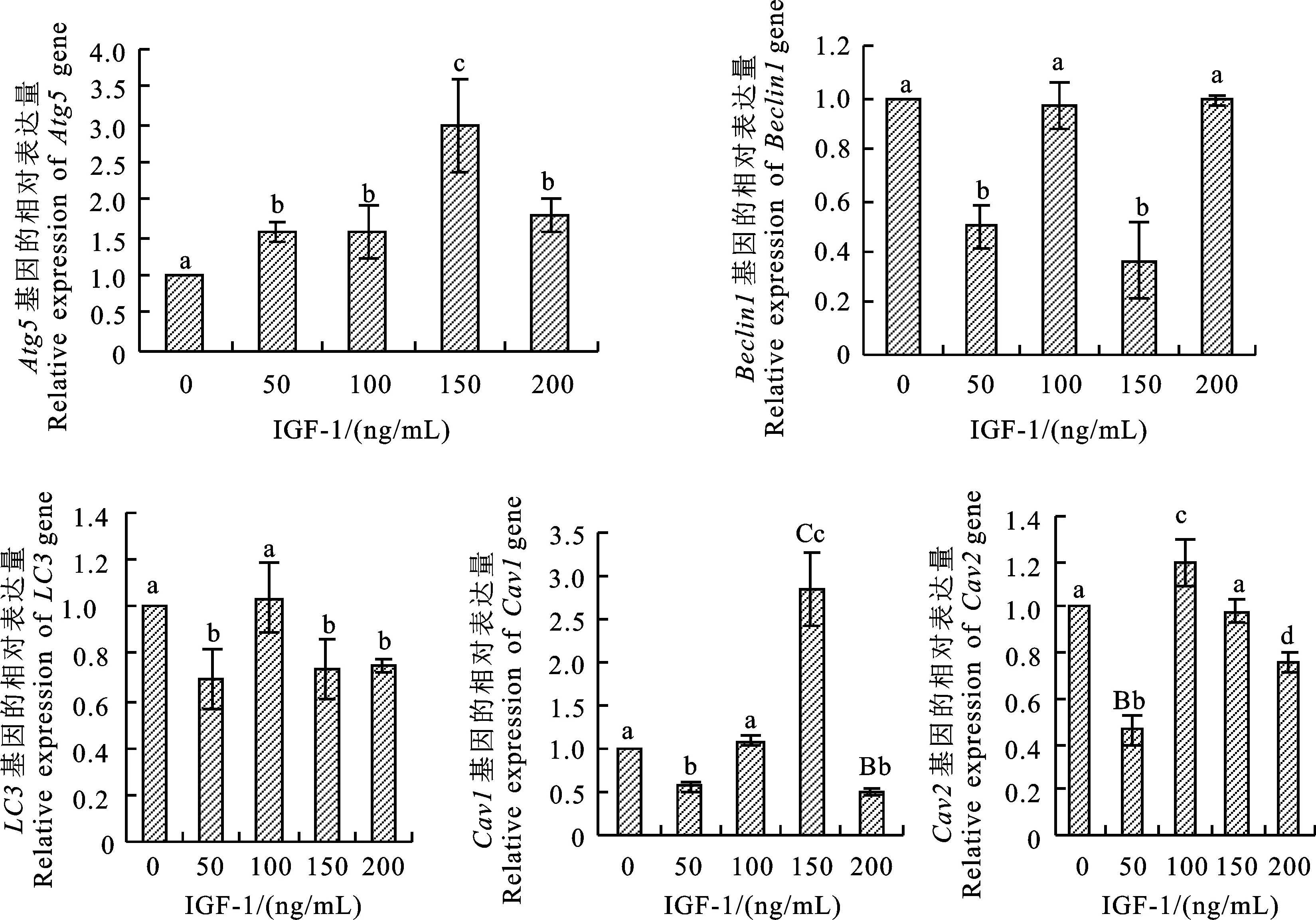
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同 Lowercase letters indicate significant differences(P<0.05),uppercase letters indicate significant differences (P<0.01),the same below
图3 IGF-1处理下小鼠卵丘细胞Atg5、Beclin1、LC3、Cav1和Cav2基因的表达量
Fig.3 Expression ofAtg5,Beclin1,LC3,Cav1andCav2genes in mouse cumulus cells under IGF-1 treatment
2.4 IGF-1对Atg5、Beclin1、LC3、Cav1和Cav2蛋白表达的影响
研究结果显示(图4,图5),与对照组 (0 ng/mL)相比,IGF-1刺激ATG5蛋白表达,抑制Beclin1和LC3表达,且在100 ng/mL时最低。此时LC3Ⅱ/LC3Ⅰ比值也最低,该比值是评估自噬水平高低的重要标志,比值越小说明细胞自噬水平越低。50和200 ng/mL IGF-1显著抑制Cav1和Cav2蛋白的表达;但与50 ng/mL处理组相比,100和150 ng/mL处理组Cav1和Cav2 蛋白的表达量有回升趋势,特别是Cav2蛋白在150 ng/mL作用下表达量显著高于对照组。
3 讨 论
本研究分别从基因水平和蛋白水平检测不同质量浓度IGF-1因子对小鼠卵丘细胞自噬和胞吞活动的影响。分析自噬相关的数据发现:在IGF-1作用下,自噬相关蛋白Beclin1和LC3Ⅱ的蛋白表达量显著降低,表明细胞内自噬水平降低。当IGF-1质量浓度为100 ng/mL时,LC3Ⅱ蛋白及LC3Ⅱ/LC3I均显著降低且降至最低,说明此时IGF-1对小鼠卵丘细胞自噬的抑制效果最好。Beclin1基因存在选择性剪接的现象[20],且Beclin1蛋白与Bcl-2蛋白为互作蛋白,常以复合体的形式存在[21]。有研究发现Beclin1还与Vps34结合形成蛋白复合体[22],在自噬体形成阶段发挥重要作用,这可能导致Beclin1基因与蛋白检测结果有差异,具体原因需进一步研究。在IGF-1各个处理组,Atg5 mRNA和蛋白的表达量均高于对照组(0 ng/mL),可能是由于IGF-1对于自噬起始阶段有一定的抑制作用,Atg5主要在自噬诱导阶段起作用,并与Atg12和Atg16蛋白形成复合体以促进自噬泡的延伸,IGF-1对细胞自噬的抑制作用可能导致自噬泡延伸过程受阻,Atg5蛋白在体内累积,由此出现表达量增大的现象。此时另外两种自噬相关蛋白Beclin1和Lc3的表达量均下降,证明自噬诱导阶段被抑制的可能性 极大。
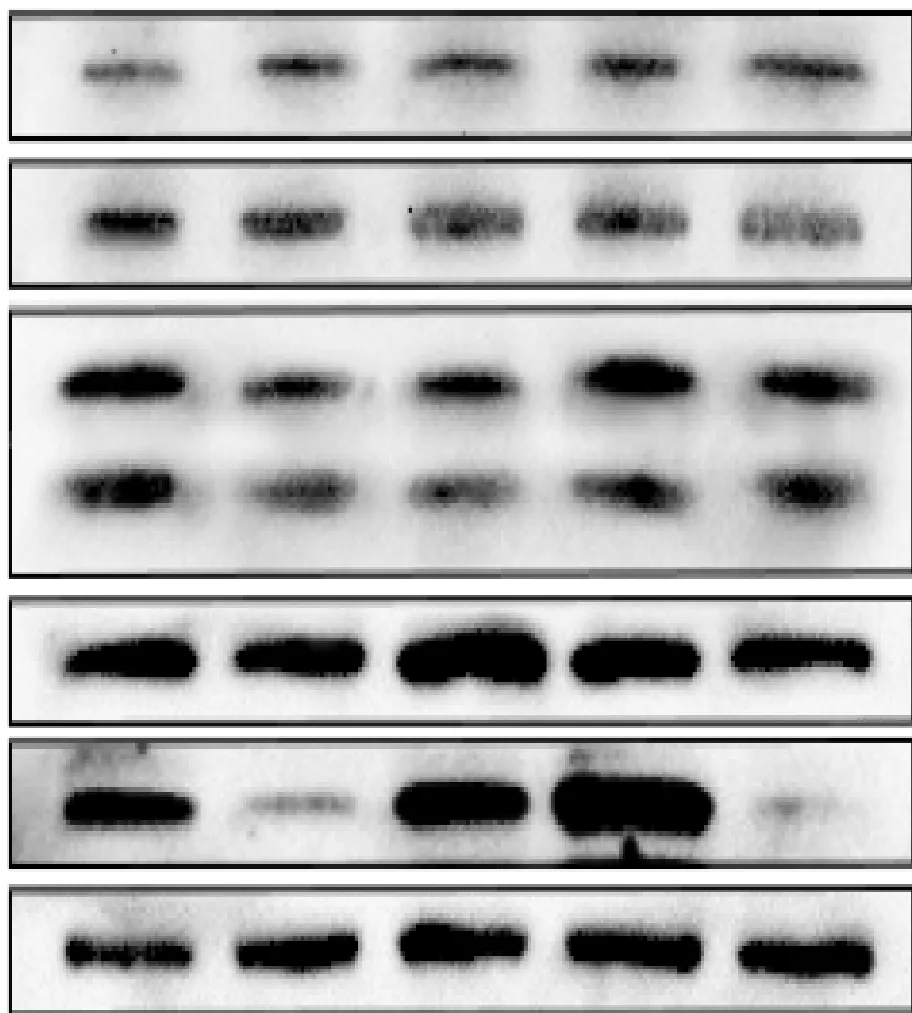
1~5.IGF-1质量浓度为0、50、100、150、200 ng/mL IGF-1 mass concentration is 50 ng/mL,100 ng/mL,150 ng/mL and 200 ng/mL
图4 Atg5、Beclin1、LC3、Cav1、Cav2和β-actin蛋白的表达
Fig.4 Expression of Atg5, Beclin1, LC3,Cav1, Cav2 and β-actin proteins
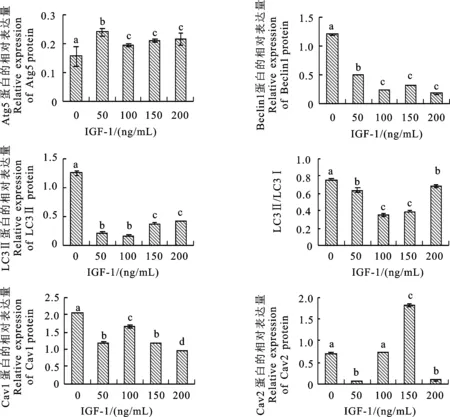
图5 Atg5、Beclin1、LC3、Cav1和Cav2蛋白的相对表达量及LC3Ⅱ/LC3IFig.5 Relative expression levels of Atg5, Beclin1, LC3, Cav1 and Cav2 proteins,LC3Ⅱ/LC3I
Cav在哺乳动物中广泛表达,但在不同组织中的表达量不同:Cav1在高分化的细胞中呈高表达,如脂肪细胞、内皮细胞、平滑肌细胞以及Ⅰ型肺泡上皮细胞,Cav2与Cav1通常共表达,且Cav2必须与 Cav1 结合形成低聚物才能定位至小窝,Cav2与胰岛素抵抗过程密切相关[23]。通过胞吞相关数据分析发现:IGF-1可调控Cav1和Cav2的表达,WB结果显示,与对照组(0 ng/mL)相比,IGF-1质量浓度为50 ng/mL和200 ng/mL时,Cav1和Cav2的表达均显著降低;但在100~150 ng/mL时,Cav1和Cav2的表达量表现出回升趋势。说明随着IGF-1质量浓度的增大,Cav1和Cav2蛋白的表达量变化趋势不是单一的上升或者下降,IGF-1对其表达的调控方式较为复杂,并不是简单的抑制或者促进作用。
前人研究结果表明,通常膜受体是在细胞膜上的脂筏和质膜微囊结构中介导跨膜信号的转导。在 3T3-L1 前脂肪细胞中发现,IGF-1受体定位于脂质筏和质膜微囊中,其信号转导依赖于细胞膜上完整的脂筏和质膜微囊结构,且 IGF-1 受体可以直接和Cav1相互作用[24-26]。脂筏和质膜微囊主要在受体激活下游信号分子的过程中起作用,而受体本身被配体激活的过程并不需要脂筏和质膜微囊的参与,这说明细胞膜上的IGF-1受体定位于脂质筏和质膜微囊中,使得受体和集聚在脂筏/质膜微囊的下游信号分子复合体相互靠近,并通过这些复合体进行信号的传递[27]。基于以上理论可看出,IGF-1作用于细胞后的确引起Cav1和Cav2蛋白表达的变化,进一步说明IGF-1因子在小鼠卵丘细胞的胞吞活动及营养物质运输过程中可能起重要调控作用,但其调节Cav1和Cav2蛋白的具体机制及作用方式尚不清楚,还需进一步研究。
自噬和胞吞作用强弱均和 IGF-1 质量浓度相关,说明IGF-1可调控小鼠卵丘细胞自噬及胞吞生理活动,但是小鼠卵丘细胞中自噬和胞吞之间的联系尚不清楚。已有研究表明Cav蛋白参与多种生理过程中的分子互作[28],并且发现在肺上皮细胞中Cav1可以通过与Atg-5和Atg-12形成的复合物作用而调节自噬[29],本研究发现,在IGF-1质量浓度为50~100 ng/mL时,Cav1和Cav2蛋白的表达水平均显著增加,Beclin1和LC3I的表达量及LC3Ⅱ/LC3I均显著增大,表明此质量浓度范围内IGF-1对自噬和胞吞调控呈正相关;但在IGF-1质量浓度为100~200 ng/mL时,Cav1蛋白的表达水平下降,LC3的表达上升,此质量浓度范围内,IGF-1对自噬和胞吞的调控呈负相关。Cav1有破坏Atg5和Atg12复合物的功能,从而抑制细胞自噬[30]。笔者发现在 100~150 ng/mL时,Cav1和Cav2的表达量表现出回升趋势,此时细胞自噬抑制效果最为明显,进一步表明细胞的自噬和胞吞存在一定关联,但其具体的作用机制仍需探索。
4 结 论
首次证实在小鼠卵丘细胞的体外培养时,IGF-1可调控Atg5、Beclin1、LC3、Cav1和Cav2的表达,进一步表明IGF-1参与动物细胞自噬与胞吞的调控,发现细胞自噬和胞吞强度与IGF-1因子的作用质量浓度有关,且自噬与胞吞之间具有一定联系。本研究对生长因子调控卵丘细胞的自噬与胞吞,及卵母细胞质量与发育能力等方面研究可资借鉴。
