微波法高效制备固定化胰蛋白酶
2019-10-28刘伟华姜子涛
刘伟华, 姜子涛, 李 荣
(天津商业大学 生物技术与食品科学学院/天津市食品生物技术重点实验室,天津300134)
胰蛋白酶是一种肽链内切酶,能水解由赖氨酸和精氨酸的羧基参与形成的肽链,被广泛地应用于轻工业及医疗行业。然而游离的胰蛋白酶稳定性较差,因此对游离的胰蛋白酶进行修饰,如采用固定化等方法来延长其使用寿命是十分必要的。
树脂是一类多聚物,具有一定的孔径和-COOH、-OH、≡N等功能基团,结构稳定,机械性能良好,可以作为固定化酶的载体[1-12]。
微波能使极性分子发生自旋运动而被加热,微波能提高反应的效率及产率。如微波提取[13]、微波合成[14]、微波酶解[15]、微波辅助固定化微生物[16],微波固定化肝素[17]以及微波固定化酶[18-25]等。值得一提的是,采用微波辅助制备的固定化酶稳定性较好,甚至酶活力也有所提高。可见,采用微波来制备固定化酶是可行的。
因此,通过从9种树脂中筛选出效果较好的D151树脂作为固定化胰蛋白酶的载体,采用吸附-微波辅助交联法,制备固定化胰蛋白酶。选用中心组合设计设计-响应面法(CCD-RSM)优化制备固定化胰蛋白酶的工艺,并对固定化胰蛋白酶的性质及应用做了相关研究。
1 材料与方法
1.1 材料与试剂
胰蛋白酶:上海阿拉丁生物科技股份有限公司产品;戊二醛和乙腈(色谱纯):天津市科密欧化学试剂有限公司产品; 树脂(D3520、D4020、H103、NKA-9、D301R、D380、D280、D061、D151): 天津南开合成科技有限公司产品;其余试剂均为分析纯。
1.2 仪器与设备
Multi SYNTH微波合成仪:意大利Milestone公司产品;Alpha-1500紫外可见分光光度计:上海谱元仪器有限公司产品;WE-1水浴恒温振荡器:天津市欧诺仪器仪表有限公司产品;1260高效液相色谱仪:美国Agilent公司产品;色谱柱Vydac-C18(250 mm×4.6 m,5 μm):Grace公司产品;DK-S12 电热恒温水浴锅:上海森信实验仪器有限公司产品。
1.3 实验方法
1.3.1 微波辅助固定化胰蛋白酶 准确称取0.5 g树脂,加入用缓冲溶液配制的胰蛋白酶溶液5 mL,在水浴恒温振荡器中吸附一定时间,然后加入一定浓度的戊二醛置于微波合成仪中,微波辅助交联胰蛋白酶。交联完成后用蒸馏水将残留的戊二醛清洗干净。
1.3.2 酶活力的测定 采用福林酚法[18]。在40℃、pH 8.0的条件下,1 min内水解酪蛋白产生1 μg酪氨酸所需的酶量为一个酶活力单位,以U表示。
1.3.3 单因素实验 准确称取0.5 g树脂,分别改变吸附时间、戊二醛质量分数、加酶量、pH、交联时间及交联温度等因素,制备固定化酶,并测定制备的固定化酶的活力。
1.3.4 响应面实验设计 在单因素实验的基础上,通过方差分析选取主要的影响因素并选用CCDRSM设计实验方案,响应面的因素编码及变量水平如表1所示。
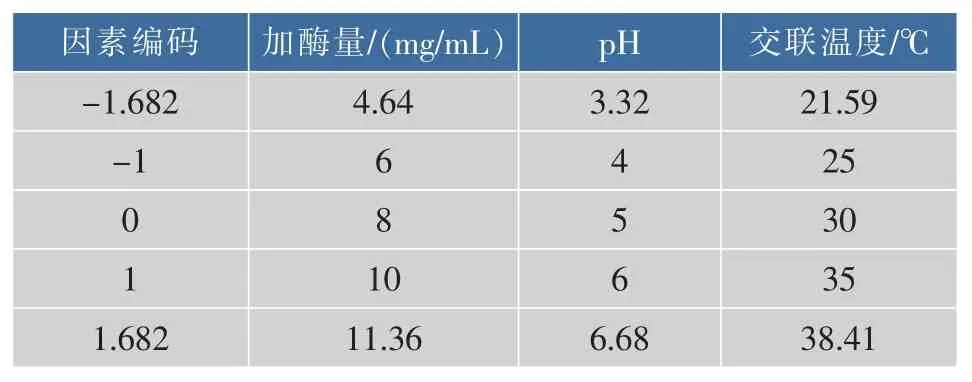
表1 响应面因素编码及水平Table1 Factors and levels of response surface design
1.3.5 固定化胰蛋白酶性质的研究
1)温度稳定性 将固定化胰蛋白酶分别在25、35、45、55、65℃不同温度的水浴中放置3 h后测定其酶活力。
2)酸碱稳定性 将固定化胰蛋白酶分别置于pH为4~10的缓冲液中在室温下放置3 h后测定固定化酶的活力。
3)重复使用性 按照1.3.2的方法,重复使用固定化胰蛋白酶,同时测定酶活力。每使用完一次将固定化酶分别用蒸馏水和缓冲液清洗干净,并将其置于新的底物中继续反应。
4)储藏稳定性 将固定化胰蛋白酶置于4℃冰箱密封保存,每一周测定固定化酶的活力。
1.3.6 固定化胰蛋白酶的应用 为了进一步比较固定化胰蛋白酶与游离胰蛋白酶在应用方面的差异,在50℃、固定化胰蛋白酶及游离胰蛋白酶各自适宜的pH条件下,水解底物质量分数为4%的酪蛋白溶液,然后将水解液分别冷冻干燥。之后用HPLC对水解产物进行分析。色谱条件为流动相:超纯水(A),乙腈(B);洗脱条件:0~5 min,体积分数 3%B;5~10 min, 体积分数 6%B;10~15 min, 体积分数10%B;15~25 min,体积分数 40%B。 流量:1 mL/min,进样量:20 μL,检测波长:275 nm。
1.3.7 水解度的测定 选用pH-State法,测定酪蛋白水解产物的水解度(DH),其公式为

式中,B为碱液体积 (mL);Nb为碱液的摩尔浓度(mol/L);α 为 α-氨基的离解常数;Mp为酷蛋白的质量(mg);Htot为每克酪蛋白中肽键的毫摩尔数(mmol/g)。
2 结果与分析
2.1 树脂载体的选择
向各树脂中加入等量的酶溶液,在恒温水浴振荡器中振荡2 h。通过测定上清液中的酶浓度计算吸附的酶量,并测定固定化酶的活力,不同树脂载体的固定化效果见表2。
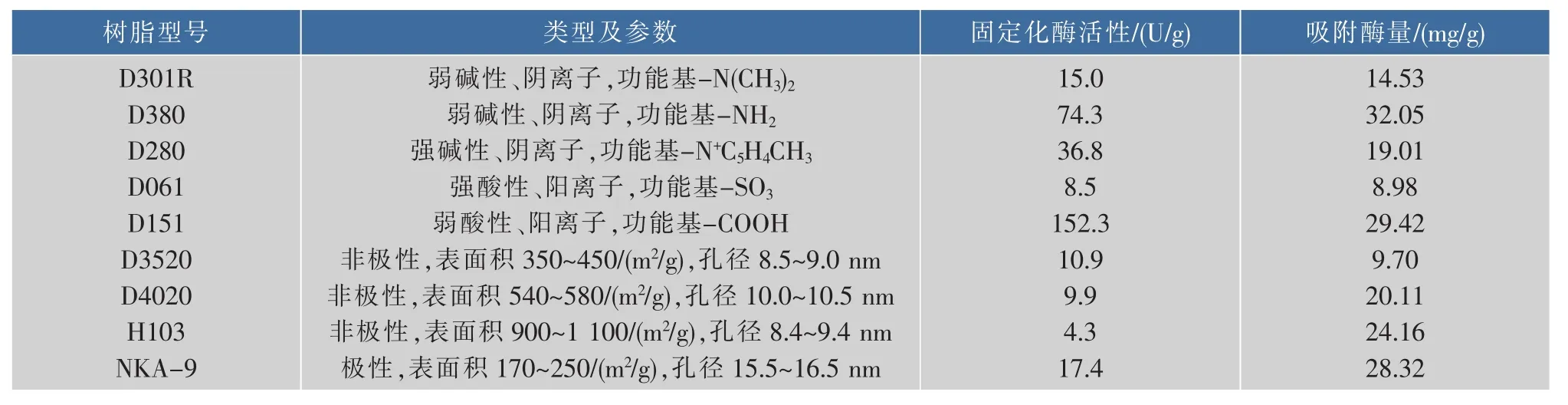
表2 不同树脂载体的固定化效果Table2 Immobilization results of different resins
由表可知,就吸附酶量来看,弱极性的大孔阴离子(D380)、大孔阳离子(D151)和大孔吸附树脂NKA-9效果较好。就单位固定化酶活性来看,D151的活性最高,而固定化吸附酶量较高的大孔吸附树脂(NKA-9)和弱极性的大孔阴离子(D380)固定化后酶活力却很低,这可能由于虽然大孔吸附树脂比表面积大、吸附能力强,由于过强的吸附可能使酶分子的空间构象发生变化导致酶的失活[26];或者由于固定化后,空间位阻会直接影响到活性中心对底物的定位作用。综合单位固定化酶活性及固定化率两个指标,D151可作为固定化胰蛋白酶的载体。
2.2 单因素实验
按照1.3.3的方法,研究各单因素条件对固定化酶活力的影响,以各自最高的酶活力为100%,不同条件下的相对酶活力结果见图1。
图1的实验结果表明,D151树脂吸附胰蛋白酶1.5 h后固定化酶的活力不再增加,因为过量吸附的胰蛋白酶致使空间位阻增大,阻碍其与底物的接触及产物的扩散,而使得酶活力下降。戊二醛质量分数为1.0%时,制备的固定化酶的活力最高,戊二醛质量分数低时,交联的酶量少,导致固定化酶在冲洗的过程中部分脱落,酶活低;当戊二醛质量分数过高时,吸附的酶被过度交联导致酶的空间构象被破坏,酶活力降低。随着加酶量的增大固定化酶的活力逐渐增加,当加酶量过多时,酶在载体表面的吸附达到饱和,部分酶会进入载体孔内部,无法与底物作用,加酶量为8.0 mg/mL的时候酶活力最高。固定化pH为5.0时酶活力最高,这是因为一方面,胰蛋白酶的等电点为10.8,在pH 5.0的环境中,胰蛋白酶带正电,与载体发生离子交换吸附,酶吸附的效果好;另一方面,环境的pH值直接影响酶分子的酸性、碱性氨基酸残基侧链基团的解离状态,影响酶与底物的亲和力。交联时间为3.5 min时固定化酶活力高。交联温度为30℃时酶活力高,温度过高会导致微波的功率过大,破坏酶的空间结构使酶的活力降低。
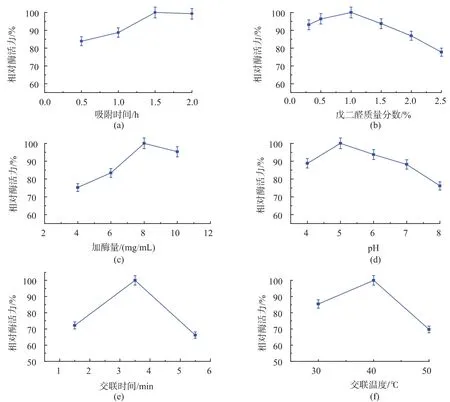
图1 吸附时间、戊二醛质量分数、加酶量、pH、交联时间及交联温度对酶活力的影响Fig.1 Effect of adsorption time,glutaraldehyde concentration,dosage of trypsin,pH,crosslinking time and crosslinking temperature on relative activity of immobilized trypsin
2.3 响应面实验
在单因素实验结果的基础上,选取对固定化酶的活力影响显著的3个因素加酶量、pH、交联温度作为主要的影响因素,采用CCD-RSM设计三因素五水平实验,响应面实验设计及结果见表3。

表3 响应面实验设计及结果Table3 Design and results of response surface design
2.4 二次回归方程拟合和方差分析
如表4所示,模型的P值<0.0001,而失拟项P值>0.05不显著,说明模型是可靠的。回归方程各项的方差分析结果表明,各因素对固定化酶活力的影响依次为:交联温度>加酶量>pH。交联温度是对回归模型影响最显著的因素,很可能是因为较高强度的微波振荡会破坏了酶的空间结构[18]。方程的一次项A和B的P值均小于0.01,一次项C的P值<0.0001,是极显著的;而交互项AB、AC、BC的P值均大于0.05,是不显著的。
加酶量、pH及交联温度3个因素两两交互影响固定化酶活力的三维空间曲面图见图2。由图2中曲面线的陡峭和平缓可以直观地看出各因素对固定化酶活力的影响程度,曲线越陡峭,则该因素对响应值的影响程度越大;而等高线的圆心处是极值所对应的条件。

表4 回归方程的方差分析Table4 Regression equation variance analysis

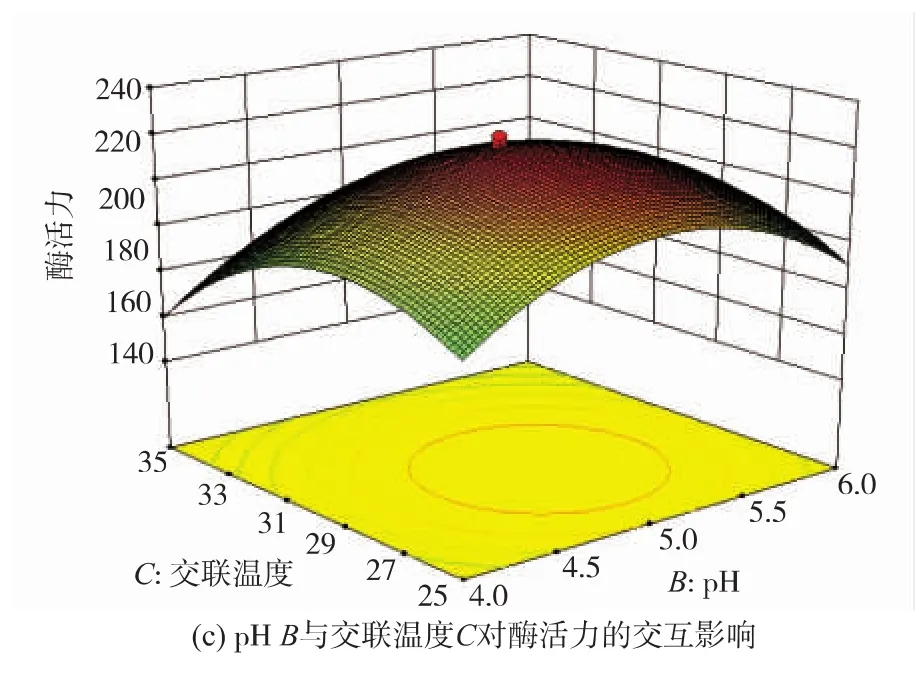
图2 两因素交互作用对酶活力影响的响应面图Fig.2 Response surface and contour plots showing the interaction of every two factors on immobilized trypsin activity
去除不显著的交互项AB、AC、BC,利用Design-Expert 8.0.5对实验结果进行拟合,以酶活力y为响应值,得到对自变量加酶量A、pHB和交联温度C3个因素的回归方程为:y=-2025.8564+114.8252A+310.9090B+68.3877C-7.0426A2-30.7336B2-1.1798C2。调整后的回归模型(P<0.0001)极显著;该模型R2=0.9945,RAdj2=0.9919,模型与试验拟合程度高,自变量与响应值之间的线性关系显著,可以用于不同变量条件下的响应值预测。失拟项P值由0.2648变为0.2223,因此去掉不显著的交互项可以使方程的拟合效果更好[27]。
2.5 最优条件验证实验
调整后的回归模型预测固定化酶的最佳工艺条件为:加酶量8.15 mg/mL、pH 5.05、交联温度29.00℃,在此条件下酶活力的预测值为219.98 U/g。考虑到实验的可操作性,修正最佳工艺条件为,加酶量8.2 mg/mL、pH 5.0、微波温度29.0℃。在此条件下进行3次平行验证实验,固定化胰蛋白酶的活力为221.5 U/g树脂,相对误差为0.69%,与预测值接近。
2.6 固定化酶的性质
2.6.1 温度稳定性 测定固定化胰蛋白酶在不同温度时的酶活力,结果见图3。
固定化酶在25~45℃的温度范围内较稳定,在65℃放置3 h后酶活力下降了一半多,其酶活力是35℃的46.5%。这可能是由于酶被固定化后其分子整体运动受限[28],抑制了自身构象的解折叠,同时减少了分子间相互作用的机会,从而热稳定性增加。

图3 固定化酶的温度稳定性Fig.3 Temperature stability of immobilized trypsin
2.6.2 酸碱稳定性 测定固定化胰蛋白酶在不同pH时的酶活力,结果见图4。
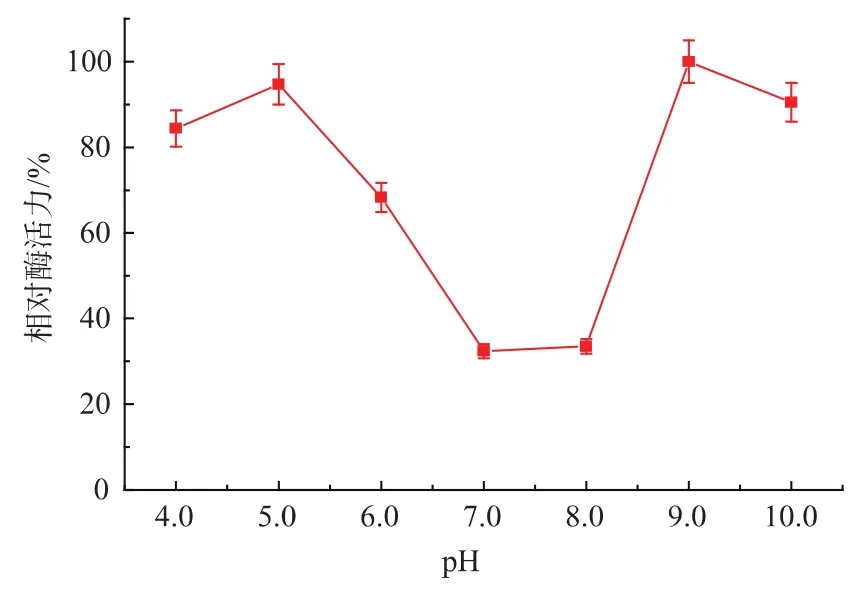
图4 固定化胰蛋白酶的酸碱稳定性Fig.4 pH stability of immobilized trypsin
固定化酶在pH 5.0左右的酸性条件下及pH 9.0~10.0范围内较为稳定。胰蛋白酶被固定化后其空间结构的改变使其与氢离子的作用与原来不同,所以固定化酶适合的pH发生了改变。
2.6.3 重复使用性 以第一次使用后的酶活力为100%,换算出不同使用次数后固定化酶的相对酶活力,结果如图5所示。

图5 固定化胰蛋白酶的重复使用性Fig.5 Reusability of immobilized trypsin
每次反应结束之后用蒸馏水清洗的固定化酶随着使用次数的增加,酶活力迅速下降。每次反应结束后用缓冲溶液清洗的固定化酶具有较好的重复使用性,酶活力下降迟缓。缓冲液有利于固定化酶活力的保存的结果表明,固定化酶所处环境的离子状态对固定化酶空间结构的维持具有重要作用。
2.6.4 储藏稳定性 测定储藏不同时间后的固定化酶的活力,结果如图6所示。
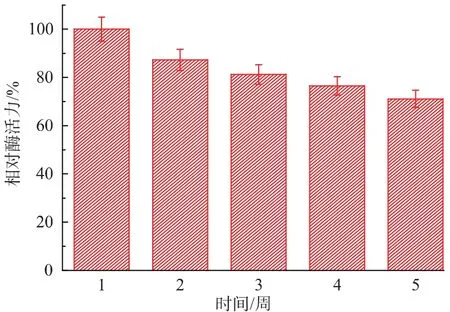
图6 固定化胰蛋白酶的储藏稳定性Fig.6 Storage stability of immobilized trypsin
固定化胰蛋白酶储藏一周后发生较大幅度的活力下降,第二周的酶活力是初始酶活力的87.3%,随后几周酶活力降低较少,储藏5周后酶活力仍保留了初始酶活力的71.1%。
2.7 固定化胰蛋白酶的应用
在50℃、固定化胰蛋白酶在pH 9.0,游离胰蛋白酶在pH 8.0的条件下,酶解底物质量分数为4%的酪蛋白溶液。将水解液分别冷冻干燥后进行HPLC分析,如图7所示。
加入相同酶活力的两种酶水解酪蛋白后,固定化胰蛋白酶水解产物及游离胰蛋白酶水解产物的水解度分别为14.8%和9.6%。从液相色谱图中可以看出,固定化胰蛋白酶水解产物与游离胰蛋白酶水解产物总体上差别不大,但在保留时间为3.2 min(峰 2)、20.1 min(峰 3)及 26.8 min(峰 5)处的峰响应值明显大于游离胰蛋白酶水解产物,且在保留时间为12.9、16.1、34.5 min处还存在一些游离胰蛋白酶水解产物中没有的小峰;而游离胰蛋白酶水解产物在 2.3 min(峰 1)、26.0 min(峰 4)处吸收峰的响应值大于固定化胰蛋白酶水解产物。这可能是由于胰蛋白酶被固定化后其与底物的亲和力发生了变化,所以固定化胰蛋白酶水解产物与游离胰蛋白酶水解产物略有不同,不过在水解度方面明显优于游离胰蛋白酶。

图7 酪蛋白及其水解产物的液相色谱图Fig.7 HPLC chromatograms of casein and its hydrolysates
3 结语
在微波辅助的条件下,以D151树脂为固定化载体制备出固定化胰蛋白酶。通过单因素实验和CCD-RSM优化确定了微波辅助固定化胰蛋白酶的最佳条件:吸附时间1.5 h、戊二醛质量分数1.0%、加酶量8.2 mg/mL、pH 5.0、交联温度29℃以及交联时间3.5 min。整个制备过程大约仅需要2 h,制备的固定化胰蛋白酶的温度及pH使用范围较游离酶更广;使用缓冲液冲洗固定化胰蛋白酶可以重复使用多次,并能保留大部分的酶活力;储藏5周后酶活力仍保留了初始酶活力的71.1%。通过比较固定化胰蛋白酶和游离胰蛋白酶水解酪蛋白的效果,发现固定化胰蛋白酶水解效率更高且产物种类更丰富。
目前,已经有研究将醛缩酶[18]、青霉素酰化酶[20]、漆酶[24]等用来微波固定化,其结果表明,在固定化时间大大减少的同时能够保持酶的优异的催化性能;而微波固定化的嗜热菌蛋白酶催化活性甚至有所提高[23],表明微波固定化酶的方法是可取的。
