组蛋白去甲基化酶LSD1对直肠癌CACO-2细胞侵袭能力的研究
2019-10-27侯高超刘现立刘怡文顾晨文
侯高超 刘现立 刘怡文 原 翔 顾晨文
直肠癌是人类消化系统最常见的恶性肿瘤之一,近年来其发生率和病死率呈逐年上升趋势[1,2]。赖氨酸特异性组蛋白去甲基化酶1(lysine-specific demethylase 1,LSD1)也被称作KDM1、AOF2、KIAA0601、BCH110、CPRF等,由3个结构域组成,即胺氧化酶结构域、FAD结合结构域和SWIRM结构域。目前研究发现LSD1与多种肿瘤细胞的发生、发展关系密切[3,4],但是关于LSD1对直肠癌干细胞的影响国内外尚未见报道。本研究前期实验已证实,LSD1在直肠癌组织中表达显著高于其相应癌旁组织,然而 LSD1在直肠癌肿瘤干细胞(CSCs)表型及恶性生物学行为中是否发挥重要调控作用尚不明确。因此,本课题旨在通过研究LSD1对直肠癌CACO-2细胞侵袭能力的影响,为后续研究奠定基础,为直肠癌靶向治疗提供潜在的分子靶点。
材料与方法
1.细胞与主要试剂:人直肠癌细胞系CACO-2购自中国科学院细胞库,LSD1抗兔单克隆抗体购自英国Abcam公司,GAPDH 抗兔多克隆抗体购自北京康为世纪生物科技有限公司,DMSO购自美国Gibco公司,BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,DAB显色试剂盒购自索莱宝公司,MEM培养基购自美国Hyclone公司,胎牛血清购自美国Gibco公司。
2.细胞培养:CACO-2的培养液为20%胎牛血清,青霉素(100U/ml)和链霉素(100μg/ml)的 MEM 培养液均购自美国 Gibco公司,并置于 37℃、CO2体积分数为 5%的饱和湿度下进行培养。
3.建立稳定敲降LSD1的直肠癌细胞系:实验分为两组,即荧光对照组及LSD1敲降组。常规培养293T细胞,密度至50%~60%时,开始转染。配制“DNA质粒-EndoFectin”混合物,转染293T细胞,收集病毒。目的细胞铺板,转染目的细胞。目的细胞转染病毒后,需每天在荧光显微镜下观察荧光信号。待视野中大部分细胞都带有荧光时,开始用嘌呤霉素或潮霉素(根据说明书中抗性决定)对目的细胞进行筛选。
4.LSD1蛋白的Western blot法检测:取对数生长期的细胞,加入适量蛋白裂解液(美国Invitrogen公司),离心后取上清为蛋白提取物,BCA法进行蛋白定量。用12%SDS-聚丙酰胺凝胶进行蛋白电泳及转膜,脱脂奶粉封闭PVDF膜(美国密理博公司)1h,加LSD1抗兔单克隆抗体(稀释度1∶1000,美国CST公司)或内参GAPDH抗兔多克隆抗体(稀释度1∶2000,北京康为世纪生物科技有限公司)4℃过夜,以HRP标记山羊抗兔IgG抗体室温孵育2h,使用显影剂处理PVDF膜后用凝胶成像系统(美国Bio-Rad公司)检测目的蛋白条带,应用ImageLab软件对蛋白条带灰度值进行测定,并以目的蛋白与内参蛋白条带灰度值比值进行定量分析,实验重复3次,每次设置3个复孔取平均值。
5.LSD1mRNA的Q-PCR法检测:取对数生长期的细胞,Trizol法提取mRNA,将提好的mRNA直接反转录,或于-80℃冰箱保存,检测mRNA浓度和质量,反转录(cDNA合成),根据人的LSD1 cDNA序列设计PCR引物,将干粉引物4℃,12000r/min离心3min,稀释引物终浓度为0.3μmol/L可以在大多数体系中获得良好扩增效果,配制实时荧光定量Q-PCR反应体系,实时荧光定量Q-PCR,结果分析,设定合适的荧光强度阈值,将每孔样品对应的Ct值导入Bio-Rad公司开发的Gene Expression Analysis软件,各样本的目的基因扩增量与GAPDH基因扩增量的比较采用2-ΔΔCt法进行,实验重复3次,每次设置3个复孔取平均值。
6.细胞成球实验:取对数生长期的细胞,将细胞消化并制成单细胞悬液,以1×105个/毫升接种于无血清培养基中进行悬浮培养,克隆形成,终止培养,计数肉眼可见的克隆数,可采用t检验,分析各组之间差异,以P<0.05为差异有统计学意义。实验重复3次,每次设置3个复孔取平均值。
7.Aldefluor实验:取对数生长期的目的细胞(每组细胞数为106个),每组各加入100μl PBS,根据CD133-PE试剂说明,再加入10μl CD133-PE(11∶1),4℃避光反应15min,PBS洗涤后离心(1000r/min)1次,用PBS调整细胞浓度为106个/毫升,每个Ep管共500μl细胞悬液,对照组为同样方法处理的不加CD133-PE的细胞悬液,各组细胞用流式细胞仪分别进行检测。实验重复3次,每次设置3个复孔取平均值。
8.Tanswell实验: 取对数生长期细胞,用无血清培养基重悬后调整细胞密度,然后将细胞悬液于小室中。实验分为对照组、转染组和抑制剂组,培养12~48h后,擦去上室内细胞,4%甲醛室温固定1~2h,4g/L结晶紫染液,倒置显微镜下拍照计数,各组均选10个视野,于倒置相差显微镜下观察、计数并照相。实验重复3次,每次设置3个复孔取平均值。
9.统计学方法:运用SPSS 23.0统计学软件对数据进行统计分析。采用配对样本t检验对各组间LSD1蛋白表达、mRNA表达、干细胞比例及侵袭能力进行统计分析,以P<0.05为差异有统计学意义。
结 果
1.建立直肠癌CACO-2-LSD1敲降稳定细胞系:为验证LSD1在直肠癌干性维持的调控作用,通过慢病毒载体包装建立CACO-2-LSD1敲降稳定细胞系(携带绿色荧光)和1株GFP荧光对照细胞系(图1)。
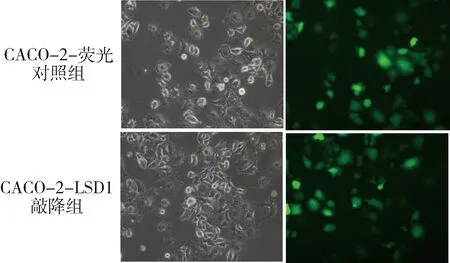
图1 建立直肠癌CACO-2-LSD1敲降稳定细胞系(荧光染色,×200)
2.Western blot法检测LSD1蛋白敲降效率:将构建出的CACO-2-LSD1敲降稳定细胞系进行Western blot法实验,检测LSD1蛋白的表达水平,通过Image J软件对蛋白电泳条带灰度值进行定量分析,敲降组的LSD1蛋白表达显著受到抑制(t=37.00,P=0.001),差异有统计学意义(图2)。
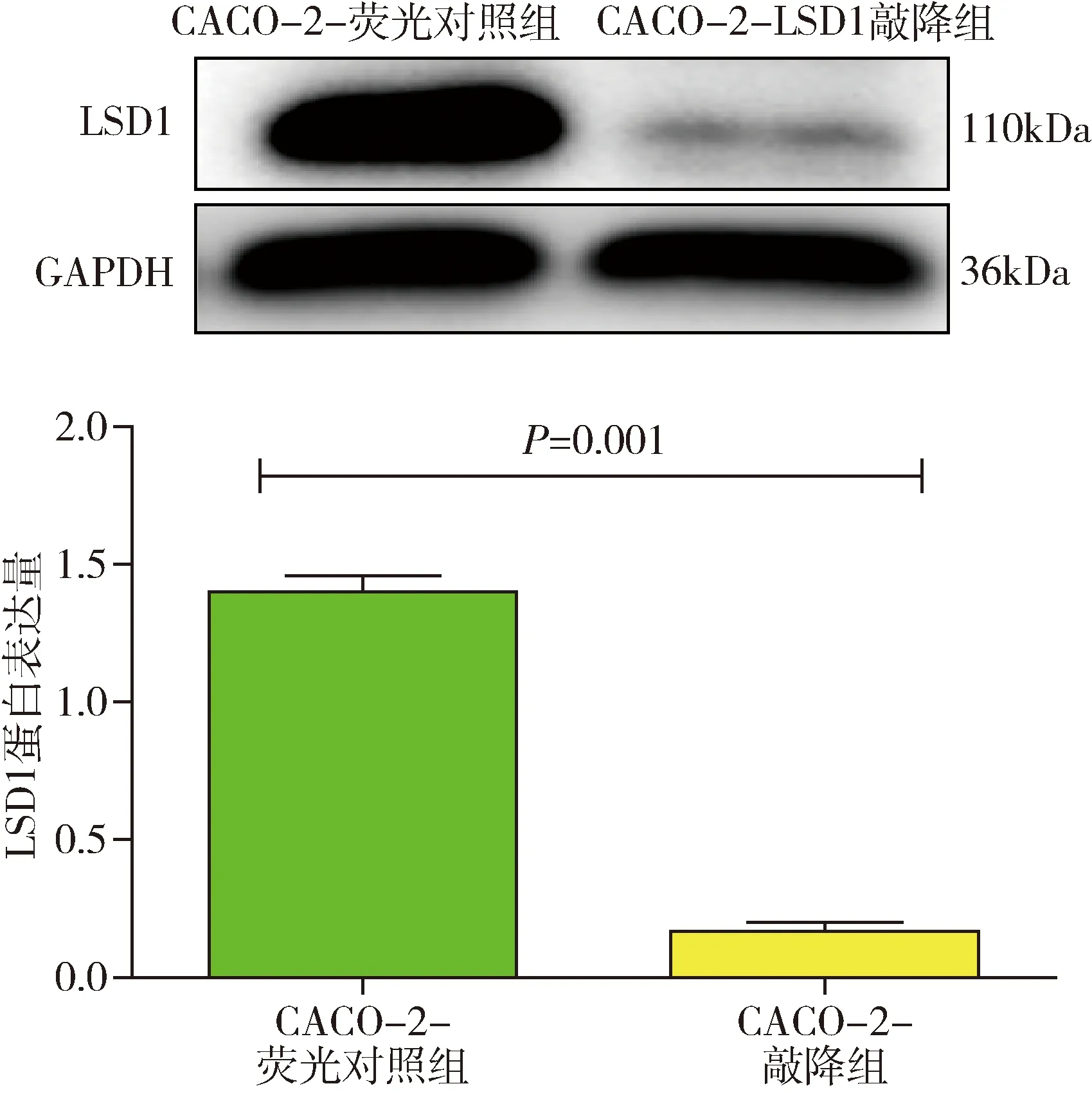
图2 Western blot法检测LSD1蛋白敲降效率
3.Q-PCR 检测LSD1 mRNA敲降效率:将构建CACO-2-LSD1敲降稳定细胞系进行Q-PCR实验,检测LSD1 mRNA表达水平,并对mRNA进行定量分析,从检测中发现CACO-2-LSD1敲降组的LSD1mRNA表达量较荧光对照组显著降低(t=13.00,P=0.006),差异有统计学意义(图3)。
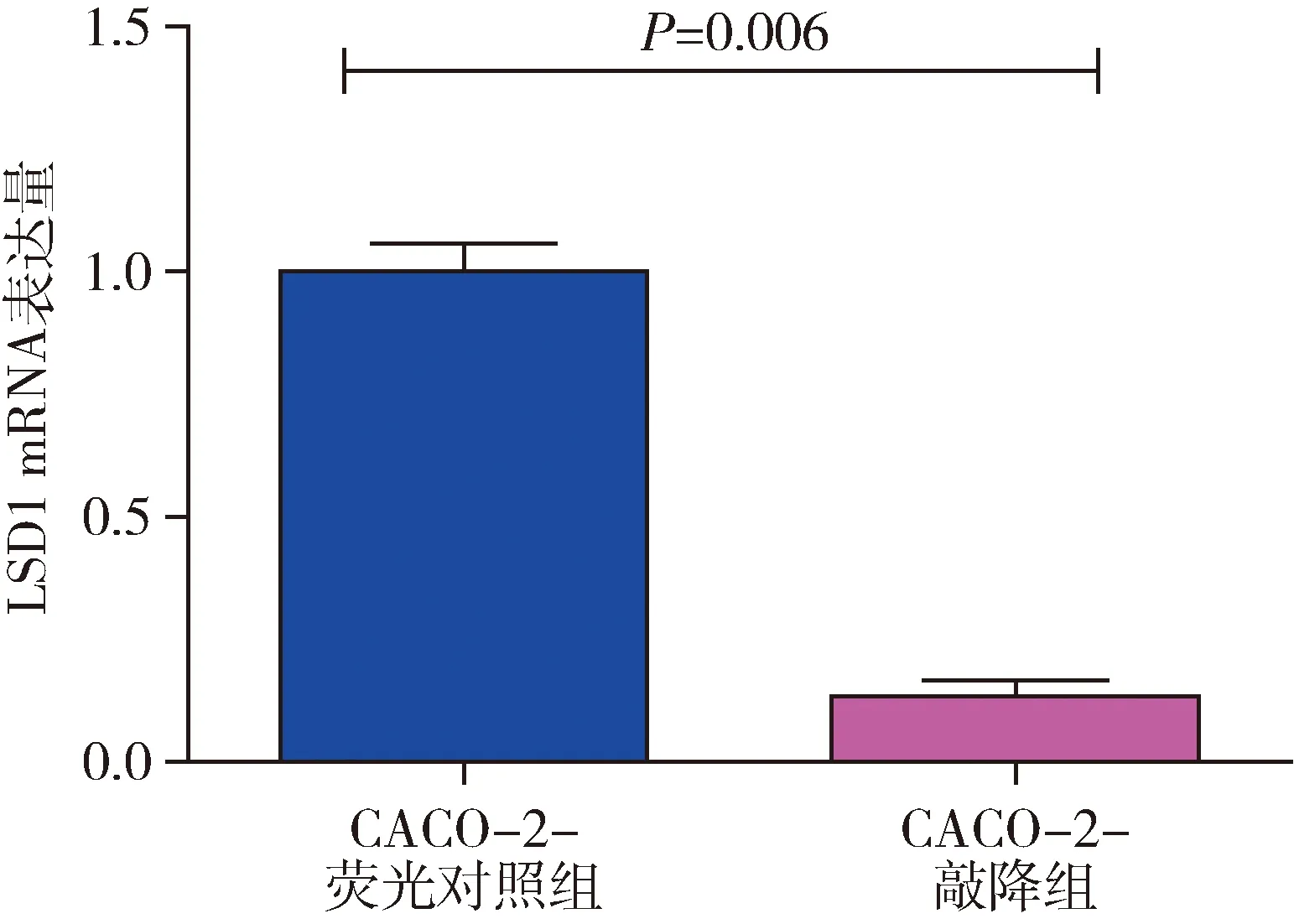
图3 Q-PCR 检测LSD1 mRNA敲降效率
4.细胞成球实验结果:通过细胞成球实验检测LSD1对直肠癌CACO2克隆成球能力的影响。发现CACO-2-LSD1敲降组(t=19.00,P=0.003)与CACO-2-LSD1抑制剂-RN1组 (t=37.00,P=0.001)克隆成球能力显著低于荧光对照组,差异有统计学意义(图4)。
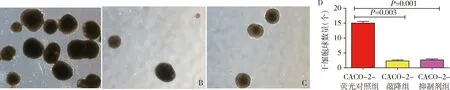
图4 LSD1对直肠癌CACO-2克隆成球能力的影响(荧光染色,×200)A.CACO-2-荧光对照组;B.CACO-2-LSD1抑制剂组;C.CACO-2-LSD1敲降组;D.LSD1对直肠癌CACO-2克隆成球能力的对比柱状图
5.Aldeflour实验结果:采用Aldeflour实验进一步检测LSD1对直肠癌细胞CACO-2干细胞的影响,发现CACO-2-LSD1敲降组 (t=38.50,P=0.001)与CACO-2-LSD1抑制剂-RN1组 (t=18.03,P=0.003)干细胞比例显著低于荧光对照组,差异有统计学意义(图5)。
6.Tanswell细胞体外侵袭实验结果:采用Transwell实验检测LSD1对直肠癌细胞系CACO-2侵袭能力的影响(24h)。CACO-2细胞转染24h后,消化、重新悬浮后进行Transwell迁移实验,并对穿过膜的细胞进行计数,发现CACO-2-LSD1敲降组 (t=30.43,P=0.001)与CACO-2-LSD1抑制剂-RN1组(t=35.50,P=0.001)体外侵袭能力显著低于荧光对照组,差异有统计学意义(图6)。
讨 论
组蛋白去甲基化酶 LSD1能够特异性催化赖氨酸去甲基,通过多种途径参与调控基因的表达,在大部分肿瘤形成的过程中起着促进作用,研究表明,LSD1与许多肿瘤的发生、发展密切相关,不同肿瘤细胞的LSD1表达明显差异,发挥的作用也不同[5]。
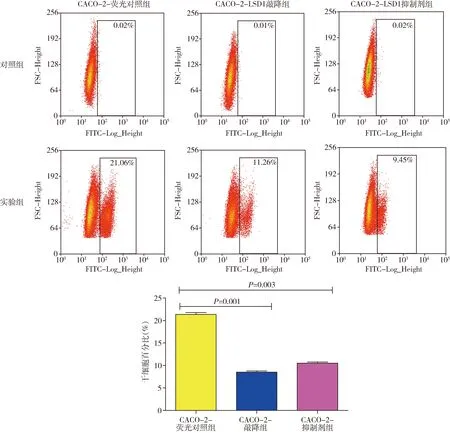
图5 SD1对直肠癌CACO-2干细胞的影响

图6 LSD1对直肠癌细胞系CACO-2侵袭能力的影响(荧光染色,×200)A.CACO-2-荧光对照组;B.CACO-2-LSD1敲降组;C.CACO-2-LSD1抑制剂-RN1组;D.LSD1对直肠癌细胞系CACO-2侵袭能力的对比柱状图
LSD1在肿瘤干细胞(CSCs)/胚胎干细胞(ESCs)、神经干细胞(NSCs)及诱导多能干细胞(iPS)自我更新和多潜能性维持中皆扮演着重要的角色[6~10]。大量研究均已证实,LSD1在白血病、胶质母细胞瘤、小细胞肺癌、人类诱导多能干细胞、膀胱癌干细胞、造血干细胞等疾病的发生、发展过程中起着重要作用[3,11,12]。
研究显示,通过瞬时转染结肠癌LoVo细胞,LSD1 shRNA可使LSD1的表达下降,同时细胞迁移实验证实,LoVo细胞穿过膜的数量也明显减少,这说明抑制LSD1的表达可以抑制结肠癌细胞的迁移和侵袭能力,提示LSD1的高表达可能与结肠癌的转移侵袭能力存在密切联系。还有通过LSD1抑制剂抑制LSD1活性并下调胃癌细胞中LSD1蛋白的表达水平,可抑制胃癌细胞的浸润及转移。Kashyap等研究发现LSD1在前列腺癌中表达升高,并证明LSD1的过表达可促进促血管生成通路的活性升高。除上述研究外,随着对LSD1研究的深入,越来越多的研究报道了LSD1在多种肿瘤中存在高表达,并调控肿瘤的发生、发展。然而,目前关于直肠癌肿瘤干细胞的研究尚未见类似报道,本课题组前期实验已证实,LSD1蛋白表达主要位于直肠腺癌细胞胞核,且随着分化程度的降低染色强度逐渐加强;LSD1蛋白表达阳性患者生存期显著低于阴性患者。
肿瘤干细胞(cancer stem cells, CSCs)是一类存在于肿瘤中的,具有高度自我更新和异常分化潜能的细胞亚群。CSCs具有很多特殊表型,如抗凋亡因子的异常表达,含有多种药物泵分子,DNA自我修复能力较高,对抗外界毒素的能力。CSCs的这些特性很可能与肿瘤目前的耐受性有关。CSCs在化疗后存活下来,为复发埋下隐患。有效地减少肿瘤中的CSCs,可以减少耐受性的存在,并且成为降低复发率、抵抗耐药、改善预后的关键突破口。以胚胎干细胞(ESCs)和神经干细胞(NSCs)为模型,近年来干细胞的定向分化和自我维持的表观遗传调控已成为研究热点[13]。以表观遗传学为基础的新方案得到更多人的关注。表观遗传药与传统化疗药物相结合,有望成为缓解化疗耐药的新途径。目前在美国已有DNA甲基转移酶抑制剂和组蛋白去乙酰化酶抑制剂上市,并且用于肿瘤的治疗。
本研究通过构建LSD1敲降的直肠癌CACO-2稳定细胞系,经Western blot法及Q-PCR法验证LSD1蛋白表达mRNA表达均显著受到抑制;经克隆成球与流式细胞术(Aldefluor)显示抑制LSD1蛋白可显著减少CACO-2干细胞比例,差异有统计学意义(P<0.05); 经Transwell显示抑制LSD1蛋白可显著抑制CACO-2侵袭能力,差异有统计学意义(P<0.05)。
综上所述,本研究证实抑制LSD1蛋白表达可显著降低直肠癌CACO-2细胞系体外侵袭能力,抑制LSD1可能是直肠癌靶向治疗的潜在分子靶点之一。同时本研究为进一步设计和合成新型LSD1家族组蛋白去甲基化酶抑制剂的研发提供了有意义的实验参考,为寻求新的直肠癌治疗策略提供依据。
