基于响应曲面法优化桑黄黄酮发酵条件
2019-10-25谢春芹曹正王春野
谢春芹 曹正 王春野


摘要:桑黄是一种珍贵的药用真菌,通过响应面分析法对桑黄的发酵培养基进行优化,进而提高该菌株黄酮类活性物质的产量。利用不同碳源、不同氮源对桑黄进行液体发酵,测定胞内黄酮产量,筛选出最佳种类的碳源和氮源。進一步通过单因素试验考察不同浓度碳、氮源及培养基初始pH值对胞内黄酮产量的影响。利用响应面分析法对桑黄黄酮发酵培养基进行优化,获得黄酮产量最高的培养基组合。结果表明,桑黄产黄酮的最佳碳源是麦芽糖,最佳氮源是酵母提取物。优化后黄酮发酵培养基中的麦芽糖浓度为46.5 g/L,酵母提取物浓度为6.0 g/L,培养基初始pH值为 4.32,优化后培养基黄酮产量达到(65.3±2.5) mg/L。获得了桑黄黄酮发酵的最佳培养基,为进一步研究桑黄黄酮生物合成调控以及提高桑黄黄酮含量奠定了基础。
关键词:桑黄;黄酮;响应面分析法;发酵培养基
中图分类号: S188+.4 文献标志码: A 文章编号:1002-1302(2019)13-0222-04
桑黄(Phellinus linteus)是一种极名贵的药用真菌,在我国和韩国有着悠久的应用历史[1-2]。近年来,国内外对桑黄的活性成分进行了深入研究,其主要活性成分包括黄酮类、多糖类化合物等[3-4]。这些活性成分具有抗氧化、抗病毒、抑制胃癌细胞增殖、调节免疫等多种活性[5-7]。虽然桑黄活性成分具有多种药理学活性,但其活性成分含量较低;因此,改良桑黄药用品质,提高其活性成分含量,成为当前桑黄研究的主要目标[8]。目前,作为桑黄主要药用成分的黄酮类化合物引起了较多关注。Ma等研究发现,萘乙酸(naphthaleneacetic acid)和香豆素(coumarin)能促进桑黄黄酮类化合物的生物合成[9]。Lung等研究不同提取工艺对桑黄活性提取物抗氧化能力及黄酮含量的影响[10]。然而,现阶段使用的培养基发酵获得的桑黄中的黄酮类化合物含量较低。为了提高桑黄中黄酮类化合物的含量,本研究对桑黄基础发酵培养基进行优化,为深入研究桑黄黄酮类化合物生物合成调控提供理论基础。
1 材料与方法
1.1 菌株和培养条件
桑黄菌株由笔者所在实验室保存于PDA培养基斜面上。在PDB培养基中进行桑黄菌丝体接种,在摇床上于 150 r/min、25 ℃恒温培养7 d作为液体母种。基础发酵培养基组分:葡萄糖20.0 g/L,酵母提取物1.0 g/L,蛋白胨 1.0 g/L,KH2PO4 0.1 g/L,MgSO4·7H2O 0.5 g/L,初始pH值5.5。接种量5%,于25 ℃恒温培养14 d。
1.2 黄酮测定方法
精确称取0.05 g菌丝粉末,加入5 mL 70%乙醇,放入超声清洗机中超声1 h获得萃取液。取1 mL提取液,用 NaNO2-Al(NO3)3比色法测定黄酮含量。以芸香苷标准品制作标准曲线,计算桑黄中的黄酮含量。提前0.5 h打开分光光度计调至510 nm预热,以未添加芸香苷标准液的标准曲线管为调零管进行调零,测定各管吸光度,绘制标准曲线,计算各管中黄酮含量[9]。
1.3 培养基优化单因素试验
1.3.1 针对碳源优化培养基 选取葡萄糖、乳糖、麦芽糖、可溶性淀粉和玉米粉各20 g分别作为碳源替换基础培养基中的葡萄糖,其他成分不变,接种量为5%,25 ℃恒温培养14 d后测定黄酮含量以确定最佳碳源。在此基础上,通过改变培养基中最佳碳源浓度再次发酵,确定最佳碳源的适合浓度。
1.3.2 针对氮源优化培养基 选取酵母提取物、蛋白胨、天冬酰胺、尿素和硫酸铵各2 g分别作为氮源替换基础培养基中的酵母提取物和蛋白胨,其他成分不变,发酵后测定黄酮含量以确定最佳氮源。在此基础上,通过改变培养基中最佳氮源的浓度再次发酵,确定最佳碳源的最适浓度。
1.3.3 针对不同初始pH值优化培养基 将基础培养基的初始pH值分别调节为3.5、4.5、5.5、6.5和7.5,其他条件不变,发酵后测定黄酮含量以确定最佳初始pH值。
1.4 响应面分析法优化培养基
基于单因素筛选的碳源、氮源以及初始pH值的试验结果,利用Design-Expert软件,以Central Composite Design 3因子设计试验方案(表1),进行发酵后以桑黄黄酮类化合物含量作为优化指标,进行条件优化。获得最佳培养基条件后,按最佳条件进行发酵试验验证。
2 结果与分析
2.1 碳源对桑黄黄酮类化合物产量的影响
由图1-A可见葡萄糖、乳糖、麦芽糖、可溶性淀粉和玉米粉等不同碳源对桑黄黄酮类化合物产量的影响。发现以麦芽糖作为碳源,桑黄黄酮类化合物产量最高,达到51.64 mg/L,是葡萄糖组的136.7%。除此之外,其他碳源发酵组黄酮产量都小于葡萄糖组。在此基础上,笔者选择麦芽糖作为最佳碳源,通过不同浓度麦芽糖进行发酵,测定桑黄黄酮类化合物产量,详见图1-B,可见不同浓度麦芽糖对桑黄黄酮类化合物产量影响较大。20 g/L的麦芽糖处理下桑黄黄酮类化合物产量最大,达65.87 mg/L。
2.2 氮源对桑黄黄酮类化合物产量的影响
不同氮源对桑黄黄酮类化合物产量的影响见图2-A。以酵母提取物作为氮源时,桑黄黄酮类化合物产量最高,达 56.45 mg/L。以硝酸铵作为氮源时,桑黄生长较差,黄酮类化合物产量最低,仅为5.22 mg/L。在此基础上,笔者选择酵母提取物作为最佳氮源,通过不同浓度蛋白胨进行发酵,测定桑黄黄酮类化合物产量,由图2-B可知,不同浓度酵母提取物对桑黄黄酮类化合物产量影响较大。4 g/L酵母提取物处理下,桑黄黄酮类化合物产量最大,达57.45 mg/L。而酵母提取物浓度大于6 g/L时,桑黄黄酮类化合物产量显著下降。
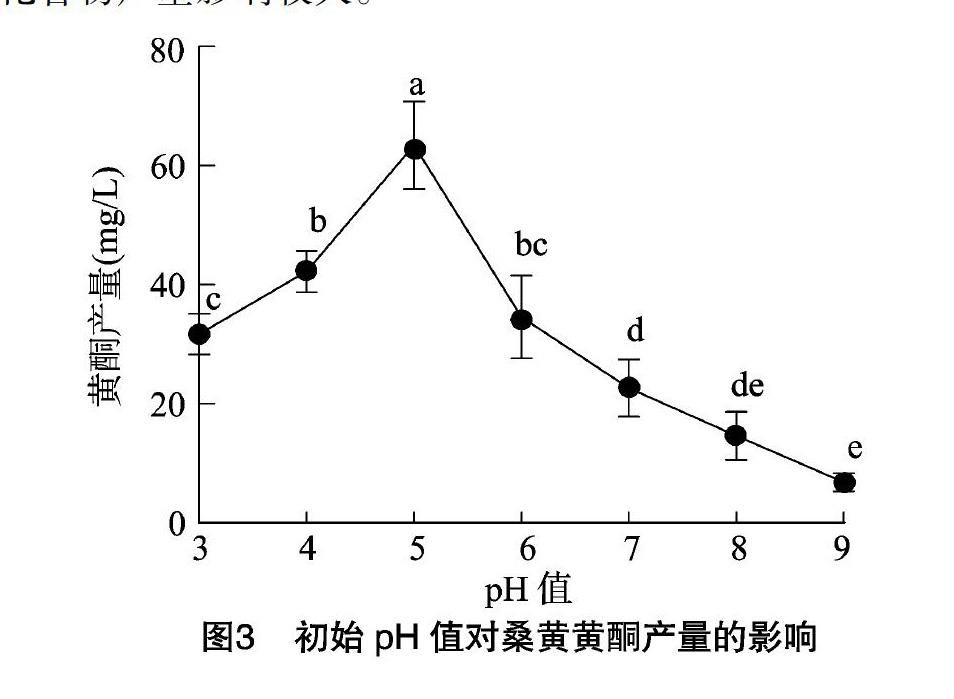
2.3 初始pH值对桑黄黄酮类化合物产量的影响
不同初始pH值对桑黄黄酮类化合物产量的影响,由图3可知,初始pH值=5时,桑黄黄酮类化合物产量达63.46 mg/L。初始pH值升高至8时,桑黄黄酮类化合物产量下降到 14.61 mg/L。结果表明,培养基不同初始pH值对桑黄黄酮类化合物产量影响较大。
2.4 响应面分析法优化桑黄黄酮类化合物发酵培养基
在上述单因素试验的基础上,笔者采用响应面分析法对液体发酵培养基进行优化。根据试验优化方案,安排27个试验组,对桑黄黄酮类化合物产量进行测定,见表1。由结果可知,以桑黄黄酮类化合物产量为响应值进行曲面拟合(图4)并获得回归方程:
Y=56.41+9.12×X1-0.77×X2-8.79×X3-2.14×X1×X2-3.80×X1×X3+2.23×X2×X3-7.12×X12-7.48×X22-7.94×X32。
式中:Y为桑黄黄酮类化合物产量,X1为麦芽糖浓度,X2为酵母提取物浓度,X3为初始pH值。
基于试验响应值的典型分析结果,该模型拟合度的R2值为0.849 1,拟合度较好。根據模型预测得出,当麦芽糖浓度为46.5 g/L,酵母提取物浓度为6.0 g/L,初始pH值为4.32时,桑黄黄酮类化合物产量获得最大值,达64.07 mg/L。对响应曲面预测值进行验证试验,应用优化培养基,测得黄酮产量为 (65.3±2.5) mg/L。预测值与验证试验所得桑黄黄酮类化合物产量较为接近,表明回归方程能够比较真实地反映各因素对桑黄黄酮类化合物产量的影响。
3 讨论
大型担子真菌的次生代谢产物很多都是具有生物活性的天然产物,相关研究是真菌研究的热点问题之一[11]。真菌次生代谢通常会受到真菌生长环境或营养条件的影响[12]。Tian等通过优化培养基成分提高了桑黄中黄酮类化合物的含量[13]。Zhao等通过改变培养基中氮源含量促进了灵芝酸的生物合成[14]。Wu等报道了pH值信号调控次生代谢基因的表达[15]。本研究也发现,无论是碳源、氮源还是初始pH值都会影响桑黄黄酮类化合物的生物合成,并且次生代谢产物含量变化幅度较大。通过响应面分析法对培养基条件进行优化时,笔者发现碳源、氮源和初始pH值在影响桑黄黄酮类化合物生物合成时还存在两两相互作用。这些结果均提示,桑黄黄酮类化合物生物合成响应环境因子调控的机制较复杂。因此,下一步笔者将在现有优化培养基的基础上,进一步通过单一因素研究其调控机制。
桑黄是一种传统药用真菌[16-17]。随着现代药理学研究的深入,桑黄的许多新的生物学活性被报道。研究者对桑黄活性成分的生物合成调控的研究也随之开展。Ma等研究发现,萘乙酸(NAA)促进桑黄黄酮的生物合成[9]。Tian等针对桑黄的双阶段发酵产生的活性物质(黄酮、多酚和多糖)进行了条件优化[13]。此外,Guo等针对植物激素吲哚-3-乙酸(IAA)、吲哚丁酸(IBA)和NAA对桑黄的发酵生物量以及胞外多糖含量的影响进行了研究,结果发现,5.0 mg/L NAA对桑黄的生物量和胞外多糖含量有显著的诱导作用[8]。本研究首次对桑黄黄酮类化合物发酵培养基进行了全面优化,桑黄黄酮类化合物产量显著提高,为今后深入研究桑黄黄酮类化合物的生物合成机制,进一步提高桑黄黄酮类化合物的生物合成效率提供了基础保障。
参考文献:
[1]Chen Y C,Chang H Y,Deng J S,et al. Hispolon from Phellinus linteus induces G0/G1 cell cycle arrest and apoptosis in NB4 human leukaemia cells[J]. The American Journal of Chinese Medicine,2013,41(6):1439-1457.
[2]Kim H I,Chung M Y,Shin J Y,et al. Protective effects of black hoof medicinal mushroom from Korea,Phellinus linteus (higher basidiomycetes),on osteoporosis in vitro and in vivo[J]. International Journal of Medicinal Mushrooms,2016,18(1):39-47.
[3]Huang S C,Kuo P C,Hung H Y,et al. Ionone derivatives from the mycelium of Phellinus linteus and the inhibitory effect on activated rat hepatic stellate cells[J]. Int J Mol Sci,2016,17(5):E681.
[4]Mei Y X,Zhu H,Hu Q M,et al. A novel polysaccharide from mycelia of cultured Phellinus linteus displays antitumor activity through apoptosis[J]. Carbohydr Polym,2015,124,90-97.
[5]Hwang J S,Kwon H K,Kim J E,et al. Immunomodulatory effect of water soluble extract separated from mycelium of Phellinus linteus on experimental atopic dermatitis[J]. BMC Complement Altern Med,2012,12:159.
[6]Jeon T I,Jung C H,Cho J.Y,et al. Identification of an anticancer compound against HT-29 cells from Phellinus linteus grown on germinated brown rice[J]. Asian Pacific Journal of Tropical Biomedicine,2013,3(10):785-789.
[7]Song M,Park H J. Anti-inflammatory effect of Phellinus linteus grown on germinated brown rice on dextran sodium sulfate-induced acute colitis in mice and LPS-activated macrophages[J]. Journal ofEthnopharmacology,2014,154(2):311-318.
[8]Guo X,Zou X,Sun M. Effects of phytohormones on mycelial growth and exopolysaccharide biosynthesis of medicinal mushroom Phellinus linteus[J]. Bioprocess and Biosystems Engineering,2009,32(5):701-707.
[9]Ma X K,Li L,Peterson E C,et al. The influence of naphthaleneacetic acid(NAA) and coumarin on flavonoid production by fungus Phellinus sp.:modeling of production kinetic profiles[J]. Applied Microbiology and Biotechnology,2015,99(22):9417-9426.
[10]Lung M Y,Tsai J C,Huang P C. Antioxidant properties of edible basidiomycete Phellinus igniarius in submerged cultures[J]. Journal of Food Science,2010,75(1):E18-E24.
[11]Calvo A M,Wilson R A,Bok J W,et al. Relationship between secondary metabolism and fungal development[J]. Microbiology and Molecular Biology Reviews,2002,66(3):447-459.
[12]Brakhage A A. Regulation of fungal secondary metabolism[J]. Nature Reviews Microbiology,2013,11(1):21-32.
[13]Tian X M,Dai Y C,Song A R,et al. optimization of liquid fermentation medium for production of inonotus sanghuang(higher basidiomycetes)mycelia and evaluation of their mycochemical contents and antioxidant activities[J]. International Journal of Medicinal Mushrooms,2015,17(7):681-691.
[14]Zhao W,Xu J W,Zhong J J. Enhanced production of ganoderic acids in static liquid culture of Ganoderma lucidum under nitrogen-limiting conditions[J]. Bioresource Technology,2011,102(17):8185-8190.
[15]Wu F L,Zhang G,Ren A,et al. The pH-responsive transcription factor PacC regulates mycelial growth,fruiting body development,and ganoderic acid biosynthesis in Ganoderma lucidum[J]. Mycologia,2016,108(6):1104-1113.
[16]Dai Y C,Zhou L W,Cui B K,et al. Current advances in Phellinus sensu lato:medicinal species,functions,metabolites and mechanisms[J]. Applied Microbiology and Biotechnology,2010,87(5):1587-1593.
[17]Kim G Y,Park S K,Lee M K,et al. Proteoglycan isolated from Phellinus linteus activates murine B lymphocytes via protein kinase C and protein tyrosine kinase[J]. International Immunopharmacology,2003,3(9):1281-1292.
