水杨酸预处理对强光胁迫下草绣球幼苗生理特性的影响
2019-10-25耿晓东周星宇周英
耿晓东 周星宇 周英
摘要:以大花绣球、圆锥绣球幼苗为材料,采用喷施水杨酸(SA)的方法,比较不同浓度SA预处理对强光胁迫下草绣球幼苗的影响。结果表明,在SA浓度为0~1.75 mmol/L内,强光协迫下大花绣球、圆锥绣球分别施用SA 1.00、0.75 mmol/L 处理,其幼苗相对电导率、超氧阴离子( O-2 · )产生速率、过氧化氢(H2O2)含量、丙二醛(MDA)含量相对最低,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性相对最高;在同一SA浓度水溶液处理下,大花绣球幼苗相对电导率、 O-2 · 产生速率、H2O2含量、MDA含量高于圆锥绣球,大花绣球幼苗SOD、POD、CAT活性低于圆锥绣球,SA预处理能有效增强这2个草绣球品种尤其是大花绣球的耐光性。
关键词:草绣球;强光协迫;水杨酸;保护酶;大花绣球;圆锥绣球
中图分类号:S685.990.1 文献标志码: A 文章编号:1002-1302(2019)13-0188-03
草绣球[Cardiandra moellendorffii (Hance) Migo]为虎耳草科八仙花属植物,别称八仙花、紫阳花等,株型美观、花团锦簇、花色丰富,观赏价值和经济价值较高,是市场上广受欢迎的流行花卉[1]。草绣球具有较强的抗性,能适应多种多样的栽培环境,很少感染病虫害,既被广泛用于园林绿化种植,也被用于室内盆花供应市场。植物的光合作用离不开光,在光合电子传递过程中,必然会产生光介导的活性氧[2],而夏季光照过强,远超过草绣球的光饱和点,易产生光抑制现象,甚至于造成植物光合器官不可逆转的光氧化破坏。通常情况下,植物体内活性氧的产生和清除处于一种动态平衡状态[3],而在逆境条件下,这种动态平衡往往被打破,抗氧化系统清除活性氧的能力减弱,活性氧会大量积累,进而对植物的细胞造成伤害[4]。
草绣球属喜阴植物,夏季强光会严重影响草绣球的生长、产量和品质,限制草绣球在园林绿化种植中的应用范围,这已成为制约草绣球发展的主要因素之一,而如何提高草绣球的耐强光能力是当前草绣球生产上迫切需要解决的问题。水杨酸(salicylic acid,SA)是一种广泛存在于植物体内、类似植物激素的酚类物质,能通过人工化学合成,具有无毒、廉价的优点,可以有效提高植物产生多种抗性[5-10]。本研究以大花绣球、圆锥绣球为材料,探讨不同浓度SA预处理对草绣球细胞膜透性、活性氧自由基、保护酶活性及丙二醛(MDA)含量的影响,以明确SA提高草绣球幼苗耐强光的效果及其生理机制,为SA在草绣球生产中的应用提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2017年4月在苏州农业职业技术学院相城科技园花卉试验基地进行,该基地位于31°25′N、120°36′E,属北亚热带季风气候区,四季分明,气候温和,雨量充沛,年均降水量 1 100 mm,年均温15.7 ℃,年无霜期244 d。
1.2 试验处理
剪取大花绣球、圆锥绣球的健康枝条,剪成6~8 cm的插穗,扦插到以泥炭土与珍珠岩按4 ∶ 6混匀作为基质的营养钵中,温室内自然光照下常规培养;当插穗生长至具6张功能叶片时,从中选取生长状况相对一致的幼苗,分别用0.25、0.50、0.75、1.00、1.25、1.50、1.75 mmol/L SA水溶液喷施幼苗叶面和叶背,以喷施蒸馏水为对照,以叶片滴水为准,早晚各喷施1次,连续处理4 d;将草绣球幼苗置于人工气候箱内强光胁迫继续培养5 d,光强为1 500 μmol/(m2·s),光照 12 h/d,温度为25 ℃,相对湿度为75%;培养第6天,每处理随机取草绣球幼苗6株,混合制样,测定各项指标。
1.3 测定指标与方法
相对电导率采用电导仪法[11]测定;超氧阴离子( O-2 · )产生速率参照王爱国等的方法[12]测定;过氧化氢(H2O2)、MDA含量参照刘俊等的方法[13-14]测定;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性分别采用氮蓝四唑(NBT)法、愈创木酚比色法、Kraus等的方法[15-17]测定。重复3次。
1.4 统计分析
采用Excel 2016、Sigmaplot软件对试验数据进行分析和绘图。
2 结果与分析
2.1 SA预处理对强光胁迫草绣球幼苗细胞膜透性的影响
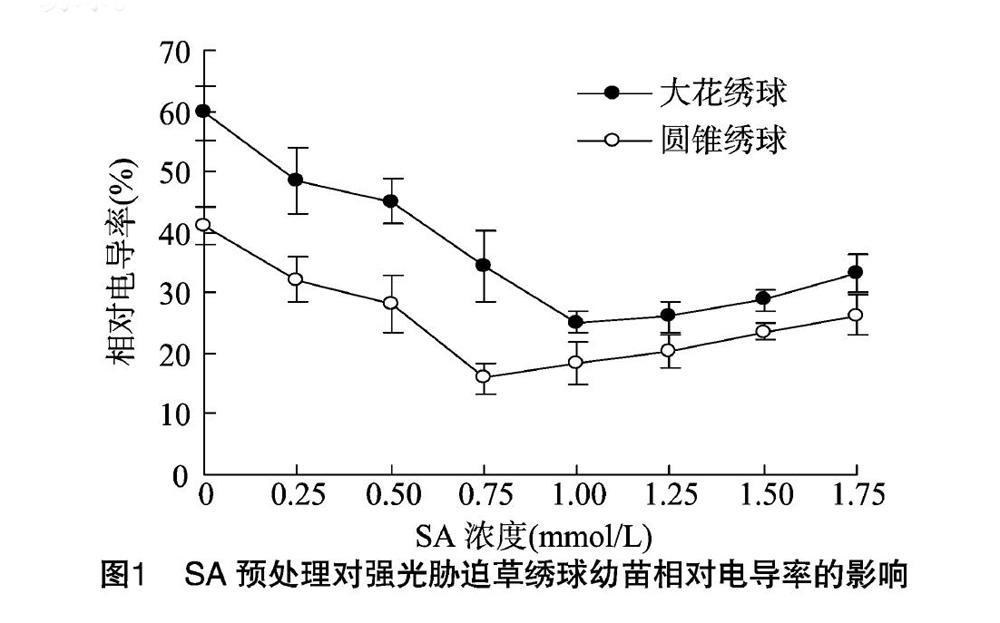
相对电导率是衡量细胞质膜稳定程度的重要指标。遭受逆境胁迫时,植物细胞膜通透性会增大,进而导致细胞内电解质外渗,相对电导率的大小可反映植物的抗逆性强弱[11]。由图1可见,强光胁迫下,随施用SA水溶液浓度的加大,大花绣球、圆锥绣球这2种草绣球叶片细胞相对电导率先迅速下降,并分别在SA浓度为1.00、0.75 mmol/L时相对电导率最低,分别仅为对照处理的37.9%、39.0%,后又逐渐上升;同一浓度SA水溶液处理下,大花绣球的相对电导率高于圆锥绣球。
2.2 SA预处理对强光胁迫草绣球幼苗活性氧自由基的影响
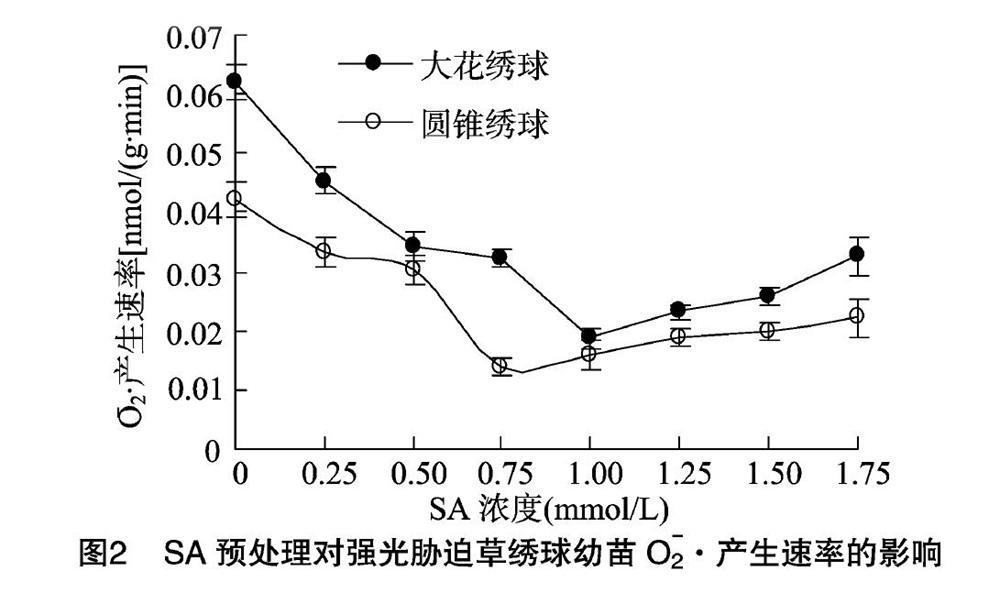
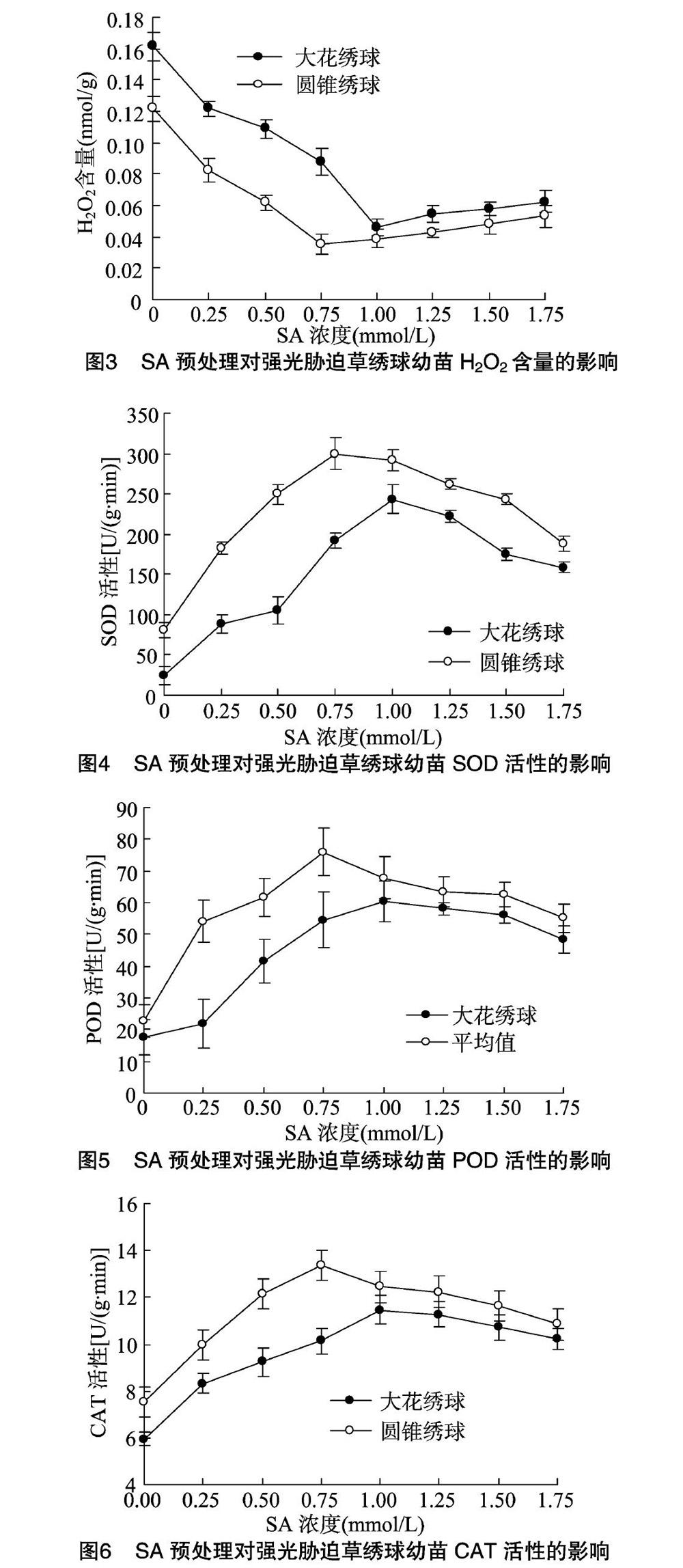
植物受逆境胁时会产生 O-2 · ,对植物膜结构造成伤害[18]。H2O2具有强氧化性, O-2 · 产生速率和H2O2含量是衡量植物逆境受损程度的重要指标。由图2、图3可见,强光胁迫下,随施用SA水溶液浓度的加大,大花绣球、圆锥绣球这2种草绣球叶片细胞 O-2 · 产生速率、H2O2含量先迅速下降,分别在SA浓度为1.00、0.75 mmol/L时达到最低,1.00 mmol/L SA水溶液处理的大花绣球 O-2 · 产生速率、H2O2含量分别仅为对照的30.6%、28.2%,而0.75 mmol/L SA水溶液处理的圆锥绣球 O-2 · 产生速率、H2O2含量分別仅为对照的33.3%、29.2%,后又逐渐上升;同一浓度SA水溶液处理下,大花绣球的 O-2 · 产生速率、H2O2含量均高于圆锥绣球。
2.3 SA预处理对强光胁迫草绣球幼苗保护酶活性的影响
SOD、POD、CAT是植物在逆境胁迫时消除体内活性氧的重要酶,其活性高低与植物抗逆性强弱息息相关。由图4、图5、图6可见,强光胁迫下,随施用SA水溶液浓度的加大,大花绣球、圆锥绣球这2种草绣球叶片细胞3种保护酶活性先迅速上升,分别在SA浓度为1.00、0.75 mmol/L时达到最高,浓度为1.00 mmol/L SA水溶液处理的大花绣球SOD、POD、CAT活性分别为对照的9.6、3.4、1.9倍,浓度为 0.75 mmol/L SA水溶液处理的圆锥绣球SOD、 POD、 CAT活
性分别为对照的3.8、3.3、1.8倍,后又逐渐下降;同一SA浓度水溶液处理下,大花绣球的SOD、POD、CAT活性均高于圆锥绣球。
2.4 SA预处理对强光胁迫草绣球幼苗MDA含量的影响
膜脂过氧化会导致MDA的积累,其含量变化在一定程度上可以反映质膜受损程度。由图7可见,随施用SA水溶液浓度的加大,大花绣球、圆锥绣球这2种草绣球叶片细胞MDA含量先迅速下降,分别在1.00、0.75 mmol/L时含量最低,分别仅为对照的31.0%、35.4%,后又逐渐上升;同一SA浓度水溶液处理下,大花绣球的MDA含量高于圆锥绣球。
3 结论与讨论
本研究结果表明,以不同浓度的外源水杨酸(SA)预处理大花绣球、圆锥绣球这2种草绣球扦插苗叶片,可明显降低强光胁迫下其相对电导率、超氧阴离子( O-2 · )产生速率、过氧化氢(H2O2)含量、丙二醛(MDA)含量,提高其超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,这说明外源SA预处理草绣球扦插苗可有效防护强光胁迫导致的氧化损伤,维持较高的活性氧清除能力,保护草绣球叶片细胞膜,有效提高草绣球品种的耐强光能力,这与秦舒浩等的研究结果[9,19]一致。SA通过积累植物体内活性氧自由基来诱导植物进行轻度胁迫锻炼,激活保护酶活性,维持较高的清除活性氧能力,降低膜脂过氧化程度和原生质膜通透性,进而增强植株对重度强光胁迫的抗性。
有关SA对保护酶活性的影响,研究结论不尽相同[20-21]。林忠平等认为,SA是通过降低CAT活性以实现植物体内H2O2、 O-2 · 含量的积累,并通过抗性锻炼来提升SOD等保护酶活性,进而增强植物的抗逆性[22]。吴楚等认为,外源SA能抑制SOD、CAT活性,提高POD活性[23]。本研究中,经SA预处理的2中草绣球品种在强光协迫下SOD、POD、CAT的活性均有明显提高,这与张蕊等的研究结果[10]相似。这些研究结果的差异性可能是由于植物种类差异、SA浓度梯度选择、处理时间及试验环境等因素导致,有必要进一步深入研究SA对植物耐光性提升的作用机制。
另外,本研究发现,在同一SA浓度水溶液处理下,大花绣球幼苗相对电导率、 O-2 · 产生速率、H2O2含量、MDA含量高于圆锥绣球,大花绣球幼苗SOD、POD、CAT活性低于圆锥绣球,说明SA预处理的大花绣球耐光性强于圆锥绣球,这为大花绣球的可扩大范围种植提供了一定的理论依据。
参考文献:
[1]胡海姿,尚爱芹. 八仙花的商品化促成栽培[J]. 中国花卉园艺,2005(2):30-31.
[2]Asada K,Foyer C H,Mullineaux P M. Production and action of active oxygen species in photosynthetic tissues[J]. Pure & Applied Chemistry,1994,79(12):2217-2227.
[3]李琲琲,刘志萍,张凤英,等. 耐盐和非耐盐大麦幼苗叶片抗氧化及抗坏血酸-谷胱甘肽循环系统对NaCl胁迫的反应差异[J]. 植物营养与肥料学报,2017,23(3):712-720.
[4]Moran J F,Becana M. Iturbe-Ormaetxe I,et al. Drought induces oxidative stress in pea plants[J]. Planta,1994,194(3):346-352.
[5]Senaratna T,Touchell D,Bunn E,et al. Acetyl salicylic acid (aspirin) and salicylic acid induce multiple stress tolerance in bean and tomato plants[J]. Plant Growth Regulation,2000,30(2):157-161.
[6]白生文,张喜峰,李彩霞,等. 水杨酸在植物非生物胁迫中的作用研究进展[J]. 河西学院学报,2015,31(2):19-24.
[7]Kang H M,Saltveit M E. Chilling tolerance of maize,cucumber and rice seedling leaves and roots are differentially affected by salicylic acid[J]. Physiologia Plantarum,2002,115(4):571-576.
[8]马乐元,陈年来,韩国君,等. 外源水杨酸对干旱胁迫下小冠花叶片活性氧水平及抗氧化系统的影响[J]. 草业学报,2017,26(10):129-139.
[9]秦舒浩,王麗丽,王廷娟. 高温强光下水杨酸对结球甘蓝幼苗生长特征及生理特性的影响[J]. 蔬菜,2013(12):5-8.
[10]张 蕊,吕 俊,米青山,等. 低温下外源水杨酸对水稻幼苗抗氧化酶系的影响[J]. 西南农业大学学报(自然科学版),2006,28(1):29-32.
[11]王学奎,黄见良. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2015.
[12]王爱国,罗广华. 超氧阴离子产生速率测定[J]. 植物生理學通讯,1990,26(6):55-57.
[13]刘 俊,吕 波,徐朗莱. 植物叶片中过氧化氢含量测定方法的改进[J]. 生物化学与生物物理进展,2000,27(5):548-551.
[14]朱广廉,钟海文,张爱琴,等. 植物生理学实验[M]. 北京:北京大学出版社,1990:242-245.
[15]Giannopolitis C N,Ries S K. Superoxide dismutases Ⅰ.Occurrence in higher plants[J]. Plant Physiology,1977,59(2):30-34.
[16]Moerschbacher B M,Noll U M,Flott B E,et al. Lignin biosynthetic enzymes in stem rust infected,resistant and susceptible near-isogenic wheat lines[J]. Physiological and Molecular Plant Pathology,1988,33(1):33-46.
[17]Kraus T E,Fletcher R A. Paclobutrazol protects wheat seedlings from heat and paraquat injury. Is detoxification of active oxygen involved?[J]. Plant & Cell Physiology,1994,35(1):45-52.
[18]张永福,黄鹤平,银立新,等. 冷(热)激对干旱胁迫下玉米活性氧清除及膜脂过氧化的调控机制[J]. 江苏农业科学,2015,43(5):56-60.
[19]曹伍林. 全光照下水杨酸对人参光合特征及质量的影响[D]. 哈尔滨:黑龙江中医药大学,2015.
[20]江 敏,郑舒文,宁慧宇,等. 外源水杨酸对涝渍胁迫下小麦产量及相关生理指标的影响[J]. 江苏农业科学,2017,45(5):55-57.
[21]姚岭柏,任 琴,韩海霞. 外源水杨酸对干旱胁迫下马铃薯生长及抗性生理指标的影响[J]. 江苏农业科学,2017,45(24):68-72.
[22]林忠平,胡鸢雷. 植物抗逆性与水杨酸介导的信号传导途径的关系[J]. 植物学报,1997(2):185-188.
[23]吴 楚,王政权. 冰冻条件下外源SA对水曲柳幼苗叶片内抗氧化酶的影响[J]. 林业科学,2002,38(5):54-59.
