基于鸡卵清蛋白启动子的纳豆激酶慢病毒表达载体表达特性的研究
2019-10-25蔡薇吴志鹏赵俊生
蔡薇 吴志鹏 赵俊生
摘要:纳豆激酶(nattokinase,NK)是一种有效的抗血栓药物。基于已构建的纳豆激酶慢病毒表达载体,旨在比较其在鸡输卵管上皮细胞和鸡胚成纤维细胞中特異性表达的有效性。提取含卵清蛋白启动子(ovalbumin promoter,OV2)和雌激素反应元件(estrogen response element,ERE)的pLV-OV2-ERE-NK-2A-EGFP重组质粒。通过PCR和双酶切进行初步鉴定,经生物公司测序、包装和滴定得转染传代培养的鸡输卵管上皮细胞和鸡胚成纤维细胞,并采用荧光显微镜和qPCR法检测细胞表达产物。结果表明,载体pLV-OV2-ERE-NK-2A-EGFP构建成功;且荧光显微镜下,鸡输卵管上皮细胞的绿色荧光多于成纤维细胞;qPCR检测发现NK正常表达。提示成功构建纳豆激酶慢病毒表达载体且在鸡输卵管上皮细胞中正常表达。
关键词:纳豆激酶;卵清蛋白启动子;雌激素反应元件(ERE);慢病毒载体;鸡输卵管上皮细胞;鸡胚成纤维细胞
中图分类号:S858.31 文献标志码: A 文章编号:1002-1302(2019)13-0042-03
临床上采用注射纤溶酶原激活剂的方法治疗血栓和栓塞性疾病。但由于其局限性不能满足市场需求。而之前所研究的纳豆激酶(nattokinase,NK)具有很强的纤溶活性,能直接作用于纤溶蛋白,也能激活体内纤溶酶原[1],且不具有其他溶栓类药物的缺点。陈寅等将NK用表达质粒pTYB102转化大肠杆菌ER2566,测定表达的NK占菌体总蛋白的30%以上[2]。黄志立等研究结果表明NK的表达率为12%,CLT法测定其具有溶栓活性,1 mL菌液的溶栓活性相当于120 U尿激酶[3]。童煜等表达出的1 mg NK干粉的溶栓活性相当于600 U尿激酶[4]。Hofmann等发现在非人类慢病毒转染人细胞过程中,可能存在转染效率低等问题[5]。Valori等研究表明,慢病毒(lentivirus,LV)能感染静止细胞,不会导致寄主细胞死亡,且被它感染的动物细胞能够连续传代[6]。Kamihira等通过对慢病毒的改造,极大地增加了慢病毒载体使用的生物安全性[7]。慢病毒载体是以慢病毒基因组为基础,除去其复制所需的必需基因,以具有治疗性的目的基因和选择性标记物整合构建而成。鸡输卵管生物反应器可使目的蛋白在鸡输卵管中特异性表达,并且随鸡蛋排出体外[8]。卵清蛋白在鸡蛋中的比重较大,鸡体细胞中的基因组均含有卵清蛋白序列,由多个外显子和内含子组成,其中一些外显子是构成mRNA编码区的重要组件[9]。在糖皮质激素和雌激素等激素的作用下,卵清蛋白基因中的类固醇激素依赖性调控元件SDRE在鸡输卵管细胞中通过激素调节卵清蛋白基因的表达。卵清蛋白基因启动子序列通过对卵清蛋白基因转录活性的调控,对卵清蛋白基因的表达量产生影响[10]。
本试验通过鉴定、包装和滴定已构建的纳豆激酶慢病毒表达载体,并转染鸡输卵管上皮细胞和鸡胚成纤维细胞以研究其表达特异性,为进一步研制NK转基因鸡奠定基础。
1 材料与方法
1.1 重组质粒、受精鸡蛋和原代鸡输卵管上皮细胞
重组质粒pLV-OV2-ERE-NK-2A-EGFP,由浙江大学动物科学学院动物遗传育种与繁殖实验室构建,保存在大肠杆菌菌株DH5a。8~10日龄受精蛋,由浙江大学实验动物中心提供;原代鸡输卵管上皮细胞,购自上海赛百慷生物技术有限公司。
1.2 主要试剂与工具酶
质粒提取试剂盒,购自天根生化科技(北京)有限公司(TIANGEN,美国);胎牛血清、DMEM培养液、胰蛋白酶、培养瓶和12孔培养板,均购自斯百汇生物技术(北京)有限公司(Gibco,美国);SYBR GreenERTM qPCR SuperMix Universal,购自杰英生物科技(北京)有限公司(Invitrogen,美国)。
1.3 纳豆激酶慢病毒载体质粒的提取、鉴定、包装、滴定
根据质粒小提试剂盒(TIANGEN,美国)提取大肠杆菌菌株DH5a内的重组质粒pLV-OV2-ERE-NK-2A-EGFP。采用酶切与测序方法进行鉴定。正确的质粒送上海汉恒生物技术有限公司进行慢病毒包装,qPCR法测定慢病毒载体滴定。
1.4 细胞的培养
1.4.1 鸡胚成纤维细胞的细胞原代培养 取受精蛋中的鸡胚,采用1%青-链霉素(双抗)的PBS溶液反复清洗;剪掉鸡胚四肢、内脏和头部。将剩余组织剪碎后贴在培养瓶管壁上,倒置放入CO2培养箱;10 min后再向其中加入5 mL完全培养液;待组织块完全浸润后,继续放入CO2培养箱中培养。
1.4.2 细胞传代培养 去除培养瓶中原有培养液,采用 37 ℃ PBS溶液漂洗细胞2~3次,再加入2~3 mL 0.25%胰蛋白酶溶液,在培养箱中翻转消化;待显微镜下观察到细胞回缩变圆分散成单个细胞时加入完全培养液终止消化,按1 ∶ 2的比例分装成2瓶,放入培养箱中继续培养。
1.5 纳豆激酶基因在细胞中的表达
1.5.1 纳豆激酶慢病毒载体转染 待传代后的鸡输卵管上皮细胞和鸡胚成纤维细胞密度生长至80%左右时,采用纳豆激酶慢病毒表达载体pLV-OV2-ERE-NK-2A-EGFP进行转染,以293F细胞为对照,通过荧光显微镜观察细胞。
1.5.2 NK的mRNA水平检测 提取鸡输卵管上皮细胞中的总RNA,反转录得到cDNA。采用qPCR检测NK在细胞中的mRNA水平。以GAPDH为内参,cDNA为模板,用Primer 5.0软件设计并由华大基因公司合成引物。PCR反应体系:SYBRGreenERqPCR SuperMix Universal 12.5 μL,其中 10 μmol/L 引物P1和P2各0.5 μL,cDNA 0.5 μL,DEPC-treated water 11.0 μL。PCR反应条件:90 ℃预变性2 min;95 ℃ 变性15 s,60 ℃退火1 min,75 ℃延伸10 min,共40个循环。293F细胞为对照组。
1.5.3 数据分析 采用SPSS软件进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 重组质粒提取、酶切与测序鉴定
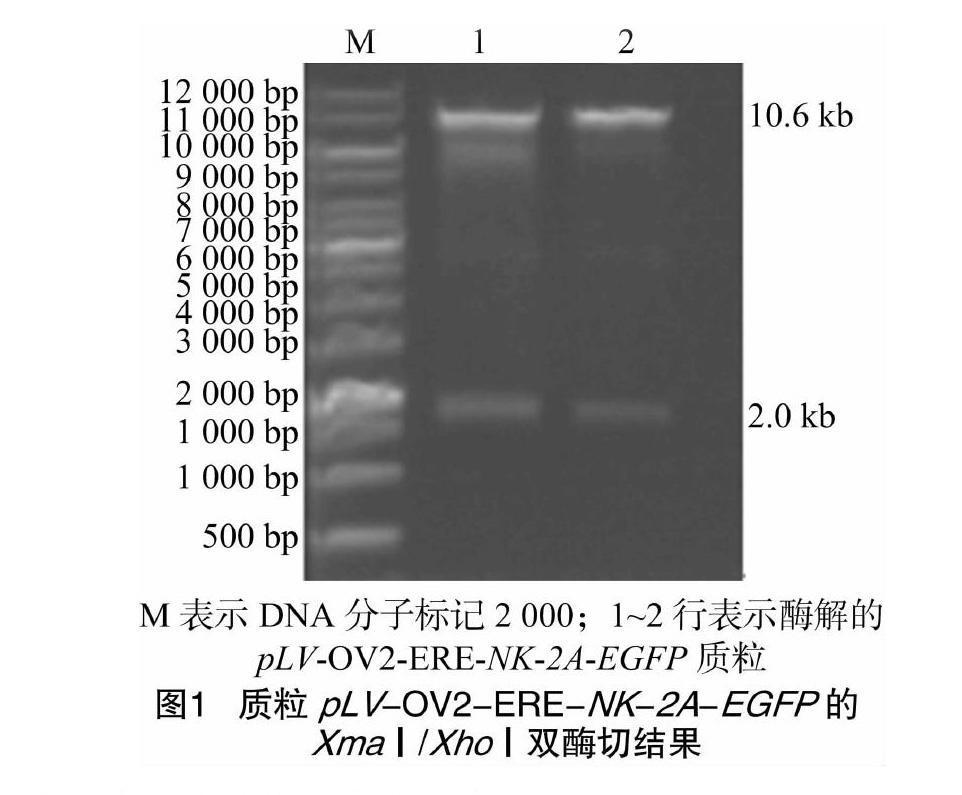
由图1可知,经试剂盒小提质粒其长度约13 kb,重组质粒pLV-OV2-ERE-NK-2A-EGFP进行XmaⅠ和XhoⅠ双酶切,得到大小约10.6、2.0 kb的2条亮带。后者与片段NK-2A-EGFP的大小为2 077 bp相符,与预期结果一致。
2.2 NK的测序和纳豆激酶慢病毒载体的包装、滴定
根据测序结果1 327 bp序列与GenBank公布的序列(GenBank:Ay219901)有99%同源性,可认定NK基因片段已插入表达载体中,成功获得纳豆激酶慢病毒表达载体。qPCR法测定慢病毒载体滴度约为1.6×107 IU/mL。
2.3 鸡胚成纤维细胞的培养
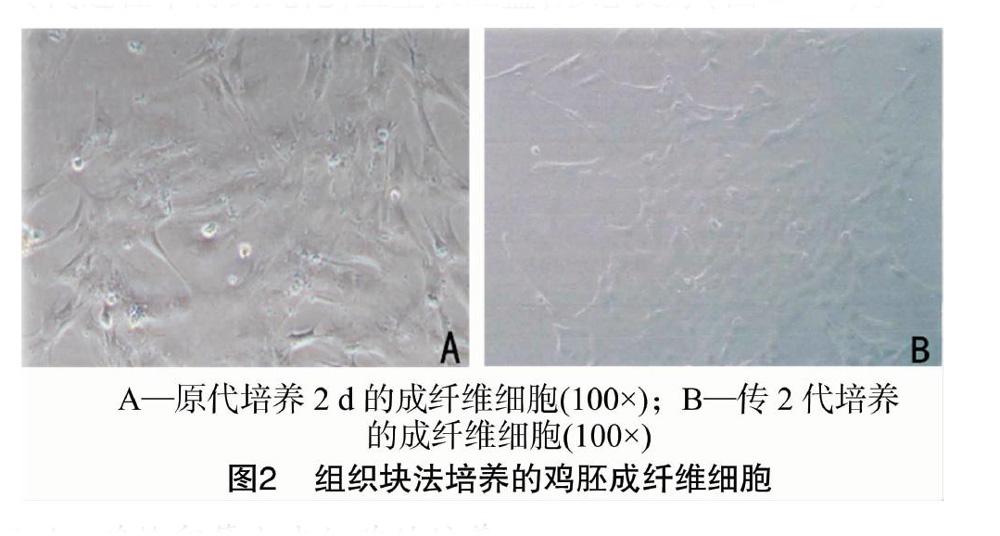
鸡胚成纤维细胞为贴壁生长型细胞。原代细胞培养1 d,组织块边缘开始游离出少量细胞,细胞间隙较大。原代培养2 d,细胞生长密度可以达到70%~80%(图2-A)。细胞在传代过程中得到纯化,且生长旺盛,形态良好(图2-B)。
2.4 鸡输卵管上皮细胞的培养
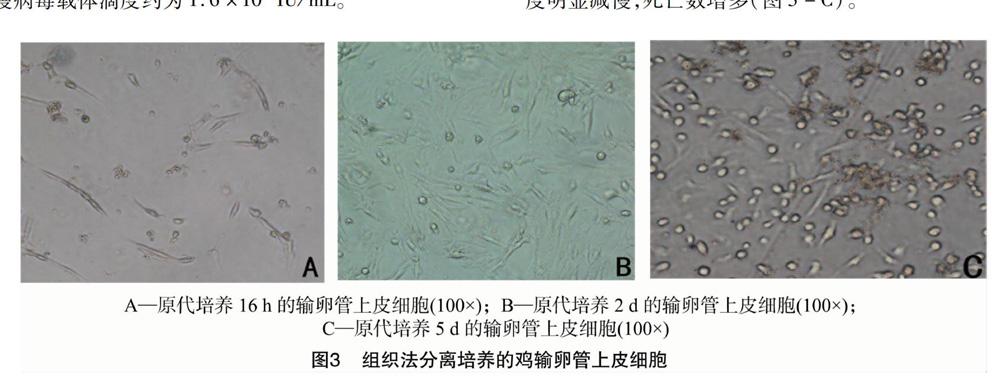
采用组织块分离法培养16 h得到原代鸡输卵管上皮细胞,此时细胞开始贴壁生长,增殖速度比成纤维细胞慢(图3-A)。原代培养2 d后,细胞呈梭长形或圆形,生长密度可高达70%左右(图3-B)。原代培养5 d的输卵管上皮细胞形态变圆,大多数细胞胞质回缩,杂质增多,细胞生长速度明显减慢,死亡数增多(图3-C)。
2.5 转染后细胞镜检
荧光显微镜观察发现,纳豆激酶慢病毒载体转染输卵管上皮细胞48 h后出现绿色荧光(图4-B),随转染时间的延长,具有绿色荧光的细胞越來越多,到72 h后,达到最高水平(图4-C)。转染的成纤维细胞48 h后未发现绿色荧光(图4-A)。说明OV2在鸡输卵管上皮细胞中特异性表达,初步表明纳豆激酶慢病毒载体在输卵管上皮细胞中成功表达。但与对照组293F细胞相比,鸡输卵管上皮细胞中的绿色荧光量明显较少(图5)。可进一步检测鸡输卵管上皮细胞中NK的mRNA相对表达量。
2.6 NK的mRNA水平检测
采用qPCR法得到CT值,通过2-ΔΔCT计算出NK的mRNA相对表达量,得出鸡输卵管上皮细胞未感染组与293F细胞对照组差异极显著(P<0.01),而与鸡输卵管上皮细胞感染组差异不显著(P>0.05)(图6),说明纳豆激酶慢病毒载体在鸡输卵管上皮细胞中的mRNA表达水平量不高。
3 讨论
本次试验设计了NK目的基因和EGFP报告基因融合在一起插入含卵清蛋白启动子(ovalbumin promoter,OV2)和雌激素反应元件(estrogen response element,ERE)的重组质粒pLV-OV2-ERE-EGFP中。现有的多基因共载体构建策略包括mRNA剪切策略[11]、内部启动子策略、融合蛋白策略及蛋白酶策略[12]等。这些策略最主要的不足之处在于载体容纳能力有限[13]。另外,多基因在同一载体上表达时其蛋白活性及表达效率不及单基因表达载体[14]。2A肽的多基因载体构建策略避免了多基因表达时蛋白活性不高或下游基因表达量低等缺点[15]。Adam等用人角蛋白K14基因的启动子替换PGK的启动子(LVK14),后用慢病毒载体感染猪胚胎。尽管在猪所有组织中都检测到了LVK14的整合体,但是仅在皮肤中有GFP的表达[16]。本试验转染鸡输卵管上皮细胞和鸡胚成纤维细胞24 h后,前者出现绿色荧光,而后者几乎没有。说明启动子在不同种类的细胞选择性地执行功能,或是EGFP在不同细胞中差异性地将解,可用Western Blot进行验证。纳豆激酶在鸡输卵管上皮细胞中转录的mRNA量较低,表明重组质粒中OV2的效率较低。杨鹏翔等以EGFP和萤火虫荧光素酶为报告基因,构建OV2慢病毒表达载体,转染鸡输卵管上皮细胞、鸡胚成纤维细胞、鼠3T3-L1 前脂肪细胞和牛乳腺上皮细胞,通过荧光和酶活性检测发现基于OV2调控序列构建的表达载体无法实现外源基因的高效特异性表达[17]。Ochiai等采用OV2的5′侧翼1.35 kb片段和3种不同的病毒启动子分别构建载体,通过基因枪的方法注射到产蛋母鸡的输卵管部位,结果发现病毒启动子的启动效率远远高于OV2调控区[18]。这些都与本研究结果一致,验证OV2在鸡输卵管上皮细胞表达效率低。
参考文献:
[1]徐 仲,赵晓东,郑稚莺,等. 纳豆激酶的纯化及活力测定[J]. 生物技术,1997,7(4):16-18.
[2]陈 寅,林旭瑷,张志芳,等. 纳豆激酶基因在家蚕生物反应器中的表达[J]. 中国蚕业,2003,24(1):67-68.
[3]黄志立,罗立新,杨汝德,等. 纳豆激酶基因重组质粒在大肠杆菌与毕赤酵母中的稳定性[J]. 广东药学院学报,2001,17(4):254-256,259.
[4]童 煜,陈守春,张思仲. 纳豆激酶原核表达载体的构建及其活性鉴定[J]. 应用与环境生物学报,2007,13(3):369-372.
[5]Hofmann A,Zakhartchenko V,Weppert M,et al. Generation of transgenic cattle by lentiviral gene transfer into oocytes[J]. Biology of Reproduction,2004,71(2):405-409.
[6]Valori C F,Ning K,Wyles M,et al. Development and applications of non-HIV-based lentiviral vectors in neurological disorders[J]. Current Gene Therapy,2008,8(6):406-418.
[7]张敬之,郭歆冰,谢书阳,等. 用慢病毒载体介导产生绿色荧光蛋白(GFP)转基因小鼠[J]. 自然科学进展,2006,16(5):571-577.
[8]Borwompinyo S,Brake J,Mozdziak P E,et al. Culture of chicken embryos in surrogate eggshells[J]. Poultry Science,2005,84(9):1477-1482.
[9]Kawabe Y,Kamihira M,Ono K,et al.Production of scFv-Fc fusion protein using genetically manipulated quails[J]. Biosci Bioeng,2006,102:297-303.
[10]杜立新,赵英会,张念华. 鸡卵清蛋白基因调控序列指导人促红细胞生成素转基因鸡的制备[J]. 山东农业大学学报(自然科学版),2004,35(3):321-324.
[11]Sharma P,Yan F,Doronina V A,et al. A peptides provide distinct solutions to driving stop-carry on translational recoding[J]. Nucleic Acids Research,2002,40(7):3143-3151.
[12]Kim J H,Lee S R,Li L H,et al. High cleavage efficiency of a 2a peptide derived from porcine teschovirus-1 in human cell lines,zebrafish and mice[J]. PLoS One,2011,6(4):185-186.
[13]Trichas G,Begbie J,Srinivas S. Use of the viral 2A peptide for bicistronic expression in transgenic mice[J]. BMC Biology,2008,6:40.
[14]Provost E,Rhee J,Leach S D. Viral 2a peptides allow expression of multiple proteins from a single ORF in transgenic zebrafish embryos[J]. Genesis,2007,45(10):625-629.
[15]Kwon M S,Koo B,Choi B,et al. Development of transgenic chickens expressing enhanced green fluorescent protein[J]. Biochem and Bioph Res,2004,320(2):442-448.
[16]Adam S,Cockrell,Kafri T. Gene delivery by lentivirus vectors[J]. Molecular Biotechnology,2007,23(3):18-23.
[17]楊鹏翔,王曦晨,王宇祥,等. 转基因鸡生物反应器载体的构建及其表达特性分析[J]. 生物工程学报,2011,27(8):1215-1224.
[18]Ochiai H,Park H M,Nakamura A,et al. Synthesis of human erythropoietin in vivo in the oviduct of laying hens by localized in vivo gene transfer using electroporation[J]. Poultry Science,1998,77(2):299-302.
