针刺单穴与腧穴配伍对炎性痛大鼠痛阈及血清炎性因子的影响
2019-10-25何玲玲游世晶陈采益
何玲玲,林 栋,游世晶,陈采益
(福建中医药大学针灸学院,福建 福州 350122)
课题组前期研究表明针刺大鼠外关穴能特异性地促进磷酸化环磷腺苷反应元件结合蛋白(p-CREB)的表达,不论在小脑或皮质扣带回,针刺穴位组的p-CREB的较非穴组表达均明显增强[1]。同时,针刺干预外关单穴可上调炎性痛大鼠皮质扣带回、海马脑区Bcl-2表达[2]。因此,本项目组在基于经穴及循经取穴(单穴)特异性研究的基础上,进一步观察针刺外关单穴与其腧穴配伍对炎性痛大鼠痛阈及血清炎性因子 P物质(substance P,SP)、前列腺素 E2(PGE2)、白细胞介素-1β(IL-1β)含量的影响,进而探讨单穴与腧穴配伍镇痛效应及相关神经-体液-免疫机制,为经穴配伍应用提供实验依据。
1 实验材料
1.1 实验动物 清洁级雄性SD大鼠40只,体质量(300±50)g,由福建中医药大学实验动物中心提供,许可证号:SYXK(闽)2014-0005。 自由饮食,饲养环境为12 h~12 h昼夜节律变换,室温控制在18~24℃,湿度控制在50%~70%。
1.2 实验试剂 大鼠前列腺素SP酶联免疫检测试剂盒、大鼠前列腺素E2酶联免疫检测试剂盒、大鼠白细胞介素-1β酶联免疫检测试剂盒(上海西唐生物科技有限公司)。
1.3 实验仪器 ZH-LUO/B鼠尾测痛仪(安徽省淮北正华生物仪器设备有限公司);一次性无菌针灸针(苏州医疗用品厂);TGL-168高速冷冻离心机(上海安亭科学仪器厂);DENLEY DRAGON Wellscan MK 3酶标仪(芬兰Thermo公司);数字显示隔水式电热恒温培养箱(上海跃进医疗器械厂)。
2 实验方法
2.1 实验分组 适应性饲养1周后按随机数字表法将大鼠分为模型组、外关组、外关配伍合谷组和外关配伍合谷、后溪组,每组各10只。所有实验对动物的处理符合国际疼痛研究会制定的准则。
2.2 模型制作 实验人员用黑布罩住大鼠头部,采用微量进样器于大鼠右前肢外侧肘节穴(定位参照《实验针灸学》三版教材中的大鼠的穴位图谱:肘突与臂骨外上髁间的凹陷中,相当于人体手少阳经天井穴)快速进针,并循经朝上注入1~2 mm相当于“清冷渊”穴区注射5%甲醛50 μL,观察动物形态学和行为学变化,动物注射后出现患肢红肿、抖动、缩肢等,示造模成功。采用鼠尾测痛仪测出疼痛阈值并记录。
2.3 穴位选择 外关穴取穴参照大鼠的穴位图谱:位于腕关节上3 mm(近心端),尺、桡骨间,在指总伸肌与指侧伸肌之间取穴;合谷穴:于前肢第一、第二掌骨之间;后溪穴:于第五掌骨小头后方掌横纹头。针具选用华佗牌0.5寸针灸针(0.25 mm×13 mm),采用单手进针法斜刺(指向炎性病灶区),深度 4~6 mm,留针20 min,间隔 5 min行针 1次(捻转幅度 90°~180°,捻转频率 60~90 次 /min)。模型组:造模成功后予模拟抓取动作,不予针刺干预。其余4组分别选取相应的穴位组合进行针刺干预,每日1次,干预6次。
2.4 取材处理 完成实验干预后,采用10%水合氯醛按2 mL/kg体质量进行麻醉,经腹主动脉取血4 mL,室温下血液自然凝固10~20 min后,冷冻离心机 4 ℃、3 000 r/min下离心 20 min,取上清液,置于-80℃冰箱中保存待测。
2.5 观察指标及方法
2.5.1 鼠甩尾潜伏期测定 上述造模成功后,在实验干预前后测定大鼠甩尾潜伏期。将ZH-LUO/B鼠尾测痛仪连接电源,设置温度参数值40℃,将大鼠距尾根部2~3 cm的位置摆放在光源中。同时记录光源点亮至大鼠甩尾时间数据,当热痛觉达到大鼠的热痛阈后,可引发大鼠甩尾反射,从照射开始至甩尾反应发生即为大鼠甩尾潜伏期。造模后各组大鼠在实验干预前后测定,每次测3次取平均值,即为平均热痛阈值。
2.5.2 酶联免疫吸附检测法测定 按试剂盒说明书检测炎性痛大鼠血清SP、PGE2、IL-1β含量。用一抗包被微孔板并制成固相抗体,并向包被单抗的微孔中加入标准品、血清样品、辣根过氧化物酶标记检测抗体,温育30 min;洗板6次后加入酶标试剂100 μL温育30 min;洗板6次后,加入显色液A、B 各 100 μL 显色 30 min;加终止液 100 μL;30 min内用酶标仪在450 nm处测量吸光度,计算血清标本中 SP、PGE2、IL-1β 浓度。
2.6 统计学方法 采用SPSS 22.0统计软件分析数据。计量资料符合正态分布以()表示,2组间比较采用t检验;多组间比较采用单因素方差分析,其中方差齐采用LSD(L)分析,方差不齐采用Games-Howell分析。
3 结 果
3.1 4组干预前后平均鼠甩尾潜伏期时间比较 见表1。
表1 4组干预前后平均鼠甩尾潜伏期时间比较()s
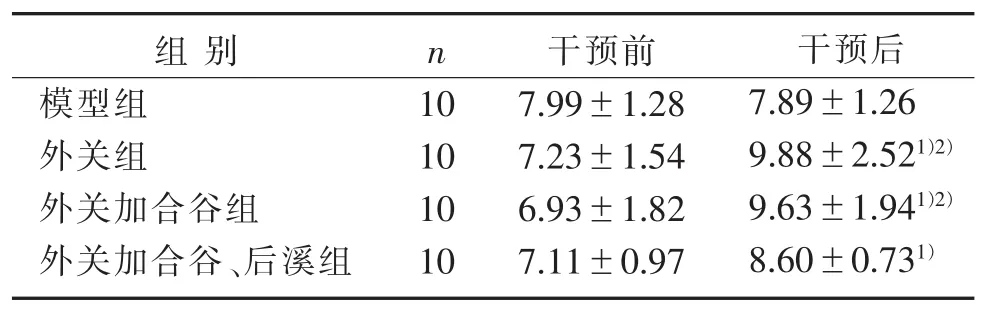
表1 4组干预前后平均鼠甩尾潜伏期时间比较()s
注:与干预前比较,1) P<0.05;与模型组比较,2) P<0.05。
组别模型组外关组外关加合谷组外关加合谷、后溪组干预前7.99±1.28 7.23±1.54 6.93±1.82 7.11±0.97干预后7.89±1.26 9.88±2.521)2)9.63±1.941)2)8.60±0.731)n 10 10 10 10
3.2 4组大鼠血清SP、PGE2、IL-1β水平比较 见表2。
表 2 4 组大鼠血清 SP、PGE2、IL-1β 水平比较()pg/mL
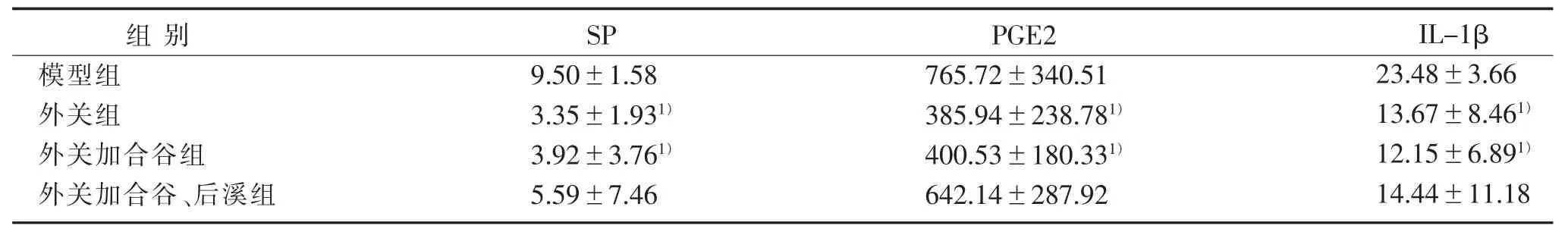
表 2 4 组大鼠血清 SP、PGE2、IL-1β 水平比较()pg/mL
注:与模型组比较,1) P<0.05。
组别模型组外关组外关加合谷组外关加合谷、后溪组SP 9.50±1.58 3.35±1.931)3.92±3.761)5.59±7.46 IL-1β 23.48±3.66 13.67±8.461)12.15±6.891)14.44±11.18 PGE2 765.72±340.51 385.94±238.781)400.53±180.331)642.14±287.92
4 讨 论
近年来,神经-体液-免疫调节因在炎性痛中发挥多靶向、多水平的复杂关联作用而受到研究者的关注。SP是一种存在于初级传入神经元的重要神经肽,其既可传递伤害性信息到脊髓,也能调节外周炎症[3-4]。SP可作用于炎性白细胞上的特异性神经激肽受体,并参与B细胞免疫球蛋白合成。研究表明SP可通过MrgprB2/MrgprX2受体参与肥大细胞脱颗粒,参与调节组织损伤所致的疼痛、免疫细胞浸润和肿胀[5]。 前列腺素(prostaglandin,PG)是不饱和脂肪酸的衍生物,具有多种生理作用的生物活性物质。当细胞膜受到刺激时,机体会产生并释放PG。PG因其不同结构及功能被分为A~I 9种类型,其中PGE2是致痛性最强的炎症反应介质,与疼痛密切相关。作为白细胞介素-1(IL-1)家族的成员之一,由活化的单核/巨噬细胞产生的IL-1β在免疫应答及炎症反应中起重要作用[6]。大量临床及实验研究表明,针刺可通过调整机体SP、PGE2及IL-1β水平发挥镇痛作用[7-12]。
《素问·调经论》记载曰:“病在筋,调之筋,病在骨,调之骨”。手三阳筋经上肢部循行在《灵枢·经筋》载曰:“手阳明之筋……上循臂,上结于肘外,上臑,结于肩髃”“手太阳之筋……上循臂内廉,结于肘内锐骨之后,弹之应小指之上”“手少阳经之筋……上循臂,结于肘;上绕臑外廉”。因此,手三阳筋经与肘外、肘内锐骨、肘上等部位密切相关。本研究引入的肢体炎性疼痛模型属于筋经病范畴,临床常根据病变部位采用局部取穴,并根据辨筋(经)取穴原则配合邻近或远端腧穴进行治疗。以腰痛取穴为例,经数据分析研究表明其取穴配伍主要以局部与远端配穴为主,且注重循经选穴及特定穴的应用[13]。有颈椎病临床取穴配伍研究表明,不同腧穴配伍的针刺治疗均可改善颈部前屈的耐疲劳性,其针刺效应与取穴数目的多少无关[14]。腧穴配伍选穴思路相关研究表明,选穴是研究影响腧穴配伍效应的首要任务[15],腧穴配伍选穴思路应以症状及同功穴为切入点,同时结合临床具体病因病机、归经、病位及病性而决定主穴及配穴[16]。另有研究表明腧穴配伍研究不能简单认为基于两个或两个以上的腧穴配合应用,而需基于一定选穴原则及临床应用进行研究,优选配伍可协同增效,而无效的穴位配伍不但不能起上述作用,甚者可能会影响单穴本身功能的发挥[17]。
辨经取穴作为针刺选穴的经典原则,在临床上被广泛应用于筋经病的治疗。目前,在筋经病取穴配伍研究中多以临床疗效及基于数据挖掘技术研究为主[18-23],较少开展相关动物实验进行机制分析。同时,在选穴配伍方面,尚缺乏比较循经选取单穴与其配合之间的效应差异。本研究结果显示外关组、外关加合谷组与外关加合谷、后溪组3组在干预后均可提高炎性痛大鼠自身痛阈。与模型组比较,外关组、外关加合谷组可提高大鼠痛阈值,并降低血清中炎性因子 SP、PGE2、IL-1β 含量(P<0.05),单穴与其配伍组间差异无统计学意义(P>0.05)。由此可知,基于辨经取穴的穴位组合配伍对炎性疼痛镇痛作用并不优于其单穴应用,其机制有待进一步研究。
