再生障碍性贫血-阵发性睡眠性血红蛋白尿综合征合并脑静脉窦血栓一例并文献复习
2019-10-24张文静
张文静 王 泳*
(首都医科大学附属复兴医院康复中心,北京 100038)
阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)是一种罕见的造血干细胞获得性疾病,以溶血性贫血、骨髓衰竭和威胁生命的静脉血栓形成为特征,与再生障碍性贫血(aplastic anemia,AA)关系密切,可相互转化且并存。脑静脉系统是PNH患者继肝静脉系统后第二常见的血栓发生部位[1]。但因为这两种疾病都属于罕见病,PNH相关脑静脉血栓的报道非常少。本文报道了1例AA-PNH综合征合并脑静脉窦血栓形成(cerebral venous sinus thrombosis,CVST)的患者,并对相关文献进行了复习。
1 临床资料
患者,女性,18岁,因“右侧颞枕部疼痛伴发热、呕吐1 d” 于2018年4月28日就诊于当地医院,接受抗感染、改善循环治疗后头痛稍好转,2018年5月8日患者再次出现头痛,合并失语、意识障碍、癫痫发作,右侧肢体无力进行性加重并累及左侧肢体,于北京某医院住院治疗,病情稳定后转至笔者科室行综合康复治疗。
既往史:10岁时因“反复鼻衄”确诊为再生障碍性贫血,曾口服环孢素1年余,长期口服司坦唑醇至今。
查体:体温39 ℃。昏睡,混合性失语,颈强直,颏下距胸4横指,重度贫血貌。右眼结膜出血。双上肢肌张力高,双下肢肌张力减低,右侧肌力I~II级,左侧肌力IV级左右。双上肢腱反射减低,双下肢腱反射活跃,右侧病理征(+)。
辅助检查:脑脊液压力330 mm H2O(1 mm H2O=0.009 8 kPa)。红细胞计数1.66×1012/L,血红蛋白53 g/L,血小板计数113×109/L。D-二聚体(D-dimer, DD)>20 μg/mL。尿潜血1+。外周血流式细胞学:成熟粒细胞和单核细胞均检出PNH克隆,红细胞CD59缺失,PNH克隆占11.6%。白血病相关基因检测:PIGA基因突变,变异比例46%。抗人球蛋白分型试验:IgG、C3、IgA、IgM均为阴性。骨髓形态学:红细胞增生旺盛。骨髓活检:骨髓增生大致正常,红系比例增高,巨核细胞略偏少,未见原始细胞及异常淋巴细胞明显增多。
影像学检查:头颅磁共振(magnetic resonance imaging,MRI)+磁共振静脉造影(magnetic resonance venography,MRV)(2018-5-8)扫描示,双侧额叶急性脑梗死;上矢状窦前部、左侧横窦显示不清(图1)。复查磁共振(2018-5-10)示,双侧额顶叶静脉性脑梗死伴出血;上矢状窦血栓,左侧横窦发育不全,右侧额顶部头皮静脉曲张。(图2)。
诊断:AA-PNH综合征、 颅内静脉窦血栓、脑梗死。
治疗及病情演变:入院后给予脱水降颅压、抗癫痫、抗感染、降纤、低分子肝素及华法林序贯抗凝,糖皮质激素免疫抑制治疗等。再次复查头颅MRI(2018-5-31)示,双侧额顶叶异常信号及周围水肿信号范围缩小,左侧脑室受压明显减轻;头颅增强MRV:上矢状窦条状充盈缺损体积减小(图3)。眼底检查示视神经乳头水肿伴出血,考虑颅内高压所致,行视神经管减压术。随后转至本科行近3个月综合康复治疗,入科时神志清醒、精神差,贫血貌,四肢肌张力低,肌力右上肢Ⅱ级,右下肢Ⅰ级,左上肢Ⅳ~级左右,卧床。血红蛋白79g/L,腰椎穿刺示脑脊液压力>330 mm H2O,给予甘露醇脱水降颅压,华法林抗凝,泼尼松免疫抑制,促红细胞生成素及司坦唑醇促进造血,小剂量铁剂及叶酸、VitB12补充造血原料等内科治疗,并给予高压氧治疗30余次及个性化康复训练,患者肌力及运动能力明显改善,目前已可监护下室内独立步行。复查脑脊液压力230 mm H2O,血红蛋白106 g/L。目前规律口服华法林抗凝治疗,国际标准化比值(international normalized ratio,INR)达标。
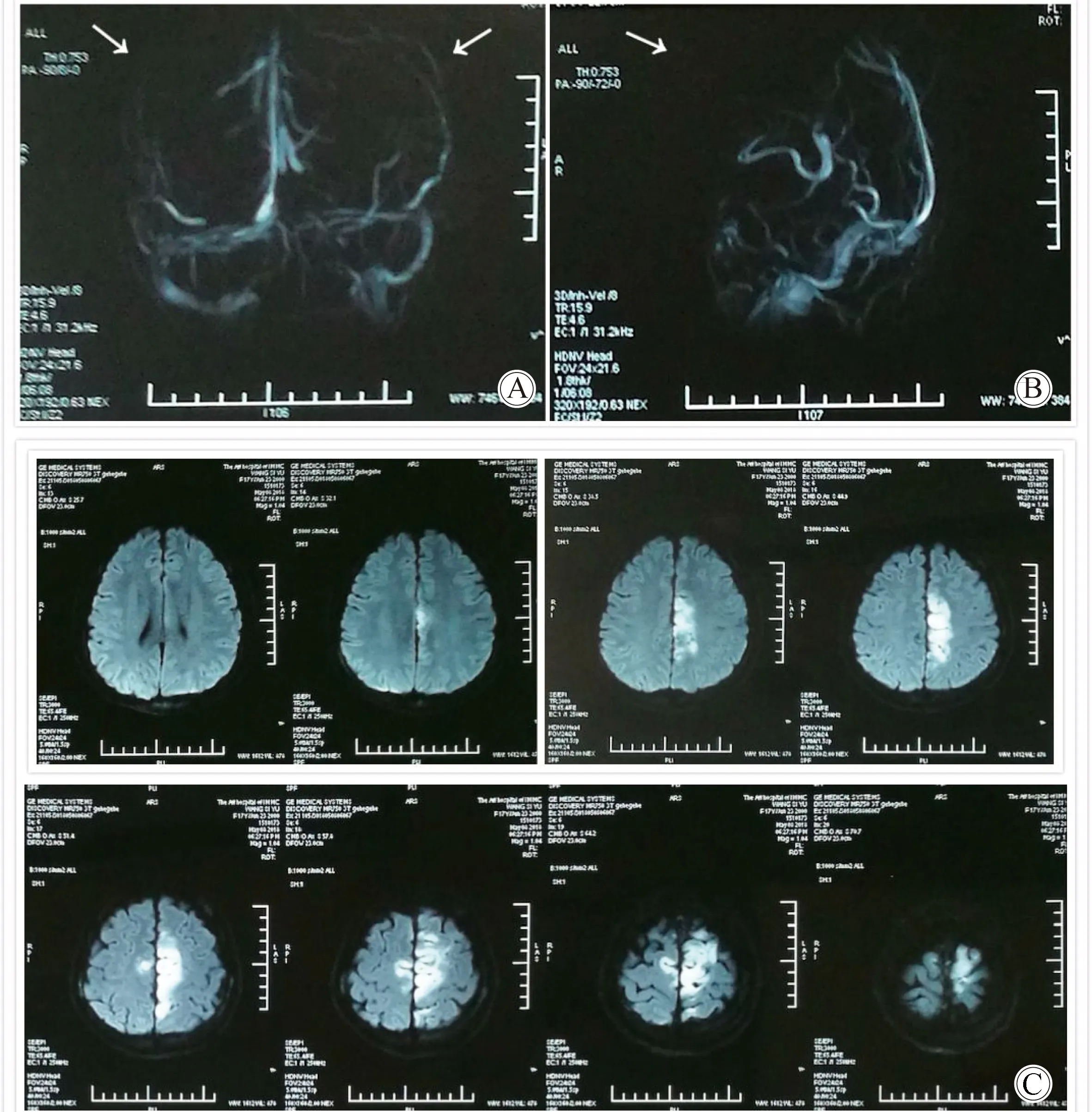
图1 入院首次头颅MRV及头颅MRIFig.1 Cranial MRV and cranial MRI at first admission
A:cranial MRV: coronal position;B:cranial MRV: midsagittal position; The anterior superior sagittal sinus and the left transverse sinus were not clear displayed;C:cranial MRI: acute infarction at bilateral frontal lobe(2018-05-08);MRV:magnetic resonance venogram;MRI:magnetic resonance imaging.
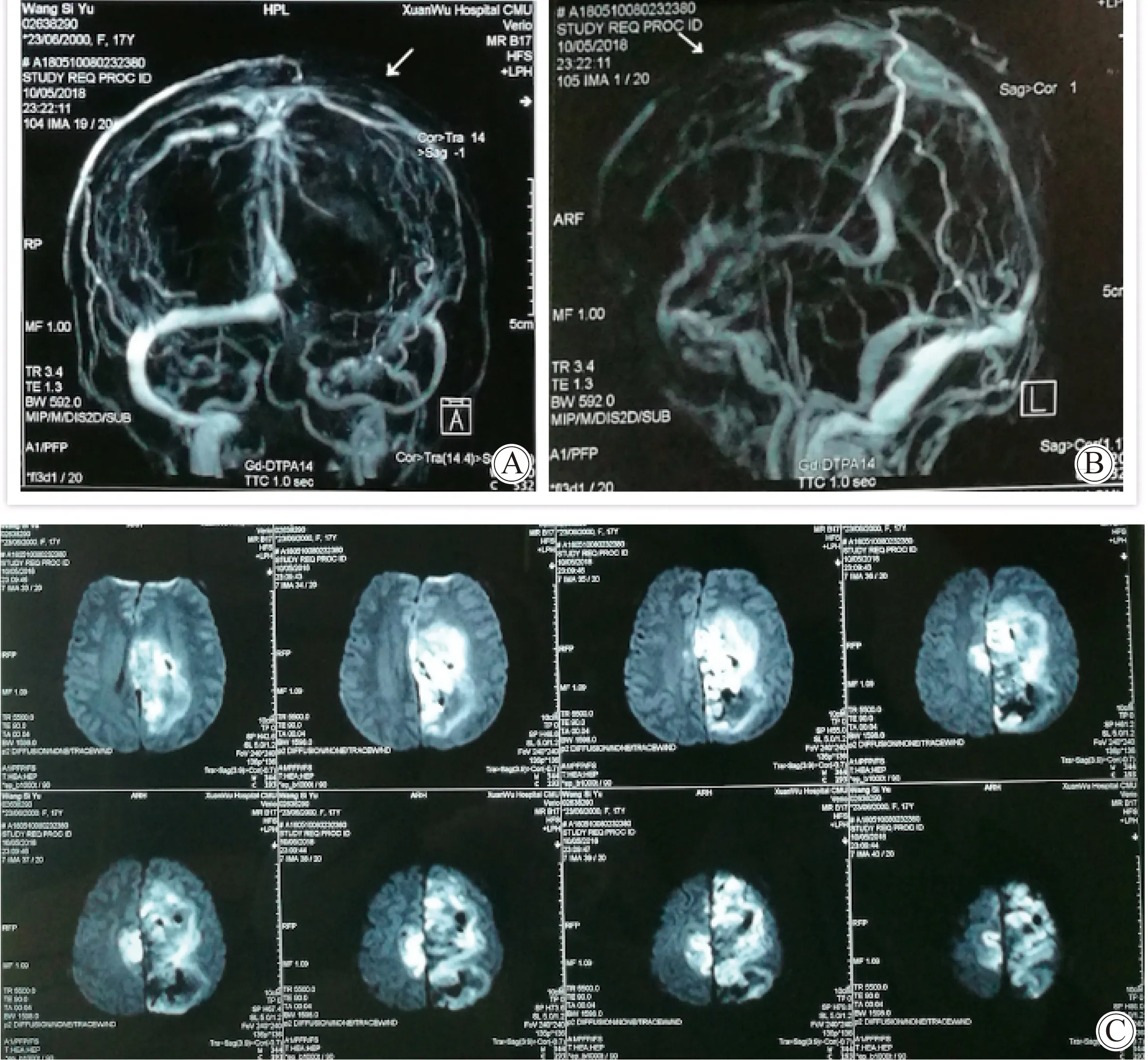
图2 入院后2 d头颅增强MRV及头颅MRIFig.2 Cranial enhanced MRV and cranial MRI 2 days after onset
A:cranial enhanced MRV: coronal position;B:cranical enhanced MRV: midsagittal position; Superior sagittal sinus thrombosis, left transverse sinus dysplasia, scalp varices at the right frontal-parietal;C:cranial MRI: vein infarction with hemorrhage at bilateral frontal-parietal(2018-5-10);MRV:magnetic resonance venogram;MRI:magnetic resonance imaging.
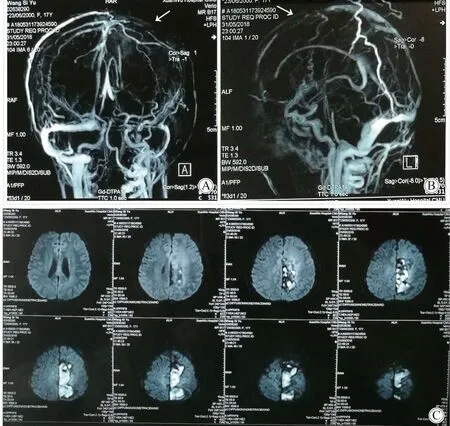
图3 发病约3周后头颅增强MRV及头颅MRIFig.3 Enhanced MRV and cranial MRI after 3 weeks of onset
A:enhenced MRV: coronal position;B:enhanced MRV: midsagittal position; The volume of strip filling defect of superior sagittal sinusdecreased;C:cranial MRI: The range of abnormal signals of bilateral frontal parietal lobes and surrounding edema decreased, and the compression of left ventricle decreased significantly (2018-5-31).MRV:magnetic resonance venogram;MRI:magnetic resonance imaging.
2 讨论
2.1 本病例讨论
该患者以头痛伴发热起病,当时头颅计算机断层扫描(computed tomography, CT)未见明显异常,而肺部CT有炎性病灶,掩盖了真实病情,没有及时完善MRV等影像学检查以明确诊断。直到患者出现偏瘫,病情开始快速进展,出现意识障碍、癫痫发作时才得以确诊。故当CVST患者有血液系统(比如再生障碍性贫血)病史,或有血红蛋白尿发作、贫血、血小板减少、溶血的证据时,应考虑到PNH的可能,并尽快完善头颅影像学检查及实验室检查,积极启动抗凝及相关对症治疗。
该患者入住笔者科室时颅内压极高,接受高压氧治疗30余次后颅内压明显减低。笔者科室曾收治多例CVST患者,行高压氧治疗后神经功能缺损症状均有明显改善。研究[2]显示,高压氧治疗可通过改善病灶血供、控制炎性反应及氧化应激反应、降低颅内压,促进神经再生等机制发挥神经保护作用。根据笔者的经验,无高压氧禁忌证的康复期患者应尽早开始高压氧治疗,并个性化制定康复治疗方案,可显著改善患者生存质量。
2.2 文献复习
2.2.1 病因与发病机制
1)AA-PNH综合征:AA是由于多种原因(主要为获得性)导致的骨髓造血衰竭综合征,引起红细胞、中性粒细胞及血小板减少,临床上表现为贫血、感染及出血。PNH是一种体细胞上Xp22.1PIGA基因突变导致的获得性造血干细胞克隆性疾病,临床主要表现为不同程度的发作性血管内溶血、骨髓造血功能衰竭及易栓症[3]。PNH和AA关系相当密切,可以相互转化且并存。严重的AA患者晚期常并发PNH,特别是应用免疫抑制剂的患者[4]。AA患者约40%可以发现PNH克隆,从某种角度看PNH可能是AA患者机体对该病进展的代偿性反应,即通过PNH克隆制造一定数量的成熟血细胞,即使这种克隆可能会导致其他的问题[5]。
AA-PNH综合征按转化和伴发情况可大致分为4型[6]:a)AA转化为PNH:最初确诊为AA,PNH确诊实验为阴性,常规治疗后外周血象恢复,骨髓由增生减低变为活跃,三系均有不同程度好转,临床治愈或缓解,AA期和PNH期可明确区分;b)PNH伴AA特征:全血细胞减少,或以贫血及血小板减少为主,网织红细胞正常或稍高,红系增生,粒系正常或减少,骨髓活检支持AA,PNH确诊实验阳性,偶发血红蛋白尿。c)AA伴PNH特征:全血细胞减少,网织红细胞不增高,淋巴细胞比例可升高,骨髓增生可减低或活跃,无血红蛋白尿等溶血表现,临床表现为AA。d)PNH转化为AA:最初确诊PNH,骨髓符合增生性贫血,血红蛋白尿发作逐渐减少至停止,血象及骨髓象均支持AA。
2)颅内静脉窦血栓:CVST病因主要包括炎性和非炎性因素。其中炎性血栓可由副鼻窦炎、乳突炎、中耳炎、面部“危险三角”感染、颅内感染等引起;非炎性血栓与血液病(血小板增多症、真性红细胞增多症、白血病、PNH等)、自身免疫性疾病(系统性红斑狼疮、白塞病)、蛋白C/S缺乏以及妊娠、产褥期、口服避孕药有关,而PNH是CVST病因中较为罕见的一种。
3)PNH合并CVST:虽然PNH患者血小板/全血细胞减低,但他们仍有较高概率(约14%~40%)发生血栓事件,其中绝大多数为静脉血栓,并倾向发生于不太常见的部位,比如肝静脉、门静脉、肠系膜静脉、脾静脉、肾静脉,以及脑静脉窦和真皮血管等更为少见的部位[7]。血栓发生的机制尚不完全明确,多种因素可能均有参与。PNH患者游离血红蛋白增多和补体系统的异常均参与了血管内皮的损伤,这可能是血栓形成的首要原因[8]。PNH患者由于细胞PIG-A基因突变,造成糖基磷脂酰肌醇(glycosyl-phosphatidyl inositol,GPI)锚连蛋白,包括一些补体调节蛋白的获得性缺陷,这种缺陷可累及红细胞、血小板、粒细胞和淋巴细胞[4]。溶血过程中释放出的游离血红蛋白能够刺激内皮细胞并清除一氧化氮,此外,补体也介导了血液中GPI缺陷细胞的损伤,导致促凝因子释放入血以及血小板的活化[1]。研究[9]显示,静脉血栓形成的风险与PNH克隆的百分比密切相关,小于50%的患者很少发生血栓,高于50%的患者风险较高,需要接受抗凝治疗。
2.2.2 临床表现
PNH患者脑静脉窦血栓形成通常累及上矢状窦,引起水肿、皮质充血和出血性梗死[7]。临床上表现为颅内压升高(头痛、呕吐和乳头状水肿)、局灶性神经功能缺损、意识状态改变、海绵窦综合征(如眼肌麻痹、球结膜水肿、眼球突出)等[10]。约40%的CVST患者会出现癫痫发作,皮质静脉血栓形成、上矢状窦血栓形成的患者出现癫痫发作的可能性更大。CVST缺乏特异性的临床表现,如果无明显卒中危险因素的患者出现顽固而持久的头痛或卒中样表现应该提高警惕,此外,对于不符合血管分布区的出血性梗死灶也应考虑到CVST的可能[11]。
2.2.3 辅助检查与诊断
由于CVST缺乏临床特异性,故诊断上主要依赖影像学检查[12]。数字减影血管造影(digital subtraction angiography,DSA)是其金标准,可直观显示静脉窦显影程度及阻塞情况,以及局灶深/浅静脉扩张,并可指导静脉溶栓[13]。颅脑CT上可表现为“条索征、空三角征”等间接征象,但阳性率不高。MRV亦能显示病灶部位静脉显影情况,简便且无创,实际应用价值较高。
PNH的确诊主要依靠实验室检查。由于经典的Ham确诊试验灵敏度和特异度均低于流式细胞术,通过流式细胞术检测外周血成熟红细胞和粒细胞CD59有无缺失已是诊断PNH最敏感最特异的指标,已成为PNH诊断的金标准[14]。PNH红细胞数量容易受输血影响,故粒细胞的阳性检出率更高且有更高的早期诊断价值。气单胞菌溶素可以特异性地与GPI锚连蛋白结合,流式细胞术荧光检测气单胞菌溶素前体及变异体(Flaer)对于较少的PNH克隆细胞检测的灵敏度更高,但只用于有核细胞的检测,不能用于评价红细胞和血小板的PNH克隆[15]。胆红素升高、酱油色晨尿、尿隐血阳性、尿含铁血黄素阳性等为血管内溶血的证据,可间接印证PNH的诊断。
2.2.4 治疗与预后
1)原发病的治疗:PNH患者急性溶血发作时可使用输血、激素冲击疗法,慢性溶血性贫血可使用叶酸、铁剂、小剂量激素和重组人源性抗补体蛋白C5单克隆抗体(eculizumab)。铁剂补充可以刺激网织红细胞增多,可产生新的对补体敏感的细胞而触发溶血,为避免这一过程,可以通过同时使用泼尼松预防[1]。血管内溶血是经典PNH的主要特征,其过程能被补体抑制剂eculizumab阻断,可以减少输血需求,减少血栓形成,延长生存期,显著改善生活质量[16]。维生素E、叶酸及碳酸氢钠等也可辅助稳定细胞膜[15]。此外,临床实践[17]证明,低剂量联合化疗可有效减轻症状,减少激素用量。迄今为止,异基因造血干细胞移植是唯一可治愈PNH的方法。然而,移植相关病死率很高,为42%,因此主要用于药物治疗无效的患者。
2)CVST的治疗:多数学者[18]认为,所有曾有血栓形成的PNH患者均需进行终身抗凝治疗,这并不会增加出血性损伤的风险,CVST伴随的颅内出血也不是抗凝治疗的禁忌证。抗凝方案通常采用低分子肝素皮下注射序贯华法林口服[19]。对于尚未发生血栓事件的PNH患者是否需要预防性抗凝治疗,因缺乏随机、前瞻性研究,故仍存在争议。CVST的治疗主要包括抗凝、脱水降颅压、病因以及合并症的治疗,当启动抗凝治疗但病情仍持续进展恶化,局部静脉溶栓治疗也是有效且相对安全的治疗手段。
3)有血栓合并症的PNH患者的预后:一项欧洲Meta分析[3]纳入了自1990年至2012年的15位PNH合并血栓形成的患者,以女性为主(12/15)。合并肝静脉血栓形成者3例。有4例以CVST为首发表现。所有患者均接受抗凝治疗。急性期死亡1例。中位生存期为9年。6年时血栓复发率为50%,多发生于未行骨髓移植或抗栓治疗的患者。死亡原因主要与肝静脉血栓形成有关。
与无血栓合并症的患者相比,合并脑静脉血栓的PNH患者长期预后较差,这是因为对他们来说,新发静脉血栓事件的概率增加了。多数情况下,即使患者长期接受抗凝治疗还是不能完全避免血栓复发。这一结果提示,脑静脉血栓形成可能是PNH严重程度的一个标志[20]。
