子宫颈细胞人乳头瘤病毒 L1 壳蛋白的表达与临床应用研究*
2019-10-24苏学英左新华谢福源
周 斌, 苏学英, 左新华, 谢福源
(1鹰潭市人民医院, 江西 鹰潭 335000; 2四川大学华西医院病理科, 四川 成都 610041; 3鹰潭市中医院检验科, 江西 鹰潭 335000; 4南昌大学第一附属医院病理科, 江西 南昌 330006)
宫颈癌是临床上最为常见的女性恶性肿瘤之一,其发生率位居女性恶性肿瘤的第2位,仅次于乳腺癌,在一些发展中国家甚至已经跃居于首位[1-2]。在我国,女性宫颈癌发病率呈现明显上升趋势,严重威胁女性朋友的生命健康[3]。大量临床证据表明,人乳头瘤病毒(human papillomavirus,HPV)感染是大多数恶性肿瘤的主要始动因素。据统计,每年约有6.5%的恶性肿瘤患者与 HPV 感染有关,在与诸多恶性肿瘤感染相关的因素中占据首位[4]。研究揭示,HPV 感染是宫颈癌及其癌前病变发生的必要条件,分子流行病调查已发现宫颈癌标本中高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)DNA 阳性率达到了99.8%[5-7]。目前临床上针对HPV 感染的预防已升级为宫颈癌预防的二级措施。研究表明,HPV L1壳蛋白(capsid protein)是HPV的主要结构蛋白,由晚期转录基因L1编码,在所有类型的HPV中高度保守,约占衣壳蛋白的90%以上[8-9]。此外,HPV L1壳蛋白是公认的机体免疫监控识别位点以及细胞免疫杀伤HPV的攻击位点。本研究旨在通过探讨HPV L1壳蛋白表达对机体免疫因子以及免疫细胞群体的影响,为进一步阐释HPV L1壳蛋白表达的检测对于宫颈细胞恶性转化以及机体细胞免疫状态判断的临床价值,提供实验依据。
材 料 和 方 法
1 主要试剂与仪器
ThinPrep 2000自动制片系统处理制成薄层涂片(用于妇科宫颈液基细胞学检测)及Cervista HPV 检测系统(用于宫颈细胞高危型人乳头瘤病毒检测)均购自HOLOGIC。赛泰®细胞/组织人乳头瘤病毒检测试剂盒检测HPV L1壳蛋白(ADVANCED);流式细胞仪(Beckman)用于免疫细胞群体(效应T细胞、NK细胞、调节性T细胞)的检测,检测试剂盒购自BD;白细胞介素2(interleukin-2,IL-2)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的ELISA试剂盒(BD)。
2 调查对象
鹰潭市人民医院2012年7月~2014年12月期间在妇科门诊就诊妇女280例,年龄22~68岁,平均(38.12±9.48)岁。280例纳入研究者参考国际癌症协会推荐的TBS(2001)分类标准包括5类:上皮内病变阴性(negative intraepithelial lesion,NILM)型179例,非典型性鳞状上皮细胞(atypical squamous cell,ASC)型41例、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LISL)型30例、高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)型28例和鳞状上皮癌(squamous-cell carcinoma,SCC)型2例。纳入标准为:(1)所有患者均符合《〈妇产科抗生素使用指南〉解读》[10]中有关于人宫颈乳头瘤病毒的临床感染诊断标准;(2)所有患者均已有性生活史;(3)均无宫颈锥切、子宫切除及宫颈手术史;(4)患者无放化疗史;(5)研究均经患者及其家属知情同意,并签署知情同意书,亦均经过医院伦理委员会审查通过。排除标准为:(1)正处于哺乳期以及妊娠期的女性;(2)合并有严重的滴虫性、霉菌性阴道炎的患者;(3)合并有心脑血管疾病以及肝肾功能不全的患者;(4)有严重精神疾病无法配合研究的患者。
3 方法
3.1标本收集 检查前 72 h,受检者禁止性生活及阴道冲洗,用窥阴器暴露宫颈后,使用棉球轻轻擦去宫颈穹窿与表面的分泌物,将专用薄层液基细胞学子宫颈刷头缓缓导入子宫颈管内,于子宫颈外口鳞柱状上皮交界处,以子宫颈外口为中心,顺时针均匀旋转7周以后取出,将宫颈脱落细胞标本置于专用液基细胞保存瓶送检。
3.2阴道镜下活检及病理 受检者均行阴道镜检查,消毒外阴、阴道和宫颈后,无明显异常者则于阴道镜下使用活检钳采取3、6、9和12点活检+宫颈搔刮,对可疑病灶进行定位活检+宫颈搔刮,组织先行固定后,经病理师切片、染色后, 由2位资深病理学专家在双盲下进行阅片。根据WHO 2014 年版国际疾病分类标准进行病理学诊断。
3.3液基薄层细胞学检测(liquid-based cytology test,TCT) 将细胞保存液中的细胞从刷子上冲洗下来,随后的制片及染色均严格按照说明书进行。采用2001年描述性宫颈细胞学诊断报告方式TBS(The Bethesds System)报告系统,细胞学结果判定:阴性为正常细胞以及组织细胞的良性改变,即NILM;阳性为各种程度的鳞状上皮细胞异常,包括ASC阳性、LSIL阳性、HSIL阳性和SCC阳性。
3.4HPV L1壳蛋白的检测 将细胞保存液中的细胞从刷子上冲洗下来后,应用赛泰®细胞/组织人乳头瘤病毒检测试剂盒检测HPV L1壳蛋白,操作严格按照说明书进行。HPV L1壳蛋白表达阳性的诊断以显微镜下阅片有1个细胞核被染红即可,计算HPV L1壳蛋白阳性率。
3.5ELISA检测血清中IL-2和TNF-α水平 所有受检者均采集清晨空腹静脉血5 mL,离心后留取血清,于-20℃条件保存,检测采用ELISA检测患者血清IL-2以及TNF-α水平。具体操作严格按照试剂盒使用说明书进行。
3.6流式细胞术检测血液中免疫细胞亚群的变化 采集受检者血液样本,离心并收集细胞,采用PBS洗涤液洗涤后,用流式细胞术按照标准程序检测细胞内活化T细胞(CD3+CD25+)、NK细胞(CD3-CD16-CD56+)以及调节性T细胞(CD4+FoxP3+)亚群的变化情况。所有操作均按照试剂盒操作说明书严格执行。
3.7Cervista HPV的检测 标本取自于TCT检测用的同一标本的同一份细胞保存液,所有HR-HPV DNA检测按照生产商的说明在Cervista技术平台中进行。Cervista HPV-DNA检测方法将HR-HPV阳性结果分为3个组,分别为A5/A6型组(包括HPV51、56和66亚型),A7型组(包括HPV 18、39、45、59和68亚型)和A9型组(包括HPV16、31、33、35、52和58亚型),任意一组阳性即判定HR-HPV DNA结果阳性。
4 统计学分析
采用SPSS 20.0统计学软件进行分析。计量资料用均数±标准差(mean±SD)表示,组间经t检验比较;计数资料采用百分位数表示,组间经2检验对比分析;样本数据的相关性采用Pearson相关性分析法进行检验。以P<0.05表示差异具有统计学意义。
结 果
1 TCT检测结果和受检者HR-HPV阳性分布情况
280例患者中,TCT检测结果显示,NILM、ASC、LSIL、HSIL和SCC 5种类型的人数分别为179例、41例、30例、28例和2例。随着TCT级别的升高,HR-HPV阳性率明显升高,在SCC中,HR-HPV阳性率达到100%,见表1。
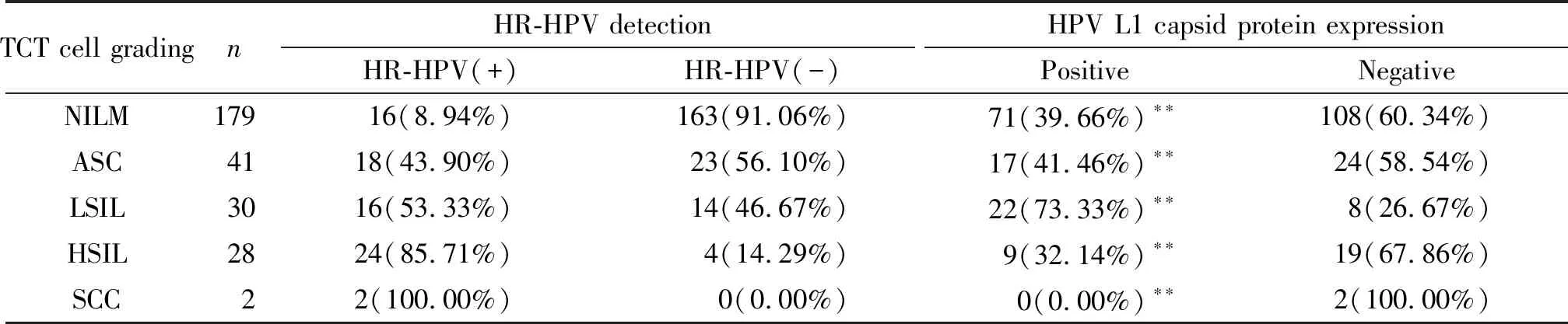
表1 TCT检测的5种类型宫颈细胞HR-HPV和HPV L1壳蛋白阳性表达检测结果比较
**P<0.01vsnegative.
2 不同分型中HPV L1壳蛋白的阳性表达
按照TCT细胞分级,280例受检者中HPV L1壳蛋白表达阳性在NILM组中占39.66%(71/179),在ASC组中占41.46%(17/41),在LSIL组中占73.33%(22/30),在HSIL组中占32.14%(9/28),在SCC组中阳性率为0%,各组比较差异具有统计学意义(均P<0.05)。按照病理活检分型,在280例受检者中HPV L1壳蛋白表达阳性119例(总阳性率74.14%),其中CIN I占64.71%(33/51),CINⅡ/Ⅲ占31.03%(9/21),两组之间比较差异有统计学显著性(P<0.05),2例SCC患者的HPV L1壳蛋白表达均为阴性。即组织病理学病变程度越重,则HPV L1壳蛋白的阳性表达率越低,见表1。
3 不同HPV L1壳蛋白表达患者的血清IL-2和TNF-α水平比较
HPV L1壳蛋白表达阳性的受检者中,血清IL-2水平为(3.20±0.70) ng/L,显著低于HPV L1壳蛋白表达阴性受检者的(5.42±0.72)ng/L(P<0.01)。HPV L1壳蛋白表达阳性的受检者中,TNF-α水平为(14.10±1.25) ng/L,明显高于HPV L1壳蛋白表达阴性的受检者(P<0.01),见表2。
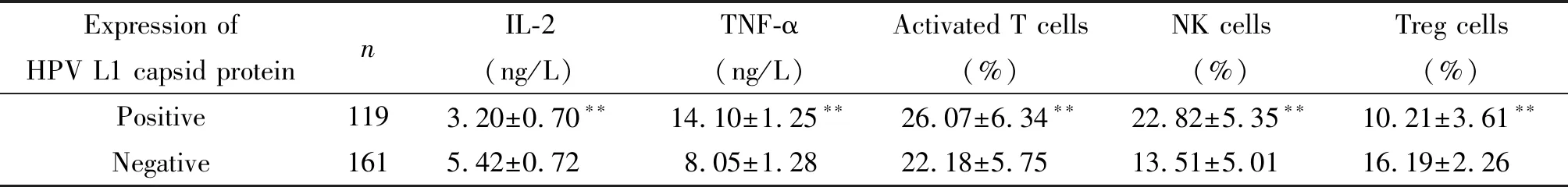
表2 不同HPV L1壳蛋白表达患者的血清IL-2和TNF-α水平比较
**P<0.01vsnegative.
4 不同HPV L1壳蛋白表达的患者血液中各免疫细胞亚群的分布
在HPV L1壳蛋白表达阳性的受检者血液中,免疫激活型细胞亚群活化T细胞以及NK细胞数明显高于HPV L1壳蛋白表达阴性的受检者(P<0.01);而HPV L1壳蛋白表达阳性的受检者血液中免疫抑制性细胞亚群Treg细胞显著低于HPV L1壳蛋白表达阴性的受检者(P<0.01),见表2。
5 HPV L1壳蛋白阳性表达与免疫细胞亚群分布的相关性分析
相关分析结果可见,HPV L1壳蛋白阳性表达与免疫激活细胞亚群分布具有正相关性,而与免疫抑制性细胞亚群分布呈现负相关性,均有统计学意义(P<0.05)。
讨 论
宫颈癌是临床妇科中最为常见的恶性肿瘤之一,据世界卫生组织统计,全球每年新发宫颈癌发病病例约有50万例[1,11],而在我国,这一数字高达14万例,对广大妇女朋友的生命健康构成了严重威胁。早期诊断对宫颈癌的治疗极其重要,目前临床上对于宫颈癌的诊断主要依据其明显的临床症状,然而,由于其症状出现较晚,导致宫颈癌的早期诊断及后期治疗受到极大阻碍[12]。
HPV感染与女性生殖道疾病的发生密切相关[13]。研究表明一半以上的宫颈癌与持续慢性的 HPV 感染密切相关[14-16]。据统计,全球每年大约有6亿女性感染HPV,但其中绝大部分感染者(约90%)均能够通过自身的免疫系统自愈,因此,免疫系统功能的正常对 HPV病毒的清除尤为重要。
HPV L1壳蛋白是一种由晚期转录基因L1编码的在所有类型的HPV中高度保守的蛋白,其含量约占到衣壳蛋白的90%以上,是学界公认的免疫反应攻击HPV病毒和病毒感染宿主细胞的主要靶位,也是HPV 疫苗形成的重要前提[17]。有研究显示,HPV L1壳蛋白表达强弱与患者宫颈损伤程度密切相关[18]。通常情况下,在HPV感染的早期阶段,即病毒复制阶段,HPV L1壳蛋白的表达增加;在HPV感染的晚期阶段,即病毒感染转化阶段,HPV L1壳蛋白的表达被抑制,直至缺失[19]。究其原因,是由于 HPV 此时已经整合到宿主基因内,从而导致HPV L1壳蛋白的产生减少[20]。
恶性肿瘤的发生发展是一个复杂的多阶段的连续性过程,受机体内外环境因素的影响。肿瘤细胞逃逸机体免疫系统监视是恶性肿瘤发生发展的重要特征之一[21]。研究表明,恶性肿瘤患者往往伴随机体免疫功能下降,从而导致机体无法有效清除恶性增殖的突变细胞,出现免疫逃逸[22]。研究揭示,HPV L1壳蛋白单体能够通过与I/II类MHC和T细胞(CD4/CD8)形成免疫复合物,从而将免疫连锁反应迅速激活,促进高浓度的免疫抗体产生,从而达到免疫清除作用[23]。众所周知,机体的免疫反应由多个系统构成,其中血清内各类免疫因子(IL-2、TNF-α、IL-8、IL-10、INF-γ等)是免疫功能调控的重要参与者,此外,机体的相关免疫细胞的增殖活化情况同样是反应机体免疫状态的重要参数。IL-2由Th1细胞分泌,可以介导细胞免疫应答,Th2细胞则参与体液免疫应答,与Th1相互制约,维持动态平衡的状态,当Th1向Th2偏移时,机体的免疫功能下降,会促进肿瘤的发生。TNF-α由单核-巨噬细胞分泌,不仅具有选择性杀伤某些肿瘤细胞的作用,还可参与免疫调控、感染、炎症反应等,可作为疾病疗效以及预后的评估指标。因此,IL-2与TNF-α均在宫颈HPV感染的发生过程中起到一定的作用。
本研究旨在探讨HPV L1壳蛋白表达的情况,与宫颈细胞恶性转化的关系,以及对于机体细胞免疫状态的影响,为阐明宫颈癌HPV L1壳蛋白表达与肿瘤免疫功能之间的关系,以期为确定其临床应用价值提供一定理论基础。结果显示HPV L1壳蛋白表达阳性率随着宫颈活检确定的宫颈病变级别的加重而呈现下降趋势,并在SCC时表达为0,各组间差异具有统计学意义; IL-2水平随着HPV L1壳蛋白表达阳性率升高而减少,TNF-α水平随着HPV L1壳蛋白表达阳性率升高而增加,经比较差异具有统计学意义; HPV L1壳蛋白阳性表达率的降低伴随着免疫激活性免疫细胞群体的增加以及免疫抑制性免疫细胞群体的减少,且二者具有相关性,组间差异具有统计学意义。与已有研究成果相比,本研究不同之处在于利用相关性分析法对HPV L1壳蛋白的阳性表达与免疫细胞亚群之间的关联性展开了分析,结果表明其阳性表达与免疫激活细胞亚群分布具有正相关性,而与免疫抑制性细胞亚群分布呈现负相关性。此点内容在既有成果中并未见到,不失为本研究的创新之所在。
综上所述,检测子宫颈细胞HPV L1 壳蛋白表达对于判断宫颈细胞恶性转化,确定机体免疫状态,阐明宫颈癌发生的免疫机制,具有重要的临床意义,值得进一步深入研究和探讨。
