雷公藤红素通过miR-17-5p和miR-155-5p靶向抑制cyclin D1阻滞A549细胞周期的研究*
2019-10-24石志刚张菡菡李美霞李雅娜
石志刚, 张菡菡, 李 然, 李美霞, 李雅娜△
(1滨州医学院, 山东 烟台 264003; 2高青县人民医院呼吸内科, 山东 高青 256300; 3青岛市中心医院内一科, 山东 青岛 266042; 4高青县人民医院妇产科, 山东 高青 256300)
肺癌是目前全球范围内发病率和死亡率最高的恶性肿瘤之一,临床上对于早期肺癌主要以手术治疗为主,但是由于早期症状不明显,大部分患者在临床确诊时已失去了手术机会。尽管现在放疗、化疗及靶向治疗等都有了较大的进展,但是患者要面临严重的副作用和高昂的治疗费用,故需要探寻更为经济低毒有效的治疗方法。
过去几十年来,草药中的天然化合物在肿瘤治疗的研究中逐渐兴起。雷公藤红素(celastrol)提取自中药雷公藤的根皮,是一种五环三萜类化合物[1-2],具有抗炎、抗肿瘤、免疫抑制、抗氧化及对抗肥胖等药理作用,现广泛应用于类风湿性关节炎和系统性红斑狼疮等疾病的治疗[3]。雷公藤红素的抗肿瘤活性近年来研究较多,首次公开报道的抗肿瘤研究是在2006年,Yang等[4]证实雷公藤红素是一种天然的蛋白酶体抑制剂,能够诱导前列腺癌细胞的凋亡。随后的多种研究证实,雷公藤红素可以抑制肺癌、乳腺癌、白血病、视网膜母细胞瘤、肝癌、结肠癌等多种癌细胞的增殖[5-7]。
微小RNA(microRNA,miRNA,miR)是一类长约22~24 nt的内源性非编码RNA,通过与靶基因mRNA的3’端非翻译区域(3’-untranslated region,3’UTR) 互补结合进而导致该mRNA分子的翻译抑制或降解,在转录后水平抑制基因的表达[8-9]。现有研究发现,雷公藤红素可通过调控miRNA来实现其对肿瘤细胞的增殖抑制、凋亡及自噬诱导等作用[10-12]。本课题组前期研究结果证实,雷公藤红素可以通过调节A549细胞和 LTEP-a-2细胞中miR-24和 miR-181b的表达来下调STAT3磷酸化水平及Bcl-2/Bax比值,诱导凋亡[13]。本实验从细胞周期角度研究了雷公藤红素对人肺腺癌A549细胞的影响,并检测了细胞周期蛋白D1(cyclin D1)及miR-17-5p和miR-155-5p的变化,探讨雷公藤红素能否通过调节cyclin D1 上游的miRNA来调控细胞周期,实现对A549细胞的生长抑制。
材 料 和 方 法
1 材料
人肺腺癌A549细胞由滨州医学院生物化学与分子生物学教研室惠赠。miR-17-5p mimics、miR-155-5p mimics、mutant-miR-17-5p(Mu-17-5p)和Mu-155-5p由上海吉玛公司合成;雷公藤红素购自北京索莱宝生物科技有限公司;DMSO、MTT和RPMI-1640培养基购自Sigma;胎牛血清购自Gibco;annexin V-FITC/propidium iodide(PI)凋亡检测试剂盒购自BD;细胞周期检测试剂盒购自南京凯基生物科技有限公司;miRNA提取及反转录试剂盒购自TaKaRa;鼠抗人cyclin D1单克隆抗体购自Proteintech;羊抗鼠IgG购自ABclonal。
2 主要方法
2.1细胞培养 A549细胞用含10%胎牛血清的RPMI-1640培养基于37 ℃、5% CO2培养箱中培养,隔天换液,3 d传代。
2.2MTT法检测细胞活力抑制率 实验共分5组,分别为0、1.5、3、4.5和6 μmol/L雷公藤红素处理组。将处于对数生长期的A549细胞以每孔6.0×103个的密度接种于96孔板,24 h后分别加入含有0、1.5、3、4.5和6 μmol/L雷公藤红素的RPMI-1640培养基,每个浓度设6个复孔。培养24 h后每孔加入含10% MTT的无血清RPMI-1640培养基100 μL继续培养4 h,然后每孔更换为DMSO 100 μL,避光振荡10 min,酶标仪检测,波长为490 nm,读取各孔吸光度(A)值。计算公式如下:细胞活力抑制率(%)=(1-A实验组/A对照组)×100%。
2.3流式细胞术及annexin V-FITC/PI双染检测细胞凋亡情况 实验共分5组,分别为0、1.5、3、4.5和6 μmol/L雷公藤红素处理组,每组重复3次。对数生长期A549细胞以每孔5.0×105个接种于6孔板,24 h后分别加入含有0、1.5、3、4.5和6 μmol/L雷公藤红素的RPMI-1640培养基正常培养24 h,24 h后收集细胞沉淀,PBS洗涤2次,500 μL 1×binding buffer 重悬细胞,加入5 μL annexin V-FITC和5 μL PI混匀,室温避光孵育15 min,1 h内用流式细胞仪检测。
2.4流式细胞仪检测3 μmol/L雷公藤红素对A549细胞周期的影响 实验共分2组,分别为0 μmol/L和3 μmol/L雷公藤红素处理组,每组重复3次。对数生长期A549细胞以每孔5.0×105个接种于6孔板,24 h后分别加入含有0和3 μmol/L雷公藤红素的RPMI-1640培养基培养24 h,24 h后收集细胞沉淀并用PBS制备成浓度为1×109/L的单细胞悬液,70%的冰乙醇固定细胞悬液,4 ℃过夜,PBS清洗细胞后收集沉淀,加入100 μL RNase A,37 ℃水解30 min,再加入400 μL PI 4 ℃避光反应30 min,上流式细胞仪检测。
2.5Western blot检测不同浓度的雷公藤红素对A549细胞cyclin D1表达水平的影响 实验分组及雷公藤红素细胞处理同2.3。雷公藤红素处理细胞48 h后,收集细胞沉淀并加入裂解液裂解细胞,提取总蛋白,10%的SDS-PAGE进行电泳分离,电泳结束后将蛋白转移至PVDF膜,封闭液封闭2 h,加鼠抗人cyclin D1单抗4 ℃封闭过夜,羊抗鼠IgG封闭2 h,曝光显影并拍照。
2.6Real-time PCR检测3 μmol/L雷公藤红素对A549细胞中miR-17-5p和miR-155-5p表达的影响 实验分组及雷公藤红素细胞处理同2.4。雷公藤红素处理细胞24 h后胰酶消化收集细胞,每孔所收细胞沉淀中加入RNAiso for Small RNA 1 mL,提取细胞总小RNA,然后将小RNA加尾、逆转录生成cDNA。 以该cDNA为模板,5S rRNA为内参照,5’-CAAAGTGCTTACAGTGCAGGTAG-3’为miR-17-5p上游引物序列,5’-CTGTTAATATGCTAATCGTGATAGGG-3’为miR-155-5p上游引物序列,5’-GCCATACCACCCTGAACG-3’为5S rRNA的上游引物序列,5’-AACATGTACAGTCCATGGATG-3’为通用下游引物,进行real-time PCR。反应总体系为20 μL。反应条件为:95 ℃预变性1 min;每个循环包括95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸20 s,共40个循环;60 ℃至95 ℃绘制熔解曲线。
2.7荧光显微镜和流式细胞术检测GFP表达情况 实验分5组,分别为:(1)阴性对照组(转染物为1 μg negative control mimics和1 μg pcDNA-GFP-cyclin D1-3’UTR 质粒);(2)pcDNA-GFP-cyclin D1-3’UTR 和miR-17-5p 共转染组(以下简称miR-17-5p组,转染物为 1 μg miR-17-5p mimics和1 μg pcDNA-GFP-cyclin D1-3’UTR质粒);(3)pcDNA-GFP-cyclin D1-3’UTR 和miR-155-5p共转染组(以下简称miR-155-5p组,转染物为1 μg miR-155-5p mimics和1 μg pcDNA-GFP-cyclin D1-3’UTR质粒);(4)pcDNA-GFP-cyclin D1-3’UTR 和Mu-17-5p 共转染组(以下简称Mu-17-5p组,转染物为 1 μg Mu-17-5p 和1 μg pcDNA-GFP-cyclin D1-3’UTR质粒);(5)pcDNA-GFP-cyclin D1-3’UTR 和Mu-155-5p共转染组(以下简称Mu-155-5p组,转染物为1 μg Mu-155-5p 和1 μg pcDNA-GFP-cyclin D1-3’UTR质粒)。对数生长期的A549细胞接种于6孔板,Lipofectamine 2000作为转染试剂,无血清RPMI-1640培养基为基质,转染后 6~8 h换液,48 h后荧光倒置显微镜下观察各组荧光强度并拍照,拍照结束后,收集各组细胞经流式细胞仪检测各组GFP的表达情况。
2.8miR-17-5p mimics、miR-155-5p mimics、Mu-17-5p和 Mu-155-5p转染A549细胞 实验共分为6组,分别为空白对照组、阴性对照组、miR-17-5p转染组、miR-155-5p转染组、Mu-17-5p转染组和Mu-155-5p转染组。对数生长期的A549细胞接种于6孔板,次日清晨细胞融合至70%左右时进行转染。空白对照组加入600 μL不含血清的RPMI-1640培养基;阴性对照组、miR-17-5p转染组、miR-155-5p转染组、Mu-17-5p转染组和Mu-155-5p转染组分别用Lipofectamine 2000转染1 μg negative control mimics、1 μg miR-17-5p mimics、1 μg miR-155-5p mimics、1 μg Mu-17-5p和1 μg Mu-155-5p, 6~8 h后换为RPMI-1640完全培养基正常培养。24 h后检测转染后miR-17-5p和miR-155-5p的表达水平(24 h后收集细胞沉淀,提取总小RNA,加尾,逆转录生成cDNA,行real-time PCR检测,步骤如前所述)。
2.9Western blot检测miR-17-5p inhibitor和miR-155-5p inhibitor分别和雷公藤红素共同处理A549细胞后对cyclin D1表达水平的影响 实验分4组,分别为正常对照组、3 μmol/L雷公藤红素处理组、3 μmol/L雷公藤红素+ miR-17-5p inhibitor 处理组和3 μmol/L雷公藤红素+ miR-155-5p inhibitor 处理组。各组处理细胞48 h后提取细胞总蛋白,行Wes-tern blot检测(步骤如前所述),检测各组细胞cyclin D1的蛋白水平。
3 统计学处理
运用Graphpad Prism 5进行统计学分析。实验数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 雷公藤红素抑制A549细胞活力,且呈一定的浓度依赖性
0、1.5、3、4.5和6 μmol/L雷公藤红素作用于A549细胞后,细胞活力抑制率升高(P<0.05),到达3 μmol/L后显著升高(P<0.01),见图1。这提示雷公藤红素可以有效抑制A549细胞的活力,且表现出一定的浓度依赖性。
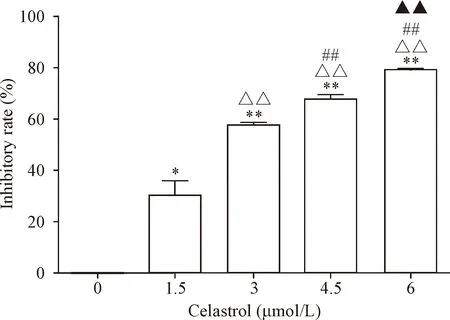
Figure 1. The effects of celastrol at various concentrations on the viability of A549 cells detected by MTT assay. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group;△△P<0.01vs1.5 μmol/L group;##P<0.01vs3 μmol/L group;▲▲P<0.01vs4.5 μmol/L group.
图1 MTT检测不同浓度的雷公藤红素对A549细胞活力的影响
2 光镜下观察到达雷公藤红素可使A549细胞形态发生改变
0、1.5、3、4.5和6 μmol/L的雷公藤红素处理A549细胞24 h后,镜下观察细胞形态可见加药组贴壁舒展细胞数目减少,细胞皱缩,变圆,脱壁,悬浮死细胞增多,3 μmol/L最接近半数致死浓度,到达4.5 μmol/L和6 μmol/L细胞基本全部死亡,见图2。
3 雷公藤红素可诱导A549细胞凋亡,并呈现一定的浓度依赖性
流式细胞术检测结果显示,雷公藤红素处理组细胞24 h后,0、1.5、3、4.5和6 μmol/L组细胞凋亡率分别为为6.02%、6.72%、55.12%、68.64%和81.80%,可见雷公藤红素可以诱导A549细胞凋亡,呈现一定的浓度依赖性,其中3 μmol/L最接近半数致死浓度,和光镜下观察结果一致,见图3。
4 雷公藤红素阻滞了A549的细胞周期
流式细胞术检测细胞周期结果显示,0 μmol/L和3 μmol/L雷公藤红素处理组G1期细胞所占比例分别为64.561%和79.681%,S期细胞所占比例为25.417%和18.255%,G2期细胞所占比例分别为10.022%和2.064%,药物作用组G1期细胞比例增加, G2期细胞比例减少(P<0.05),说明药物作用后A549细胞被阻滞于G1期,见图4。
5 雷公藤红素可下调A549细胞中cyclin D1蛋白的表达
Western blot结果显示,3、4.5和6 μmol/L的雷公藤红素处理组cyclin D1蛋白表达较对照组均显著降低(P<0.01或P<0.05),见图5。
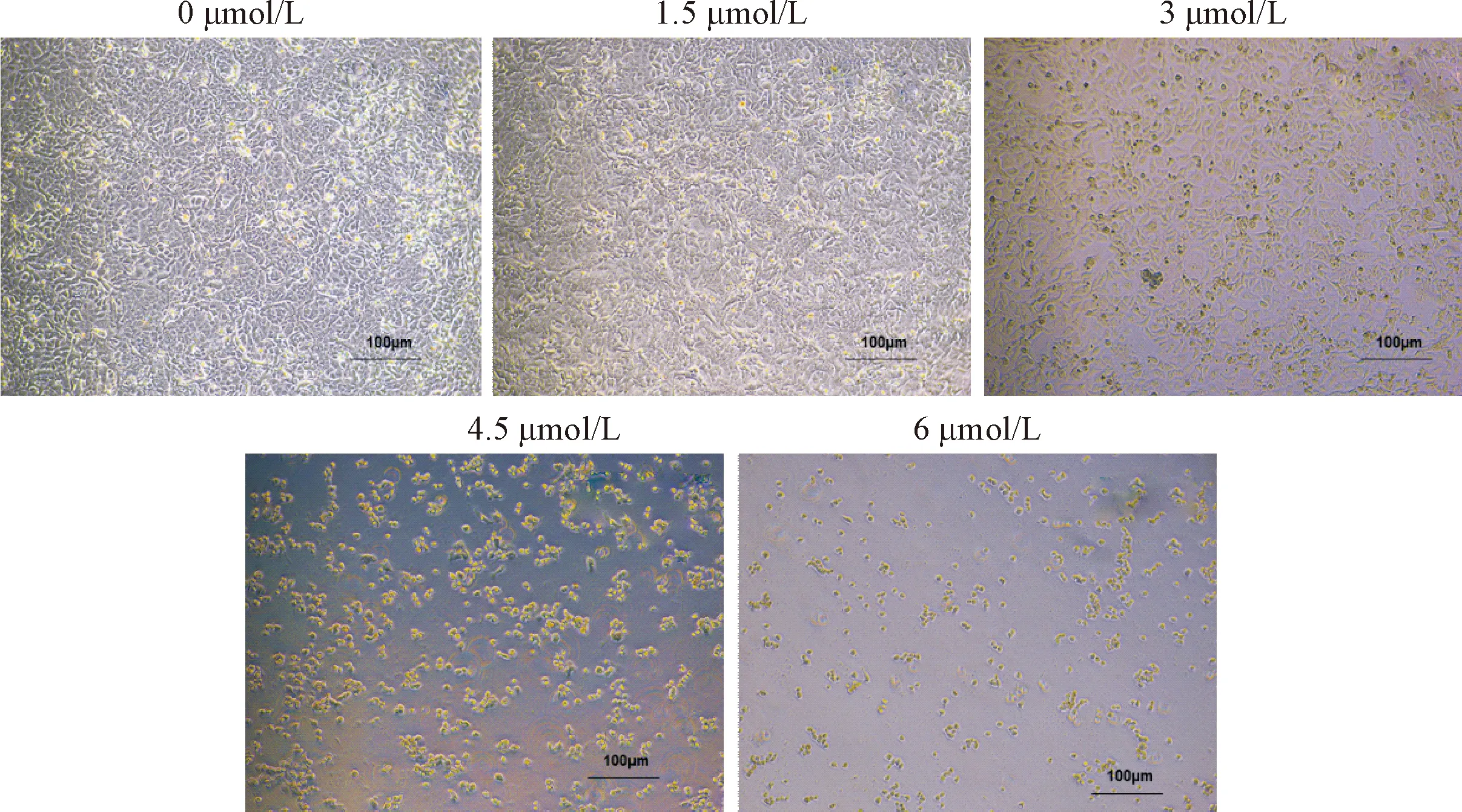
Figure 2. Microscopic analysis of A549 cell morphological changes after treatment with celastrol at various concentrations (×100).
图2 显微镜下分析不同浓度雷公藤红素对A549细胞形态的影响
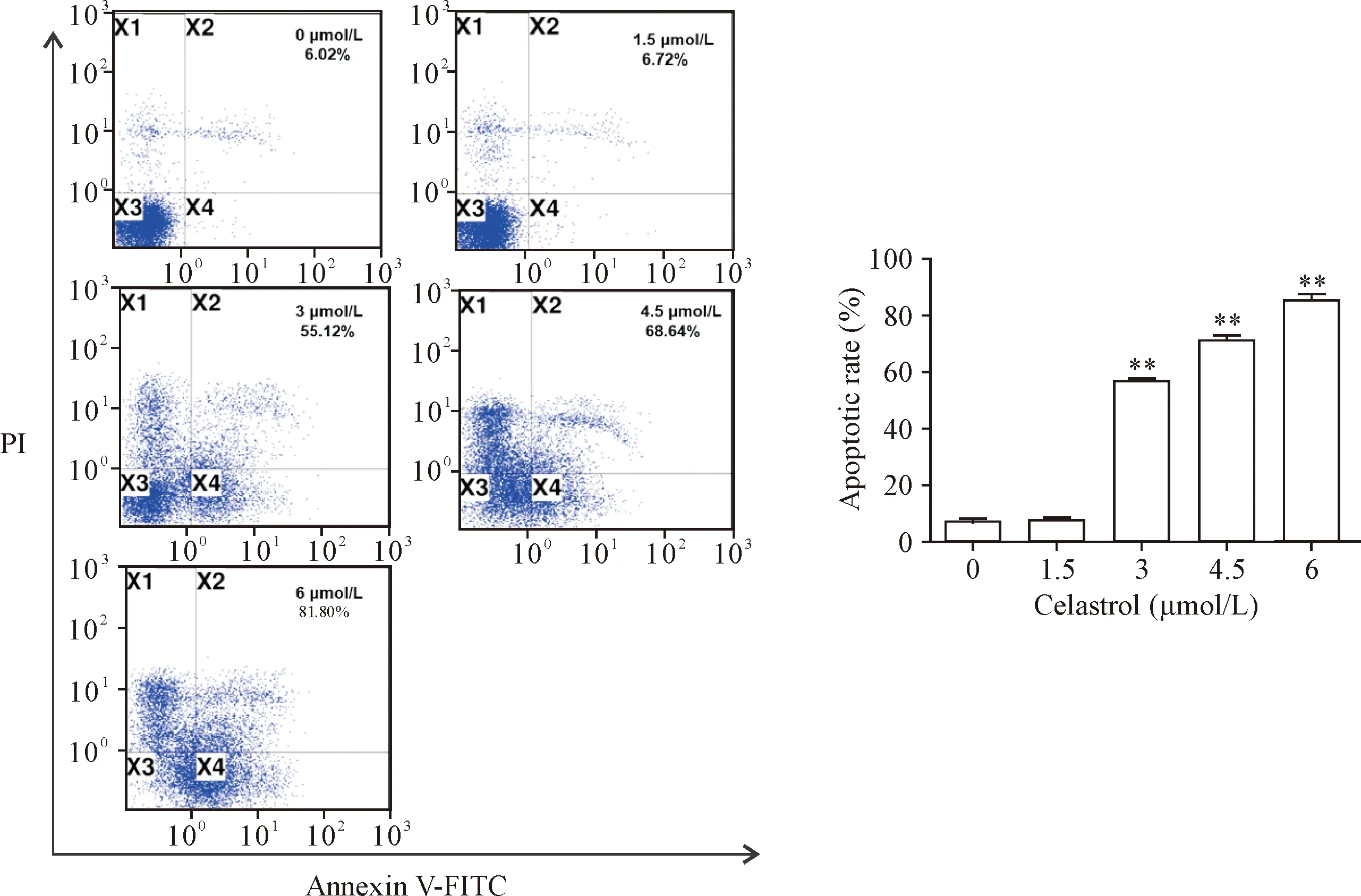
Figure 3. Flow cytometry analysis was used to evaluate the apoptosis of A549 cells after treatment with celastrol at various concentrations. Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图3 流式细胞术检测不同浓度雷公藤红素对A549细胞凋亡的影响
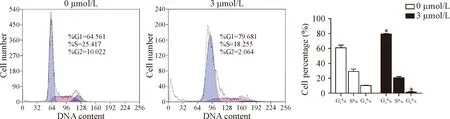
Figure 4. Flow cytometry analysis was used to evaluate the cell cycle of A549 cells treatment with celastrol at 3 μmol/L. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图4 流式细胞术检测3 μmol/L雷公藤红素对A549细胞周期的影响
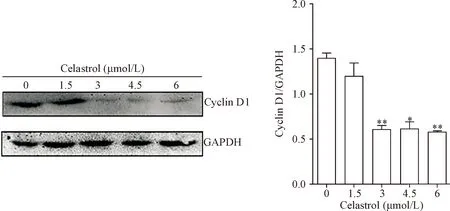
Figure 5. Western blot was used to detect the protein levels of cyclin D1 after treatment with celastrol at various concentrations. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group.
图5 Western blot 检测不同浓度的雷公藤红素作用后cyclin D1的表达
6 雷公藤红素上调A549细胞中miR-17-5p和miR-155-5p的表达
Real-time PCR结果显示,3 μmol/L的雷公藤红素处理组miR-17-5p和miR-155-5p的表达水平较对照组显著升高(P<0.01), 见图6,提示该浓度的雷公藤红素可有效上调A549细胞中miR-17-5p和miR-155-5p的表达。

Figure 6. The effect of celastrol at 3 μmol/L on the expression of miR-17-5p/miR-155-5p in the A549 cells detected by real-time PCR. Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图6 Real-time PCR检测 3 μmol/L雷公藤红素对A549细胞miR-17-5p和miR-155-5p表达的影响
7 CCND1是miR-17-5p和miR-155-5p的靶基因
通过microRNA.org(http://www.microrna.org/)生物学信息软件预测,显示cyclin D1的3’-UTR存在miR-17-5p和miR-155-5p的结合位点,即CCND1(cyclin D1的基因)是miR-17-5p和miR-155-5p的靶基因,并针对miR-17-5p和miR-155-5p与cyclin D1 3’-UTR 的结合序列设计合成相应突变体Mu-17-5p和Mu-155-5p,见图7。
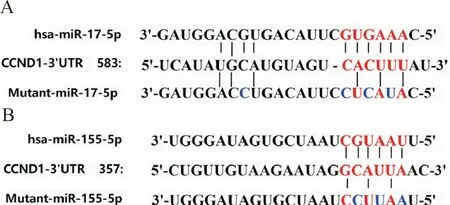
Figure 7. The targeting sites of miR-17-5p (A) and miR-155-5p (B) on cyclin D1 and the sequences of Mu-17-5p and Mu-155-5p.
图7 Cyclin D1上miR-17-5p和miR-155-5p的结合位点及Mu-17-5p和Mu-155-5p序列
8 miR-17-5p和miR-155-5p直接靶向cyclin D1的3’-UTR发挥作用
GFP检测结果显示,miR-17-5p组和miR-155-5p组GFP荧光强度明显较阴性对照组减弱,而将其与cyclin D1 3’UTR结合的种子序列突变后的突变体Mu-17-5p和Mu-155-5p转染后荧光强度与对照组相比较没有明显变化,见图8A。流式细胞术结果显示阴性对照组、miR-17-5p组、miR-155-5p组、Mu-17-5p组和Mu-155-5p组GFP阳性细胞率分别为15.1%、9.93%、7.3%、15.14%和13.79%,与阴性对照组及各自突变体组相比较,miR-17-5p组和miR-155-5p GFP阳性率显著降低(P<0.05),见图8B。以上结果提示miR-17-5p和miR-155-5p直接靶向cyclin D1发挥作用,可以有效下调cyclin D1表达。
9 miR-17-5p和miR-155-5p mimics转染下调cyclin D1蛋白的表达水平
Real-time PCR结果显示,miR-17-5p mimics和miR-155-5p mimics转染A549细胞后,相应的miRNA表达升高(P<0.01),见图9。同时Western blot结果显示,和空白对照组和阴性对照组相比,miR-17-5p和miR-155-5p转染组的cyclin D1蛋白表达均显著降低(P<0.01),见图10。
10 miR-17-5p inhibitor和miR-155-5p inhibitor可阻止雷公藤红素对cyclin D1蛋白表达的抑制作用
Western blot结果显示,当应用miR-17-5p inhibitor或miR-155-5p inhibitor与雷公藤红素共同处理A549细胞后,雷公藤红素对cyclin D1表达的下调作用被阻止,见图11。
讨 论
雷公藤红素可以调节包括肿瘤增殖、凋亡、血管生成和转移等多个过程。Chang等[6]发现雷公藤红素对乳腺癌和结肠癌等9种癌细胞系有显著的抑制作用,Nagase等[5]的研究发现雷公藤红素可以抑制急性髓系白血病HL-60细胞的生长增殖,闵红波等[7]发现雷公藤红素可诱导视网膜母细胞瘤Y79细胞凋亡。本课题前期研究中,确定了到达一定浓度的雷公藤红素可以诱导A549细胞凋亡、抑制增殖,在此基础上,进一步检测了雷公藤红素对A549细胞周期的影响,发现雷公藤红素能够引起G1期的阻滞,这可能是其抑制增殖诱导凋亡的诱因,同时,因为阻滞是在G1期,由此我们提出设想——这种阻滞是否和cyclin D1相关?
cyclin D1是由人类CCND1基因所编码的蛋白质,调节细胞通过G1/S检查点,是检测G1期增殖信号的关键靶点[14]。cyclin D1的过表达可导致细胞通过G1/S检查点的过度进行,从而促进细胞增殖,导致肿瘤形成[15]。目前,cyclin D1的过表达已被证明与多种肿瘤的发病和进展有关[16]。cyclin D1在肺癌中的研究早在1998年就有报道,Kong等[17]利用免疫组化法分析了104例手术切除的肺癌组织,发现约70%的肿瘤表达cyclin D1;Papay等[18]发现cyclin D1水平升高与NSCLC发生脑转移有关;Zhang等[19]发现NSCLC组织中cyclin D1的mRNA和蛋白水平均较正常肺组织升高,以上结果都提示,cyclin D1参与了肺癌的发生发展过程,它升高所致的细胞周期失调可能作为临床肺癌治疗的靶点。本研究中,我们检测了雷公藤红素作用后cyclin D1的表达,发现其表达水平显著降低,验证了我们的设想,那么雷公藤红素下调cyclin D1的分子机制又是什么?
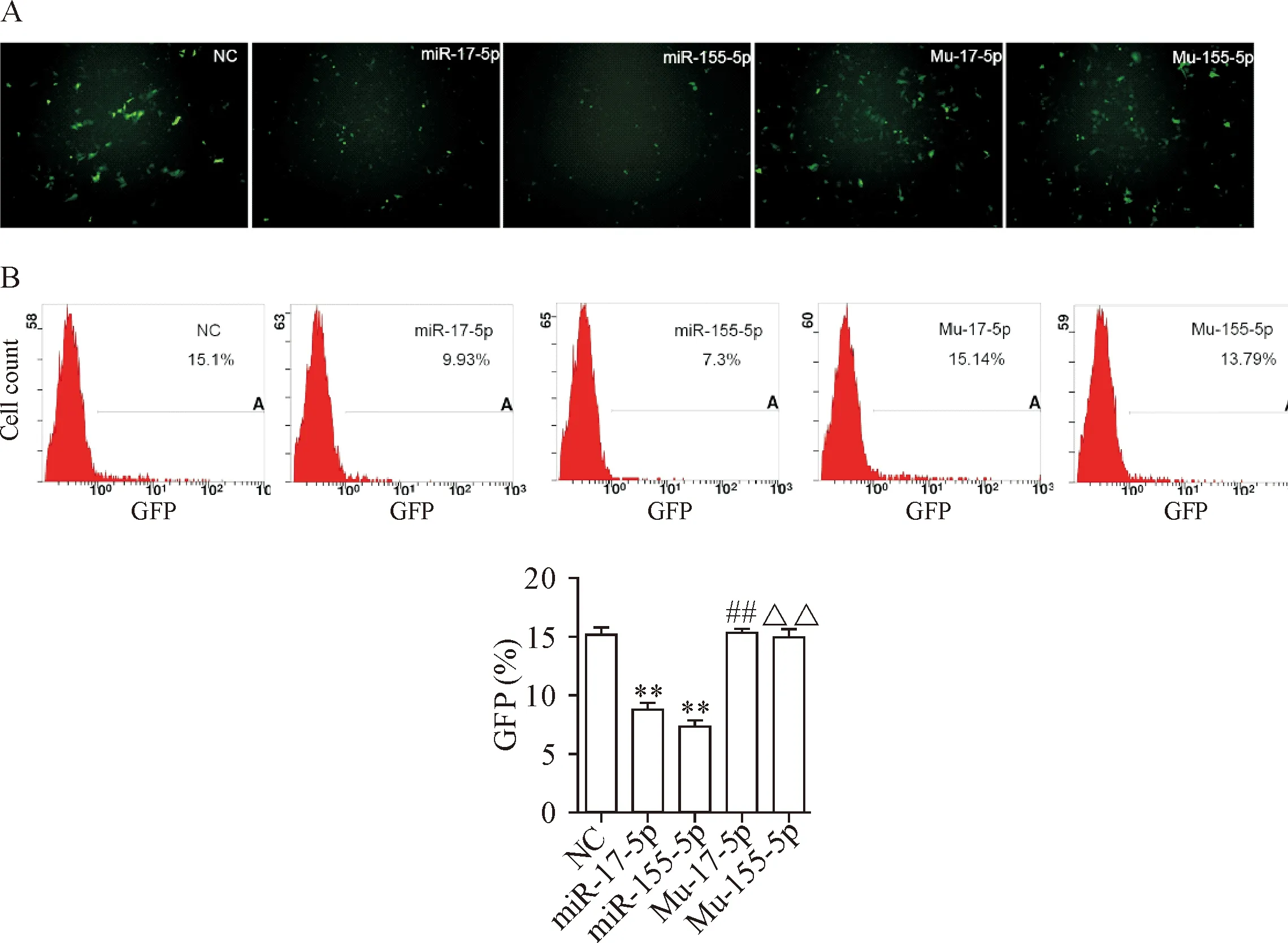
Figure 8. The expression of GFP was observed by fluorescence microscopy (A;×100) and flow cytometry (B). Mean±SD.n=3.**P<0.01vsNC group;##P<0.01vsmiR-17-5p group;△△P<0.01vsmiR-155-5p group.
图8 荧光显微镜及流式细胞术检测GFP表达
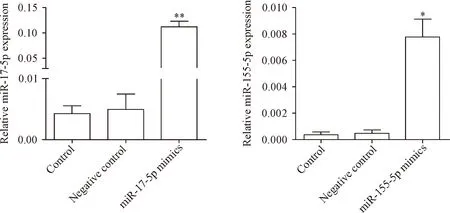
Figure 9. Real-time PCR was used to detect the expression of miR-17-5p/miR-155-5p after treatment of A549 cells with miR-17-5p/miR-155-5p mimics. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图9 Real-time PCR检测miR-17-5p/miR-155-5p mimics转染A549细胞后相应miRNA表达的变化
近年来,有研究发现miRNA参与了cyclin D1表达的调控,Zhang等[20]的研究证实miR-365通过靶向抑制cyclin D1抑制了血管平滑肌细胞的增殖,Li等[21]的研究发现miR-520a-3p诱导乳腺癌细胞凋亡是通过直接靶向抑制CCND1和CD44来实现的。为了进一步研究雷公藤红素是否是通过调节相关miRNAs来下调cyclin D1的表达,我们使用miRNA分析软件预测 cyclin D1的3’-UTR存在miR-17-5p和miR-155-5p的结合位点,并检测了A549细胞中这2种miRNAs在雷公藤红素处理后的表达情况,结果显示有效浓度的雷公藤红素作用后无论miR-17-5p还是miR-155-5p均会有明显的表达上调,这提示我们miR-17-5p和miR-155-5p很可能是雷公藤红素调控cyclin D1表达的中间物质。为了验证这一想法,随后的实验中,我们验证了miR-17-5p和miR-155-5p分别与cyclin D1的靶向关系,应用本实验室前期合成的pcDNA-GFP-cyclin D1-3’UTR重组质粒与miR-17-5p、miR-155-5p分别进行共转染,并且设计合成了miR-17-5p、miR-155-5p针对cyclin D1-3’UTR结合区的突变体Mu-17-5p和Mu-155-5p作为对照,结果证实了miR-17-5p/miR-155-5p与cyclin D1-3’UTR的靶向关系。进一步实验中,我们将miR-17-5p inhibitor和miR-155-5p inhibitor与雷公藤红素共同处理A549细胞,发现雷公藤红素引起的cyclin D1表达下调被阻止。以上这些结果均提示雷公藤红素下调cyclin D1可能是调控了miR-17-5p和miR-155-5p的表达来实现的,进一步验证通过转染miR-17-5p和miR-155-5p mimics到A549细胞中来检测cyclin D1的表达,再一次证实这个结果。
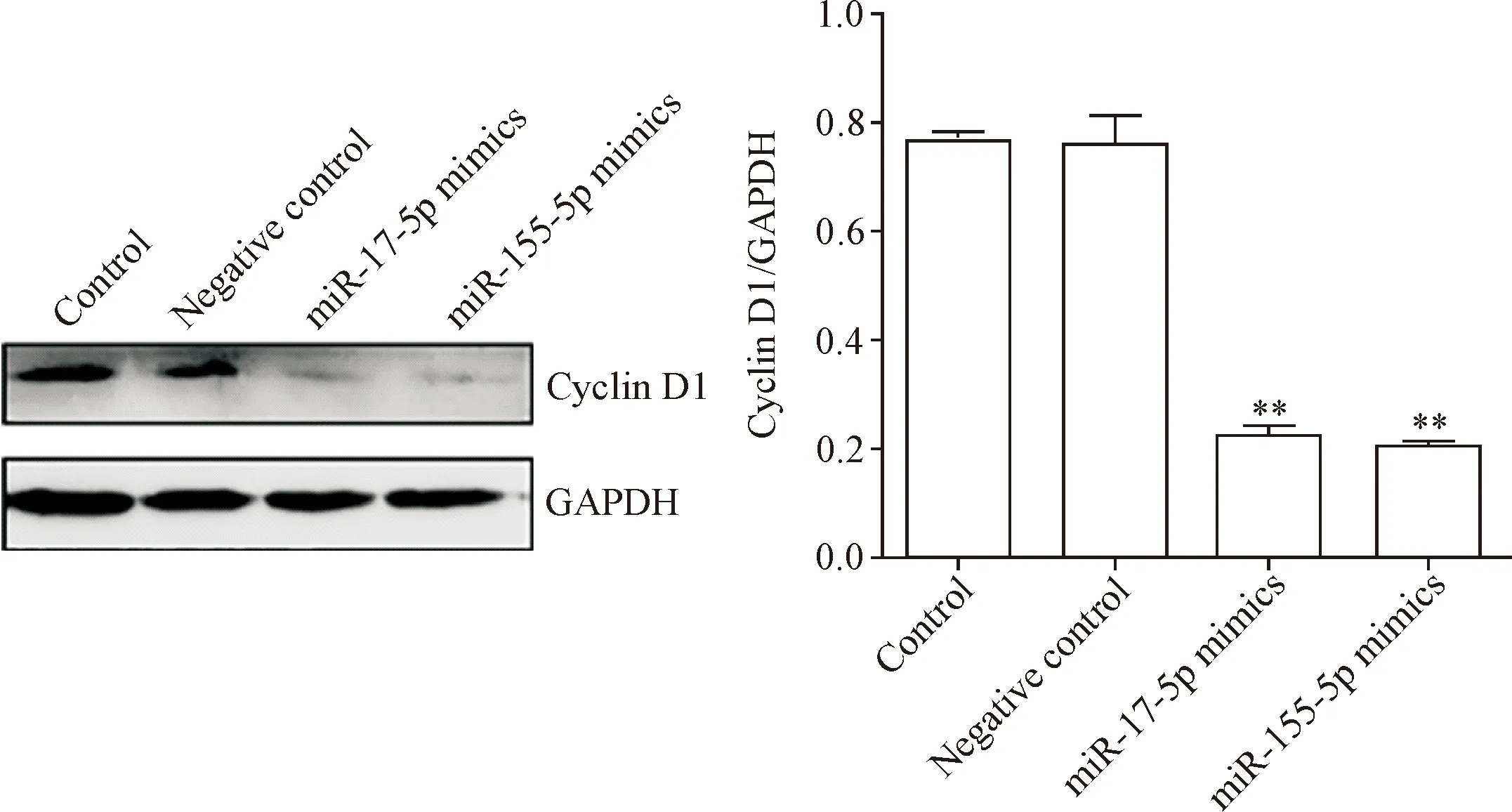
Figure 10. The protein levels of cyclin D1 in A549 cells after transfection with miR-17-5p/miR-155-5p mimics. Mean±SD.n=3.**P<0.01vscontrol group.
图10 Western blot检测miR-17-5p和miR-155-5p转染后cyclin D1的蛋白水平
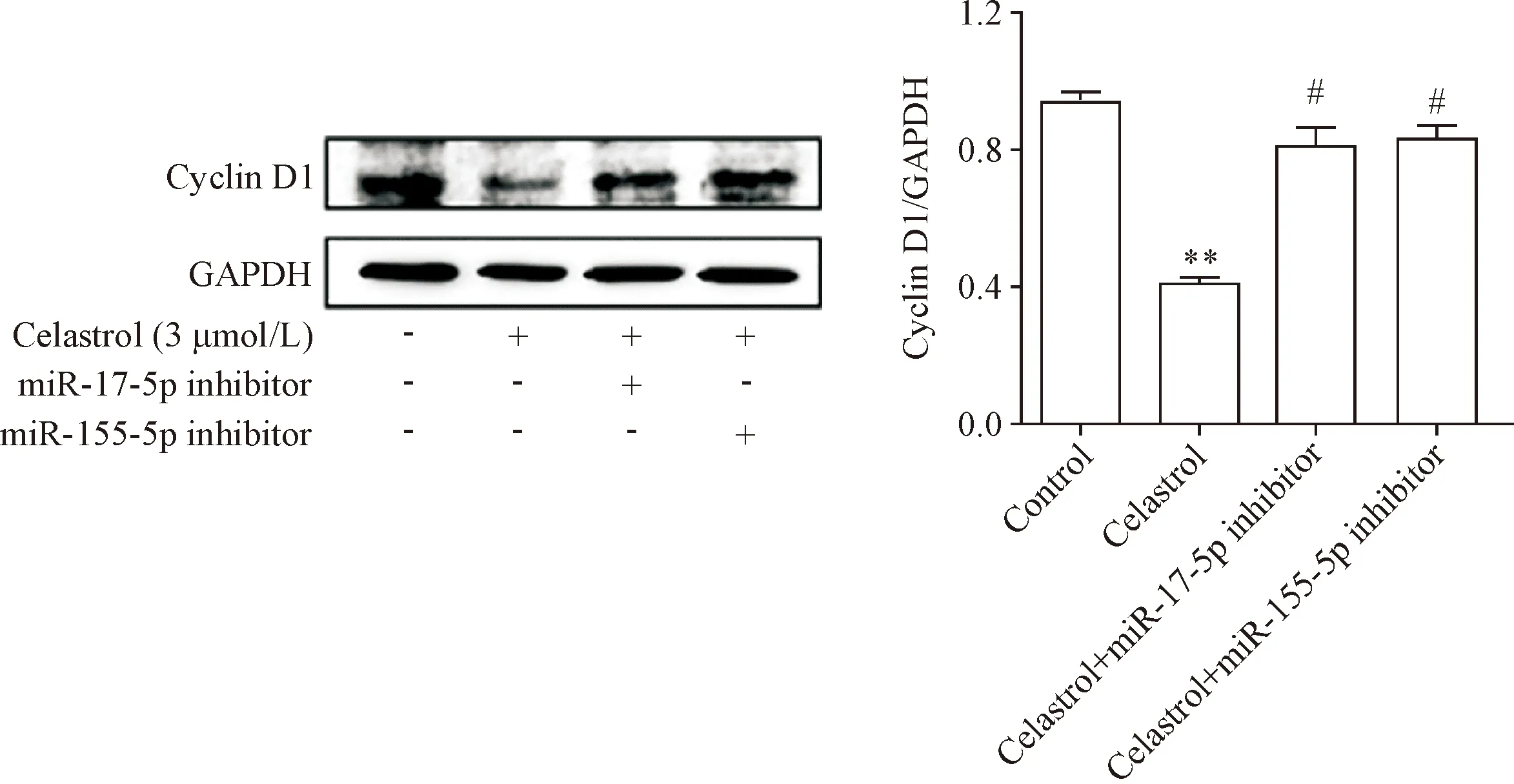
Figure 11. The protein levels of cyclin D1 in A549 cells after treatment with celastrol (3 μmol/L) and transfection with miR-17-5p inhibitor. Mean±SD.n=3.**P<0.01vscontrol gprup;#P<0.05vscelastrol group.
图11 Western blot检测miR-17-5p inhibitor和miR-155-5p inhibitor与雷公藤红素共同作用后cyclin D1的表达变化
综合上述结果,我们认为雷公藤红素通过上调miR-17-5p和miR-155-5p的表达来靶向抑制cyclin D1,进而导致细胞周期G1期的阻滞,这是雷公藤红素阻滞A549细胞周期、抑制肿瘤细胞增殖的重要机制之一。本研究为雷公藤红素作为肺癌治疗的临床药物提供了理论依据。
