KLF6基因对THP-1细胞诱导分化的巨噬细胞凋亡的影响*
2019-10-24焦光美单海雷张晓璇康玲伶窦志杰高燕军
马 征, 焦光美, 单海雷, 张晓璇, 康玲伶, 窦志杰, 高燕军
(承德医学院附属医院神经内科, 河北 承德 067000)
动脉粥样硬化(atherosclerosis,AS)是多种心脑血管疾病共同的病理基础,其发生涉及单核细胞来源的巨噬细胞、内皮细胞、泡沫细胞和T淋巴细胞等多种细胞间复杂的相互作用[1-2]。大量研究表明,巨噬细胞凋亡可通过降低细胞数量、释放胆固醇、释放促血栓物质等途径促进AS易损斑块形成[3],因此,抑制AS相关的巨噬细胞凋亡对其治疗具有重要意义。巨噬细胞凋亡调控体系复杂,氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)等各种刺激因素均参与巨噬细胞凋亡调控过程[4]。已有研究表明,近些年发现的锌指转录因子Kruppel样因子6(Kruppel-like factor 6,KLF6)与脂代谢和炎症等生理病理状态有关[5]。最新研究表明,KLF6是调控巨噬细胞极化的关键因子之一,通过对巨噬细胞过氧化酶体增殖物激活受体γ抑制M2型抗炎因子表达[6];也有研究指出,KLF6可通过促进ATP结合盒转运蛋白A1的表达抑制ox-LDL诱导的巨噬细胞胆固醇蓄积[7]。以上研究提示KLF6可能在AS发病过程中有重要作用。本研究将重组体pcDNA3.1-KLF6转染THP-1细胞诱导分化的巨噬细胞,旨在探讨过表达KLF6对ox-LDL诱导巨噬细胞凋亡的影响,为进一步研究AS的发病机制提供实验依据。
材 料 和 方 法
1 细胞试剂和仪器
人单核细胞株THP-1购自美国模式培养物集存库(American Type Culture Collection,ATCC)。佛波脂(phorbol myristate acetate,PMA)购自碧云天生物技术研究所;胎牛血清(fetal bovine serum,FBS)及RPMI-1640培养液均购自Gibco;ox-LDL购自Sigma;鼠抗人KLF6抗体、鼠抗人Bcl-2抗体、鼠抗人Bax抗体和p-AKT抗体均购自CST;MTT试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)、pcDNA3.1载体及H2DCF-DA荧光探针均购自Sigma;细胞凋亡试剂盒和流式细胞仪均购自BD。酶标仪购自Thermo。
2 方法
2.1细胞培养 THP-1细胞使用含10% FBS的RPMI-1640培养液,在培养箱中常规培养。以每孔1×105个细胞将传4~6代的细胞接种至6孔板中,细胞生长约90%融合时,加入160 nmol/L的PMA预处理细胞24 h,将其诱导分化为 THP-1巨噬细胞,更换培养基。
2.2实验分组 将诱导分化的THP-1巨噬细胞随机分为:pcDNA3.1组,转染空载体pcDNA3.1;ox-LDL组,50 mg/L的ox-LDL刺激细胞24 h;ox-LDL+pcDNA3.1组,细胞转染pcDNA3.1 24 h(转染浓度100 nmol/L),再加入50 mg/L的ox-LDL刺激24 h;ox-LDL+pcDNA3.1-KLF6组,细胞转染pcDNA3.1-KLF6(转染浓度100 nmol/L) 24 h,再加入50 mg/L的ox-LDL刺激24 h,其中pcDNA3.1的转染参照LipofectamineTM2000试剂盒说明。细胞达60%~70%生长融合时进行转染。制备pcDNA3.1与脂质体复合物,将复合物加入24孔板相应孔内,于培养箱内继续孵育4 h,更换为含FBS的培养基。各组细胞处理24 h,收集细胞用于后续实验。
2.3Western blot实验 细胞裂解液提取总蛋白,BCA试剂盒对蛋白浓度定量,制备5%浓缩胶及12%分离胶。将蛋白样品与上样缓冲液混匀,100 ℃变性5 min。每孔道上样40 μg变性蛋白,经SDS-PAGE分离、转PVDF膜及封闭膜后,4 ℃孵育 I 抗过夜(KLF6、Bcl-2、Bax和p-AKT抗体,1∶1 000),洗膜,加HRP标记的羊抗鼠 II 抗(1∶3 000),37 ℃孵育1 h,ECL显色,暗室中显影、定影。Quantity One软件进行灰度值分析。实验重复3次。
2.4细胞活力的检测 接种巨噬细胞于96孔板,每孔200 μL细胞悬液(每孔5×103个),于培养箱内常规培养,细胞达70%~80%贴壁融合时,将培养孔中的培养液吸弃,含2% FBS培养液静置24 h,使用pcDNA3.1、ox-LDL、ox-LDL+pcDNA3.1和ox-LDL+pcDNA3.1-KLF6处理细胞,24 h后,每孔中加MTT液(5 g/L) 20 μL,于培养箱内常规孵育4 h,吸去上清,在每孔中加DMSO 150 μL,在振荡器上振荡混匀,使结晶溶解充分。酶标仪测定各组490 nm波长的吸光度(A)值。每组设置5个复孔,实验重复3次。
2.5细胞凋亡检测 以Annexin V-FITC/PI双标法,通过流式细胞术检测细胞凋亡。pcDNA3.1、ox-LDL、ox-LDL+pcDNA3.1和ox-LDL+pcDNA3.1-KLF6处理巨噬细胞24 h后,PBS洗涤细胞,制备成细胞悬液,分别加入Annexin V-FITC和PI各5 μL,室温避光反应15~20 min,上机前加200 μL 1×缓冲液,通过流式细胞仪检测(1 h内)。实验重复3次。
2.6活性氧簇(reactive oxygen species,ROS)水平的检测 使用H2DCF-DA探针检测。pcDNA3.1、ox-LDL、ox-LDL+pcDNA3.1和ox-LDL+pcDNA3.1-KLF6处理巨噬细胞24 h后,每孔加终浓度10 μmol/L的H2DCF-DA,常规孵育20 min,用流式细胞术检测各组细胞的荧光强度。实验重复3次。
3 统计学方法
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,多组差异比较采用单因素方差分析,两两比较采SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 KLF6在巨噬细胞的表达
参照LipofectamineTM2000试剂盒说明,将重组体pcDNA3.1-KLF6转染巨噬细胞,通过Western blot检测转染后的巨噬细胞KLF6蛋白表达,结果显示,转染pcDNA3.1-KLF6的巨噬细胞中KLF6的蛋白表达明显升高(P<0.05),而转染空载体pcDNA3.1组KLF6的蛋白表达与空白(blank)组差异无统计学显著性(P>0.05),见图1。
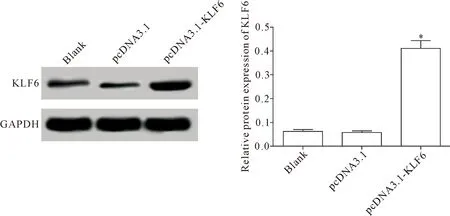
Figure 1. Western blot was used to determine the protein expression of KLF6 in the THP-1 cell-derived macrophages transfected with pcDNA3.1-KLF6. Mean±SD.n=3.*P<0.05vsblank group.
图1 Western blot检测转染pcDNA3.1-KLF6的巨噬细胞中KLF6的表达
2 过表达KLF6对ox-LDL诱导的巨噬细胞活力的影响
各组细胞处理24 h,通过MTT法检测各组细胞活力,结果显示,ox-LDL可明显降低巨噬细胞的活力,而过表达KLF6可减弱ox-LDL对巨噬细胞活力的抑制作用(P<0.05),见图2。
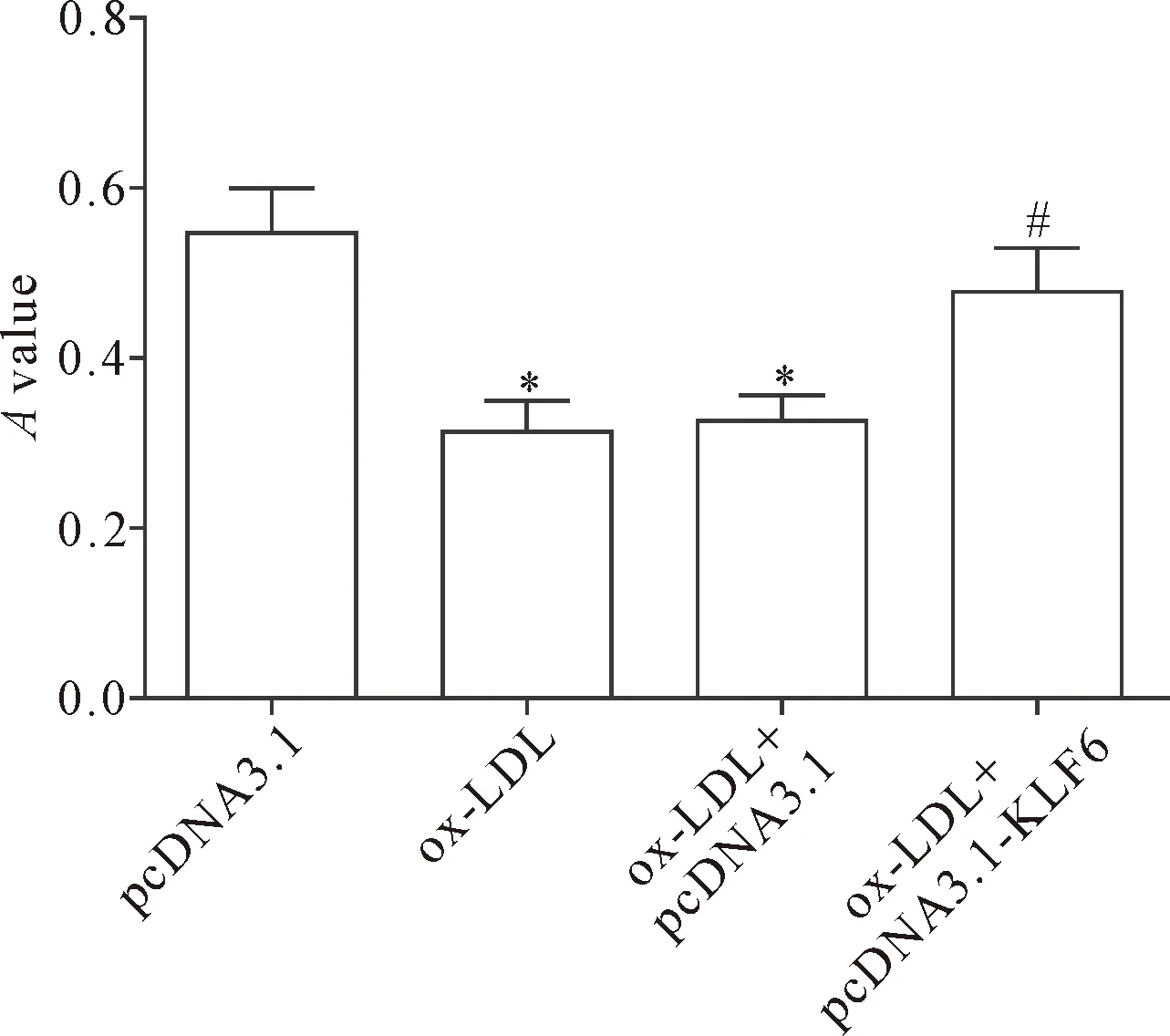
Figure 2. The effects of KLF6 over-expression on macrophage viability induced by ox-LDL. Mean±SD.n=3.*P<0.05vspcDNA3.1 group;#P<0.05vsox-LDL+pcDNA3.1 group.
图2 过表达KLF6对ox-LDL诱导的巨噬细胞活力的影响
3 过表达KLF6对ox-LDL诱导的巨噬细胞凋亡的影响
使用Annexin V-FITC/PI双染法,通过流式细胞术检测各组细胞凋亡率变化,结果显示,ox-LDL可明显促进巨噬细胞凋亡,而过表达KLF6可减弱ox-LDL对巨噬细胞凋亡的促进作用(P<0.05),见图3。
4 过表达KLF6对ox-LDL诱导的巨噬细胞ROS水平的影响
使用H2DCF-DA探针检测各组细胞内ROS水平变化,结果显示,ox-LDL可明显诱导巨噬细胞ROS的产生,而过表达KLF6可减弱ox-LDL对巨噬细胞ROS产生的诱导作用(P<0.05),见图4。
5 过表达KLF6对ox-LDL诱导的巨噬细胞Bcl-2和Bax表达的影响
通过Western blot检测各组细胞凋亡相关蛋白Bcl-2和Bax的表达,结果显示,ox-LDL可明显下调巨噬细胞Bcl-2表达,上调Bax表达,而过表达KLF6可减弱ox-LDL对Bcl-2表达下调及Bax表达上调的作用(P<0.05),见图5。
6 过表达KLF6对ox-LDL诱导的巨噬细胞AKT信号通路的影响
通过Western blot检测各组细胞p-AKT的蛋白水平,结果显示,ox-LDL可明显下调巨噬细胞p-AKT的蛋白水平,而过表达KLF6可减弱ox-LDL对细胞p-AKT蛋白水平下调的作用(P<0.05),见图6。

Figure 3. The effects of KLF6 over-expression on macrophage apoptosis induced by ox-LDL. Mean±SD.n=3.*P<0.05vspcDNA3.1 group;#P<0.05vsox-LDL+pcDNA3.1 group.
图3 过表达KLF6对ox-LDL诱导的巨噬细胞凋亡的影响

Figure 4. The effects of KLF6 over-expression on ROS production level in the macrophages induced by ox-LDL. Mean±SD.n=3.*P<0.05vspcDNA3.1 group;#P<0.05vsox-LDL+pcDNA3.1 group.
图4 过表达KLF6对ox-LDL诱导的巨噬细胞ROS生成水平的影响
讨 论
AS是多种心血管疾病的重要病因,巨噬细胞在AS发生及发展过程中发挥重要作用[8]。ox-LDL是低密度脂蛋白经超氧阴离子、金属离子或其它致氧因子作用形成的,对AS过程中炎症因子释放有促进作用,并可促进巨噬细胞介导的粥样斑块降解,其水平与AS严重程度呈正相关[9]。有研究表明,ox-LDL低浓度可抑制生长因子引起的巨噬细胞凋亡,其机制与激活PI3K/AKT信号通路有关,而ox-LDL高浓度可导致巨噬细胞凋亡,甚至死亡[10]。已有研究表明,<50 mg/L ox-LDL诱导巨噬细胞凋亡不明显,而50 mg/L ox-LDL可诱导细胞凋亡[11]。因此,本研究选择50 mg/L ox-LDL处理巨噬细胞建立细胞损伤模型。
KLF6是KLF家族成员之一,是一类有锌指结构域的转录因子,可通过对下游基因转录调控参与细胞增殖、凋亡、生长发育、血管生成、分化等生理和病理过程[12]。已有多项研究表明,KLF6与多种肿瘤发生发展密切相关,是一个抑癌基因[13-14]。近年来的研究表明,KLF家族成员与AS形成存在密切关系,如KLF2在AS病变的多种细胞中,参与转录调控多种因子,达到抗炎、防治血栓、抗凝和抗氧化等作用[15]。已有研究表明,KLF6可通过促进ATP结合盒转运蛋白A1表达,抑制ox-LDL诱导的巨噬细胞胆固醇蓄积[7],提示KLF6在AS发生发展过程中的重要作用。本研究旨在探讨过表达KLF6对THP-1细胞诱导分化的的巨噬细胞凋亡的影响。结果显示,过表达KLF6可明显提高ox-LDL诱导的巨噬细胞的活力,降低细胞凋亡率,提示过表达KLF6可能减轻AS的损伤作用。

Figure 5. The effects of KLF6 over-expression on the protein expression of Bcl-2 and Bax in the macrophages induced by ox-LDL. Mean±SD.n=3.*P<0.05vspcDNA3.1 group;#P<0.05vsox-LDL+pcDNA3.1 group.
图5 过表达KLF6对ox-LDL诱导的巨噬细胞Bcl-2和Bax表达的影响
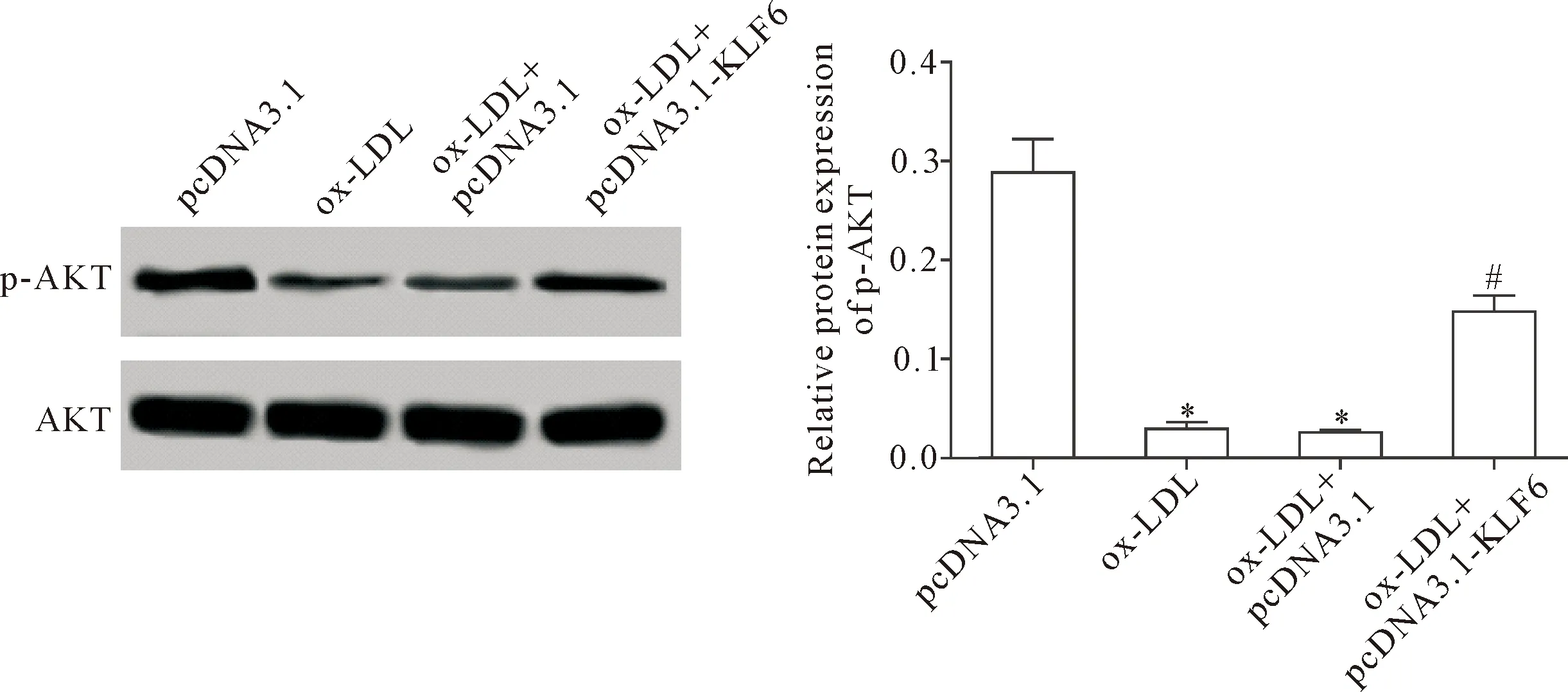
Figure 6. The effects of KLF6 over-expression on the AKT signaling pathway in the macrophages induced by ox-LDL. Mean±SD.n=3.*P<0.05vspcDNA3.1 group;#P<0.05vsox-LDL+pcDNA3.1 group.
图6 过表达KLF6对ox-LDL诱导的巨噬细胞AKT信号通路的影响
当机体受到各种刺激源时,可引起氧化与抗氧化失衡,引起ROS的大量产生,最终导致细胞死亡和组织损伤[16]。已有大量研究表明,氧化应激在AS、糖尿病等多种疾病的发生发展过程中有重要作用[17-18]。有研究表明,ox-LDL可明显促进AS相关的巨噬细胞ROS产生[19]。本研究使用50 mg/L ox-LDL处理巨噬细胞,ROS水平升高,这与既往研究结果一致;而过表达KLF6可明显降低ox-LDL诱导的巨噬细胞ROS的产生,提示降低ROS水平可能是KLF6降低巨噬细胞凋亡的机制之一。
AKT是PI3K/AKT信号通路的中心环节,生长因子和细胞因子等均可通过激活PI3K使磷酸化AKT活化,而AKT活化后可通过引起下游靶蛋白和磷酸化级联反应相互作用,从而调控细胞生长、增殖和凋亡等生物学过程[20-21]。AKT调控细胞凋亡与凋亡相关的Bcl-2家族密切相关,Bcl-2和Bax分别为该家族的抑凋亡基因和促凋亡基因,下调Bcl-2或上调Bax均可诱导细胞凋亡[22-23]。已有研究表明,AKT信号通路在巨噬细胞凋亡中有重要作用,激活AKT信号可明显抑制细胞凋亡,而抑制该信号则促进细胞凋亡[24-25]。本研究结果显示,过表达KLF6可明显上调ox-LDL诱导的巨噬细胞Bcl-2和p-AKT的蛋白水平,下调Bax表达。提示KLF6对AS相关的巨噬细胞凋亡与激活AKT信号通路有关。
综上所述,KLF6基因可明显提高ox-LDL诱导的巨噬细胞活力,降低细胞凋亡,机制可能与降低细胞ROS水平及激活PI3K/AKT信号通路有关。本实验结果提示KLF6可能是AS治疗的分子靶点之一。本研究仅检测了KLF6对巨噬细胞活力和凋亡的影响,其他生物学特性及机制尚未涉及,后续将进一步加以探讨。
