电芬顿—生物泥浆法联合修复芘污染土壤
2019-10-23徐文迪郭书海李凤梅
徐文迪,郭书海,李 刚,吴 波,李凤梅
电芬顿—生物泥浆法联合修复芘污染土壤
徐文迪1,郭书海2,3*,李 刚2,3,吴 波2,3,李凤梅2,3
(1.沈阳理工大学环境与化学工程学院,辽宁 沈阳 110159;2.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016;3.污染土壤生物-物化协同修复技术国家地方联合工程实验室,辽宁 沈阳 110016)
以芘污染土壤为研究对象,建立一种电芬顿与生物泥浆法联合的修复(EF-BIO)处理方法.通过对2种修复技术在污染物降解过程中显现出的不同降解特性以及所需环境因素的区别与变化的分析和研究,构建一种高效的联合的有机污染土壤修复方法.研究主要分为两部分: 第一部分通过目标污染物去除率与降解速率,羟基自由基(·OH)生成量与微生物数量,以及污泥pH值等参数的变化分析得出联合修复方法的联合顺序;第二部分通过不同联结时间点目标污染物去除率与降解速率,微生物数量变化以及中间产物变化等的研究分析,确定最佳的EF-BIO联合修复方法.结果显示:当EF先进行6h,EF-BIO联合修复法仍然在72h内对芘的去除率高达91.02%,比单独使用两种方法的去除率提高50%以上.
电芬顿;物泥浆法;联合修复;芘
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是指分子中含有两个或两个以上苯环以稠环形式连接在一起的碳氢化合物,是一类环境中普遍存在的有机污染物,具有致癌,致畸,致突变的“三致”毒性,是环境持久类污染物中的一种[1].目前针对PAHs污染土壤的修复方法主要有物理修复(客土法,焚烧,填埋,等),化学修复(萃取法,化学淋洗法,化学氧化法,等)和生物修复,其中生物修复方法是PAHs污染土壤最常用的方法之一[2].生物修复技术是一种安全、高效、环境友好的有机物染土壤修复技术[3].然而在土壤实际修复过程中受到目标污染物的生物可利用性,浓度,毒性,分子结构,疏水性,土壤环境的低传质性,不均质性以及修复历时长等因素的制约,一定程度限制了使用[4-5].生物泥浆反应器是一种异位生物强化修复技术,无论在反应速率和对污染物的去除效果上较原位土壤生物修复都大大提高[6-7].虽然生物泥浆反应器较传统原位生物修复技术处理效果大大提高,但是对于大分子的PAHs以及高浓度的有机污染物,生物可利用性仍然是影响反应效率的限速步骤[8-9].因此,将生物泥浆修复技术与其他可以迅速提高生物可利用性的技术联合应用,强化生物泥浆修复技术的处理效果.在这些技术中高级氧化技术(AOPs)显现出独特的优越性.电芬顿技术作为AOPs中的代表性技术具有反应速率快和降解能力强的特性[10].虽然已有一些关于电芬顿与生物修复联合应用于污水处理的技术的报道[11],但土壤和水的性质存在巨大差异,然而此类研究却鲜有报道.芘为四环的PAHs,性质稳定,本文选择芘作为PAHs的代表物为目标污染物,根据电芬顿与生物修复的不同降解特性等因素的分析,构建电芬顿与生物修复的联合修复方法,为污染土壤修复提供一种高效,节能的修复新方法.
1 材料与方法
1.1 材料
芘(Pyr,纯度99%,购自Sigma-Aldrich,德国),其他化学试剂均是分析纯级或色谱纯级.供试的土壤取自中国科学院沈阳生态实验站洁净壤土,0~30cm地表土(理化性质见表1),将土壤中的石块与植物根须挑拣出,自然风干后过60目筛,储藏待用.为排除微生物降解在化学氧化降解过程中的影响以及土著微生物的影响,供试土壤在高压灭菌器(120℃, 20min)中灭菌处理[12].按理论浓度160mg/kg(干土)向供试土壤中添加芘的二氯甲烷溶液,充分混合均匀,置于通风橱中待有机溶剂二氯甲烷挥发完全,测定其实际浓度为144.70mg/kg.供试细菌筛自PAHs长期污染焦化土壤(辽宁沈阳,沈阳炼焦煤气有限公司遗留场地),本实验室前期实验中保存高效降解菌株B2和B4[13].将混合菌接种致600mL以芘为唯一碳源的无机盐培养基中,30℃震荡培养,待培养液在600nm时的光密度值(OD600)达到1时,将菌体离心,洗净后,添加至生物泥浆反应器中.

表1 土壤理化性质
1.2 实验设置
实验共设置A、B、C三组(共6个实验设置)不同处理,水土比均为3: 1,在常温下进行反应,具体见表2.
实验装置包括有效容积为1L的圆柱玻璃罐,配有配套的可固定电极、方便取样、并能防止水分蒸发的盖子;六联链式搅拌器通过搅拌棒搅拌;曝气泵通过塑胶软管连接曝气装置,在反应器中阴极附近曝气,并且在进气端软管处放置气体流量计,监测并控制进气量;长17cm,直径为1cm的柱状铁阳极与石墨阴极相对置于反应器中,高于罐底1cm;两电极通过直流电源相连接,电路上连接电流表.

表2 实验设置
注: BIO为生物修复;EF为电芬顿修复.
1.3 测试与分析方法
1.3.1 ·OH检测 ·OH采用以水杨酸为探针试剂,高效液相色谱法测定水杨酸羟基化产物(2,3-二羟基苯甲酸和2,5-二羟基苯甲酸)的方法测定[14].水杨酸浓度为400µmol/L,色谱条件为:C18反向柱,流动相为30mmol/L醋酸-醋酸钠缓冲溶液(pH值为4.9),流速为0.8mL/min,色谱柱柱温为25℃.
1.3.2 Pyr浓度检测 Pyr浓度采用高效液相色谱法测定[15],泥浆中水相和固相样品中Pyr的前处理包括样品萃取,萃取液浓缩,净化,再浓缩和换溶剂,后用乙腈定容.色谱条件:PAHs分析柱;流动相是水和乙腈;流速是1.0mL/min;流动相梯度比例为0min,10:90水/乙腈;1min,100%乙腈;9min,10:90水/乙腈;柱温25℃.
1.3.3 总细菌数量分析 泥浆中总细菌数的测定采用实时荧光定量PCR(Real-time PCR)法[16].依次经过土壤基因组DNA的提取,重组质粒的制备,质粒DNA的提取,质粒的定量, Real-time PCR标准曲线的绘制,微生物数量的计算等步骤.
1.3.4 中间产物的测定 芘氧化降解的主要中间产物采用GC-MS(Ultra-ISQ)检测分析,通过对单环和无环中间产物与残留Pyr峰面积比值表征中间产物的变化[3].工作条件和升温程序为:初始温度100℃,保持1min;15℃/min升至160℃,保持1min;再以5℃/min升至300℃,保持5min.离子源温度为200℃,传输线温度为250℃,进样口温度为250℃.采用非极性毛细管柱(TR-1MS,30m´0.25mm´0.25μm).载气为99.99%高纯氦,流量1.0mL/min,进样量1μL.
1.3.5 数据分析与处理 试验数据均取3组平行试验的平均值,应用SPSS 20软件统计分析.
2 结果与讨论
2.1 联合修复方法的构建
2.1.1 去除率与降解速率 表3和图1分别为BIO和EF两个过程对Pyr的去除率与降解速率随时间的变化情况.
虽然两种方法在Pyr的总去除率上几乎相同(BIO: 62.69%;EF: 60.11%),但是整个修复过程中去除率和降解速率变化情况存在显著差异.根据Pyr去除率的变化情况可以将降解过程分为两个阶段,第一阶段为前36h,EF的去除率要明显大于BIO的去除率;而在第二阶段(后36h)BIO对Pyr的去除率逐渐变大,最终去除率反超EF.而在图1中降解速率的变化过程能更说明这一差异,EF对Pyr降解速率在短时间内达到最大值随后即迅速减小,而BIO过程的降解速率要缓慢的多,但是在后期显现较高降解速率,而且最大的降解速率要小于EF的最大降解速率.

表3 不同处理后Pyr去除率随时间的变化
2.1.2 ·OH与细菌总数的变化 两种处理方法对Pyr的不同去除率和降解速率主要是因为这两种方法的降解机制是不同的.EF主要依靠在电芬顿过程中生成的强氧化剂·OH完成对有机污染物的氧化降解,而BIO主要是靠微生物的代谢活动而使得Pyr得以降解.然而EF反应速率极快,在通电的情况下,芬顿试剂(H2O2和Fe2+)立即在阴极和阳极分别产生,·OH快速且大量生成,Pyr迅速减少[17],而对于BIO,微生物的生长代谢需要一段时间,因此,Pyr的降解过程相对平稳缓慢[18].

图1 EF和BIO过程中Pyr降解速率变化
图2为·OH与微生物数量随时间的变化情况,可以看出·OH浓度达到最大值后,由于Fe泥的生成、铁电极的消耗、土壤有机质结构与含量、以及pH环境的改变等不利条件的产生[19],·OH浓度随反应时间延长逐渐减少,EF反应后期降解速率变得缓慢.而BIO反应器中的微生物经历了一个相对漫长的适应期后,生物量在36h时开始迅速上升,48h达到一个较大值后,最大值出现在60h,但增加幅度并不大.所以在对Pyr降解的降解速率上反应出来生物降解的高效反应阶段是后半段.

图2 ·OH浓度以及泥浆中总微生物16S rRNA基因拷贝数的变化
2.1.2 pH值的变化 EF和BIO过程对pH值有不同的要求,pH是影响EF与BIO组合顺序的另一个重要影响因素.EF需要酸性环境(pH在3左右),过高或过低的pH都不利于·OH的生成[20].而微生物的生长则更适宜在温和的pH环境中(5.0~9.0)[21].因此,pH是联合修复技术的另一个控制因子.图3显示,随着EF反应的进行,泥浆的pH值从最初的3.0逐渐上升,当在反应结束时pH值已经接近中性.主要因为H+和OH−通过电解分别在阳极和阴极产生[15],而H+因为是合成H2O2的主要原材料被消耗,同时OH−又在芬顿反应中生成,虽然H+在Fe3+还原成Fe2+的过程中产生,但是两个反应的反应速率相差很大(芬顿反应70/M·s,Fe3+还原反应0.001-0.01/M·s[22]),因此pH值是不断升高的.

图3 pH值随时间的变化
综上分析,两种处理方法对污染物的降解特性是不同的,正是这种差异的存在,使得两种修复方法联合处理有机污染土壤的技术是可行的.充分利用两种修复方法的高效率阶段,使去除率提高的同时反应时间能大大缩短.所以从降解速率的角度分析EF在BIO之前进行更合理,这种组合方式可以使两种技术处于高效率阶段.另外,从所需pH环境的角度分析,先EF后BIO的组合,能合理利用EF过程中pH的变化,节省了药剂用量和调节pH所需的时间,更重要的是避免了土壤性质因反复调节而受到的破坏.因此,EF-BIO的联合修复技术更为合理.
2.2 联合修复技术参数优化及分析
2.2.1 最佳EF处理时间的确定 从Pyr降解速率以及·OH产生速率的分析结果可以看出在EF过程中前24h内数值是最大的,因此,对于此EF-BIO联合修复过程中EF阶段的时间控制在24h之内.
从图4A可以看出,EF进行时间的长短与Pyr的总去除率在整体上呈现负相关的关系,氧化时间最短的,总去除率最大,皮尔森相关系数为-0.967 (<0.05),C1~C3对Pyr的总去除率依次分别是91.02%,71.94%和53.72%.可能是因为:1)EF反应时间过长,电化学氧化反应对土壤原有性质的破坏,不利于微生物生长[23];2)由于BIO对有机污染物的降解是有选择性的,因此,虽然EF过程增加了目标污染物的生物可利用性[24],但是由于BIO的选择性而使得在Pyr与其他生物可利用性高的物质之间形成了竞争关系.经不同EF氧化时间处理的3个试验,在BIO阶段Pyr的降解速率也是不同的(图4B).在C1与C2中,生物降解的速率急速升高,之后又缓慢的下降;而对C3,生物降解速率是先减小然后在反应后期才逐渐的上升.这说明在C1与C2中微生物对目标污染物Pyr的降解是有效的,C3经过较长的氧化后,生成的小分子中间产物较多,与目标污染物Pyr的降解存在竞争关系,而使得微生物对目标污染物的去除率非常低,在反应后期可能是因为竞争减小或消失而使得微生物对目标污染物的降解效率又有所提高.综上,当EF时间为6h,BIO为66h时,更有利于土壤中Pyr的去除.
2.2.2 降解菌总数的变化 通过测定EF-BIO处理泥浆中总微生物16S rRNA基因拷贝数的变化,分析了Pyr降解菌接种到经EF氧化处理后的泥浆中细菌数量的变化,结果如图5所示(图中为EF 6h的处理,不同EF处理后的细菌总数变化曲线几乎相同).接种相同数量的细菌,在BIO反应器中细菌总数要经历近24h的适应期后才逐渐上升(图2),而在EF- BIO反应器中,细菌总数的适应期非常短,甚至从接种后BIO反应开始时细菌总量便直接上升至最高值.EF处理后泥浆温度上升了约1℃左右,在一定程度上促进了生物降解.此外,C1(EF6h)中BIO阶段的Pyr降解速率曲线与Pyr降解菌的生长曲线完全吻合,这说明6h的EF氧化处理,使目标污染物Pyr的生物可利用性增强,并且底物的多样性提高了BIO阶段的降解速率,Pyr降解菌在BIO阶段对Pyr进行了有效的降解.
2.2.3 中间产物分析 Pyr在EF反应过程中会在·OH氧化降解过程中生成小分子量和结构简单的中间产物[25].由于生物降解过程不同于化学氧化,生物降解是具有选择性的[26].因此,中间产物的浓度与种类都会影响BIO阶段的降解效率,从而影响EF-BIO过程对目标污染物Pyr的总体去除.因此,对EF过程中主要的中间产物进行分析非常重要.
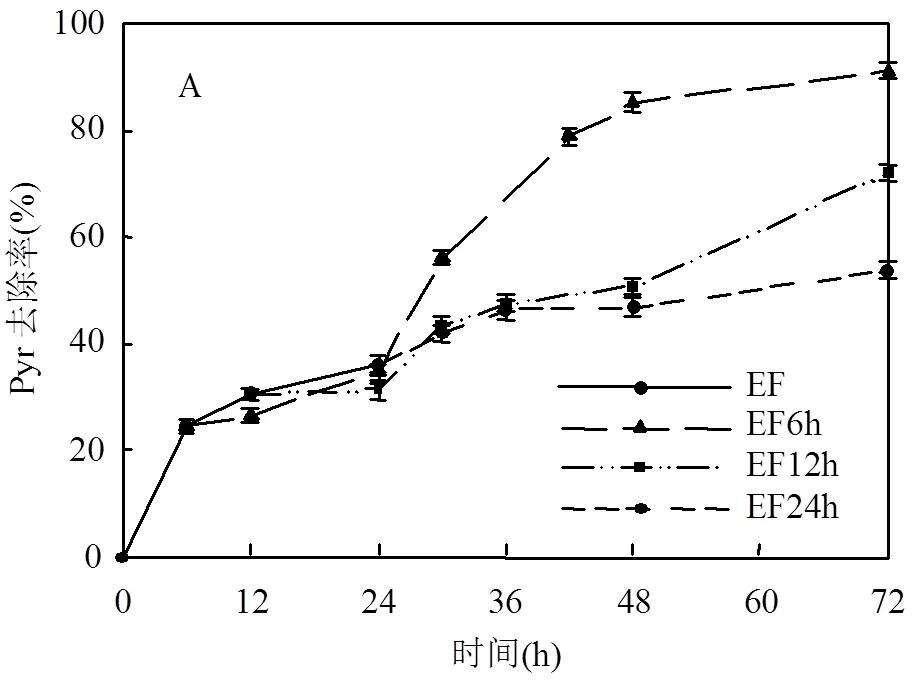

图5 EF(6h)-BIO反应器中泥浆总微生物16S rRNA基因拷贝数变化

表4 低分子量中间产物所占比例
Pyr在·OH自由基作用下迅速开环,生成小分子和低环的中间产物(本文指单环和无环中间产物).在EF过程中生成的中间产物通过GC-MS测定分析.无论是化学氧化过程还是生物氧化过程,有机污染物都会经历醇-醛-酸的变化过程,并最终完全矿化生成CO2和H2O[27-28].取经EF氧化处理6、12和24h的泥浆样品,提取后用GC-MS测定,并通过比对定性分析Pyr氧化降解的中间产物.经检测发现,在所检测到的中间产物中以单环和无环的产物为主.从表4可以看出,随反应时间的进行,单环和无环中间产物与残留Pyr的峰面积比值逐渐升高,从6h的15.63%左右升至24h的33.30%左右.与2.2.1与2.2.2结果结合分析来看,6h的EF氧化对Pyr的降解效果最好,而与此相对应的单环和无环中间产物的比例在所测试的3个时间点上是最低的.这说明虽然经氧化处理后,低分子的污染物的量升高,Pyr的生物可利用性有所提高,但并不是小分子物质越多越有利于微生物的降解.由于生物降解过程不同于化学氧化过程,生物降解具有选择性,更容易并首先选择生物可利用性强的小分子物质,然后再利用大分子物质[29].经过6h的EF氧化处理后,生物可利用性高的小分子物质的量以满足Pyr降解菌快速生长繁殖的需求.同时,增加适当浓度中间产物,相当于生物泥浆反应器中添加了共代谢的底物,强化了BIO过程的生物降解效率,使对目标污染物的去除率增强.然而继续延长EF处理时间,虽然小分子物质更多了,但是在相同的时间内对Pyr的去除效果却没有提升反而降低了.这是因为Pyr与这些小分子产物之间所建立的竞争关系导致的.微生物首先利用这些生物可利用性高的物质[30],而减少了对目标污染物Pyr的降解.从图4可以看出,BIO阶段对Pyr的降解效率随EF继续增加明显降低.可以推算,若再持续延长BIO的处理时间,也许会得到Pyr较高的降解率,但是就达不到高效且快速修复污染土壤的初衷.因此从中间产物的角度分析,在EF-BIO修复过程中,6h的EF时间是最适宜的,不仅提高了生物降解效率,而且还减少通电时间,节约了运行成本.
综上所述,EF氧化时间为6h的EF-BIO联合处理技术对Pyr污染土壤的修复效果最佳.
3 结论
3.1 采用联合修复方法可以缩短EF的处理时间,可有效利用EF的高效阶段.同时EF使污染物的生物可利用性提高,降解菌适应期缩短,提高生物降解效率,从而EF-BIO联合修复方法对芘的降解显著提高.
3.2 联合修复过程中,EF时间的长短是影响整个修复方法效率高低的主要因素.当EF处理时间为6h时,pH值(>5),小分子和结构简单中间产物比例(15.63%)都处于适合生物降解的水平,微生物数量增长速度最快.在72h内对污染土壤中芘的总去除率达到91.02%,比单独使用两种修复方法提高了约50%.
[1] 张 娟,吴建芝,刘 燕.北京市绿地土壤多环芳烃分布及健康风险评价 [J]. 中国环境科学, 2017,37(3):1146-1153. Zhang J, Wu J Z, Liu Y. Polycyclic aromatic hydrocarbons in urban green space of Beijing: distribution and potential risk [J]. China Environmental Science, 2017,(3):1146-1153.
[2] 巩宗强,李培军,王 新,等.利用植物油淋洗修复受多环芳烃污染的土壤 [J]. 中国环境科学, 2002,22(5):421-424. Gong Z Q, Li P J, Wang X, et al. Using plant oil leach polycyclic aromatic hydrocarbons contaminated soils [J]. China Environmental Science, 2002,22(5):421-424.
[3] 范瑞娟.石油污染土壤电动-生物修复过程中的耦合作用 [D]. 沈阳:中国科学院沈阳应用生态研究所, 2014. Fan R J. Coupling effect of bio-electrokinetics in the remediation of petroleum contaminated soil [D]. Shenyang: Institute of Applied Ecology, Chinese Academy of Sciences, 2014.
[4] Abbondanzi F, Bruzzi L, Campisi T, et al. Biotreatability of polycyclic aromatic hydrocarbons in brackish sediments: Preliminary studies of an integrated monitoring [J]. International Biodeterioration & Biodegradation, 2006,57(4):214-221.
[5] Li X J, Li P J, Lin X, et al. Biodegradation of aged polycyclic aromatic hydrocarbons (PAHs) by microbial consortia in soil and slurry phases [J]. Journal of Hazardous Materials, 2008,150(1):21–26.
[6] Di Gennaro P, Franzetti A, Bestetti G, et al. Slurry phase bioremediation of PAHs in industrial landfill samples at laboratory scale [J]. Waste Management & Research, 2008,28(8):1338–1345.
[7] Fuller M, John F. Microbiological changes during bioremediation of explosives-contaminated soils in laboratory and pilot-scale bioslurry reactors [J]. Bioresource Technology, 2004,91(2):123-133.
[8] 夏 青.酶催化氧化耦合反应去除有机污染物的机理及应用研究 [D]. 南京:南京农业大学, 2013. Xia Q. Transformation of organic pollutants in enzyme catalyzed oxidative processes [D]. Nanjing: Nanjing Agricultural University, 2013.
[9] 魏德洲,秦煜民.H2O2在石油污染土壤微生物治理过程中的作用 [J]. 中国环境科学, 1997,(5):46-49. Wei D Z, Qin Y M. Function of H2O2in the bioremediation process of petroleum contaminated soil [J]. China Environmental Science, 1997,(5):46-49.
[10] 殷梦菲,李 静,王翠苹,等.多溴联苯醚污染土壤的新型强化修复技术 [J]. 中国环境科学, 2017,37(10):3853-3860. Yin M F, Li J, Wang C P, et al. A novel technology for enhanced remediaton of soils contaminated by PBDEs [J]. China Environmental Science, 2017,(10):3853-3860.
[11] Fatiha F S, Florence F, Isabelle S H, et al. Tetracycline degradation and mineralization by the coupling of an electro-Fenton pretreatment and a biological process [J]. Journal of Chemical Technology & Biotechnology, 2013,88:1380–1386.
[12] Aburto-Medina A, Adetutu E M, Aleer S, et al. Comparison of indigenous and exogenous microbial populations during slurry phase biodegradation of long-term hydrocarbon-contaminated soil [J]. Biodegradation, 2012,23(6):813–822.
[13] 张灿灿.焦化场地PAHs污染土壤的电动-微生物修复 [D]. 沈阳:中国科学院大学, 2013.Zhang C C. Electro-bioremediation of PAHs contaminated soils at coking industrial sites [D]. Shenyang: The University of Chinese Academy of Sciences, 2013.
[14] 甘信宏,郭书海,徐文迪,等.电芬顿泥浆反应器中羟基自由基生成影响因素分析 [J]. 农业环境科学学报, 2015,34(1):44-49. Gan X H, Guo S H, Xu W D, et al. Analysis of factors influencing hydroxyl radical formation in electro-fenton slurry reactor [J]. Journal of Agro-Environment Science, 2015,34(1):44-49.
[15] Xu S J, Guo S H, Wu B, et al. An assessment of the effectiveness and impact of electrokinetic remediation for pyrene-contaminated soil [J]. Journal of Environmental Sciences (China), 2014,26(11):2290-2297.
[16] Guo S H, Fan R J, Li T T, et al. Synergistic effects of bioremediation and electrokinetics in the remediation of petroleum-contaminated soil [J]. Chemosphere, 2014,109:226–233.
[17] Dong Y C, Dong W J, Cao Y N, et al. Preparation and catalytic activity of Fe alginate gel beads for oxidative degradation of azo dyes under visible light irradiation [J]. Catalysis Today, 2011,175(1):346–355.
[18] F. Fava, S. Berselli, P. Conte, A. Piccolo, L. Marchetti. Effects of humic substances and soya lecithin on the aerobic Bioremediation of a soil historically contaminated by polycyclic aromatic hydrocarbons (PAHs) [J]. Biotechnology and Bioengineering, 2004,88(2):214–223.
[19] Harimurti S, Dutta B K, Ariff I, et al. Degradation of monoethanolamine in aqueous solution by Fenton's reagent with biological post-treatment [J]. Water Air and Soil Pollution, 2010,211(1-4):273–286.
[20] Wang Y J, Li X Y, Zhen L M, et al. Electro-Fenton treatment of concentrates generated in nanofiltration of biologically pretreated landfill leachate [J]. Journal of Hazardous Materials, 2012,229–230: 115–121.
[21] Moscoso F, Teijiz I, Deive F J, Sanromán M A. Efficient PAHs biodegradation by a bacterial consortium at flask and bioreactor scale [J]. Bioresource Technology, 2012,119:270–276.
[22] de Luna M D, Veciana M L, Su C C, et al. Acetaminophen degradation by electro-Fenton and photoelectro-Fenton using a double cathode electrochemical cell [J]. Journal of Hazardous Materials, 2012,217- 218:200–207.
[23] Sun H W, Yan Q S. Influence of Fenton oxidation on soil organic matter and its sorption and desorption of pyrene [J]. Journal of Hazardous Materials, 2007,144(1/2):164–170.
[24] Chamarro E, Marco A, Esplugas S. Use of Fenton reagent to improve organic chemical biodegradability [J]. Water Research, 2001,35(4): 1047–1051.
[25] Zeng Y, Hong P K A, Wavrek D A. Chemical-biological treatment of pyrene [J]. Water Research, 2000,34(4):1157–1172.
[26] Koshlaf E, Shahsavari E, Aburto-Medina A, et al. Bioremediation potential of diesel-contaminated Libyan soil [J]. Ecotoxicology and Environmental Safety, 2016,133:297-305.
[27] Ortega-Calvo J J, Tejeda-Agredano M C, Jimenez-Sanchez C, et al. Is it possible to increase bioavailability but not environmental risk of PAHs in bioremediation? [J]. Journal of Hazardous Materials, 2013, 261:733-45.
[28] Rubio-Clemente A, Torres-Palma R A, Penuela G A. Removal of polycyclic aromatic hydrocarbons in aqueous environment by chemical treatments: a review [J]. Science of the Total Environment, 2014,478:201-25.
[29] 范瑞娟,郭书海,李凤梅,等.混合烃污染土壤微生物-电动修复中的互补性研究 [J]. 农业环境科学学报, 2018,37(1):64-71. Fan R J, Guo S H, Li F M, et al. Complementarity of bio- electrokineties in the remediation of soil contaminated with multiple hydrocarbons [J]. Journal of Agro-Environment Science, 2018,37(1): 64-71.
[30] Fedrizzi F, Ramos D T, Lazzarin H S, et al. A modified approach forchemical oxidation coupled to biodegradation enhances light nonaqueous phase liquid source-zone remediation [J]. Environmental Science & Technology, 2017,51(1):463-472.
Remediation of pyrene-contaminated soil by a combined process with electro-Fentonand bioremediation.
XU Wen-di1, GUO Shu-hai2,3*, LI Gang2,3, WU Bo2,3, LI Feng-mei2,3
(1.Shcool of Environmental and Chemical Engineering, Shenyang Ligong University, Shenyang 110159, China;2.Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang110016, China;3.National-local Joint Engineering Laboratory of Contaminated Soil Remediation by bio-physicochemical Synergistic Process, Shenyang 110016, China)., 2019,39(10):4247~4253
The electro-Fenton (EF) process combined with bioremediation (BIO) process was established for pyrene (Pyr) contaminated soil. Two factors including degradation characteristics as well as environmental parameters were compared between EF and BIO processes. Optimal process order was determined by a series batch tests of parameters, such as the effects of removal rate, degradation efficiency, concentration of ·OH radical, biomass, and the pH value. The results showed EF process followed by BIO process was the optimum process order, the removal efficiency of Pyr was almost 50% higher than each single process. After 72h of reaction time, Pyr removal efficiency of the EF-BIO combined treatment process was still high of 91.02%.
electro-Fenton;slurry phase bioremediation;combined process;pyrene
X53
A
1000-6923(2019)10-4247-07
徐文迪(1986-),女,吉林省白山人,博士(后),讲师,研究方向为污染防治与环境修复技术、污泥处置与资源化技术以及高级氧化修复技术.发表论文10篇.
2019-04-01
国家点研发计划(2018YFC1801900);沈阳理工大学引进高层次人才科研支持经费(1010147000806)
* 责任作者, 研究员, shuhaiguo@iae.ac.cn
