耦合发酵产氢尾液处理的微生物电化学系统研究
2019-10-23卢建宏孙驰贺
卢建宏,李 卓,孙驰贺,付 乾*,李 俊,张 亮,廖 强,朱 恂
耦合发酵产氢尾液处理的微生物电化学系统研究
卢建宏1,2,李 卓1,2,孙驰贺1,2,付 乾1,2*,李 俊1,2,张 亮1,2,廖 强1,2,朱 恂1,2
(1.重庆大学低品位能源利用技术及系统教育部重点实验室,重庆 400030;2.重庆大学工程热物理研究所,能源与动力工程学院,重庆 400030)
区别于传统的稀释或加缓冲剂调节pH值的方法,本文提出采用微生物电解池(MEC)电调控暗发酵尾液pH值,并进一步采用微生物电合成系统(MES)降解废液产甲烷.结果表明,在MEC处理产氢暗发酵尾液过程中,伴随着阴极侧氢气的产生,暗发酵尾液中大量H+被消耗,溶液pH值从4.5升高到8.7;随后在MES中,产氢发酵尾液中有机物被进一步降解产生甲烷,其平均产甲烷速率达到4.5mmol/(L•d),且在21d内化学需氧量(COD)去除率达到89%,远优于没有经过pH调控的产氢发酵尾液MES中的产甲烷性能.
微生物电化学系统;暗发酵尾液;pH调控;有机物降解;甲烷
随着工业化进程的不断推进,化石燃料消耗所带来的环境污染,温室效应及能源短缺等问题日益凸显,寻找新型清洁可再生能源迫在眉睫[1],生物能源作为一种生产安全、制备简单的清洁能源被认为是最具潜力的新型能源之一[2-4].目前,通过对有机物进行发酵而产生氢气,是最为常见的生物能源方法之一,由于氢气具有热值高、燃烧后无污染、容易分离等优点,发酵产氢正受到国内外研究者的广泛关注[5-7].
发酵产氢以秸秆或高浓度有机废液为原料产生氢能,是一种极具应用前景的生物能源技术.然而,发酵产氢过程中产生的脂肪酸积累可导致pH值过低,抑制产氢微生物活性,从而迫使产氢中断.
发酵产氢主要可分为两个过程:首先是大分子有机物(纤维素,木质纤维素等)在微生物的催化下水解成单糖(如葡萄糖等)[7],其次是单糖进一步被微生物利用,水解形成脂肪酸以及脂肪酸进一步水解成乙酸,过程中伴随氢气的产生,产生的脂肪酸主要由乙酸、丙酸,丁酸、戊酸等小分子有机物组成[5,8].
同时,在有机物的水解过程中,发酵液累积了大量脂肪酸,溶液pH将明显下降,有研究表明积累的脂肪酸可使发酵液pH降低至4.5以下[8-10];这不仅抑制了发酵产氢,也会导致发酵产甲烷(彻底降解)过程缓慢[8,10].为了解决上述问题,Cai[11]和Ghimire[12]等学者用连续流动及定期更换发酵液的运行模式及时移除溶液中的脂肪酸,但由于水力停留时间较短,溶液中的有机物不能充分被降解,导致尾液中残留大量有机物,直接排放将对环境造成二次污染. Tao等[13]在实验过程中,对发酵尾液进行稀释虽然能够提高溶液pH,使低pH条件下失活的微生物恢复活性,进而继续降解有机物,提高能量回收率,但稀释过程将消耗大量洁净水,且由于热力学限制等因素,尾液中依然残留大量有机物;Dou等[14]和Cai等[11]在发酵液中加入大量缓冲液,使溶液pH值始终保持在近中性条件,虽然在长时间运行后能够将有机物彻底地水解为氢气和甲烷,但在工业应用中该方法将极大增加运行成本.
综上所述,目前对于发酵尾液pH值的控制存在着各种不足,通过移除溶液中的H+来调节pH值可有效解决发酵尾液中pH值过低的问题.微生物电化学系统(BES)是一种新型的生物能源转换装置,其主要特点是以具有电化学活性的微生物来催化电极表面的氧化还原反应,从来可以在降解溶液中有机物的同时进行产电、产H2或者还原CO2产CH4.按其产物及工作原理,可分为微生物燃料电池(MFC)、微生物电解池(MEC)和微生物电合成系统(MES).
MEC可以在降解有机物的同时产生氢气,从而实现溶液中H+的移除,是一种十分理想的调控发酵尾液pH的能源转化装置[15]. MEC主要由阳极、阴极及电解质组成,在生物阳极侧,微生物在降解有机物(如乙酸根)的同时将其电子转移到阳极表面. 电子经过外电路到达阴极表面,在阴极表面微生物催化剂的作用下,与H+结合反应生成H2,与此同时, MEC反应的进行需要外部输入一定的电压.对于MEC与发酵产氢的耦合系统来说,因为在移除H+的过程中,溶液pH不断提高,在低pH条件下失活的微生物将恢复活性,进一步提高该系统降解有机物效率及燃料产率;但由于热力学的限制,最终的小分子有机物无法继续降解为氢气[16],因此本文利用MES对近中性尾液彻底降解,同时将二氧化碳还原成甲烷.
MES结构及工作原理与MEC类似,主要区别是在其阴极侧,具有电化学活性的微生物(以产甲烷菌为主)可从其电极表面汲取电子,并将CO2还原成CH4.同样的,MES反应的进行需要外部输入一定的电压[16].相比于发酵产氢过程,由于外加能源的输入,MES能够将发酵尾液中不能继续被微生物自发降解的小分子有机物彻底降解;又由于该系统生成的物质都为气态的生物燃料,因此既实现了燃料的气液分离,又实现了溶液中H+的移除,因此将厌氧发酵过程与MES相结合是一种十分具有前景的生物能源转化技术.
本文利用MEC的优势,首先利用双室型MECs将暗发酵尾液中溶液中的大部分H+还原为H2,使得溶液pH值升高;然后利用单室MES将已调控pH值的产氢发酵尾液进行进一步降解,以去除溶液中有机物并生成CH4等燃料;同时研究了该系统中产氢发酵尾液中有机物的降解率、pH调控范围及生物燃料产量.
1 材料与方法
1.1 MEC反应器构建及启动
双室MEC反应器示意图如图1左图所示,主要包括阴阳两极腔室,其腔室容量均为340mL,中间通过阳离子交换膜(AEM)(直径5cm, CMI700,安德膜,北京,中国)分隔开来,并用铰链固定.阴阳极均采用碳布(5´4.5cm, TMIL Ltd.,茨城,日本)制成,并经过丙酮和超纯水冲洗3次以去除表面可能存在的有机物等杂质.为减小电极电阻,采用钛丝连接碳布电极以引出电流,并确保电极电阻小于3欧姆.反应器开口处均采用丁基胶塞及铝盖密封.阴极腔室插入Ag/AgCl参比电极(饱和KCl溶液)以监测阴极电位.
单室MES反应器结构示意图如图1右图所示,与双室MEC反应器相比去除了阳离子交换膜,其容积为300mL.电极与双室MEC中所采用电极一致,反应器开口处均采用丁基胶塞及铝盖密封以保持反应器厌氧状态.运行过程中插入Ag/AgCl参比电极(饱和KCl溶液)来监测阴阳极电位.
1.2 暗发酵产氢尾液样品
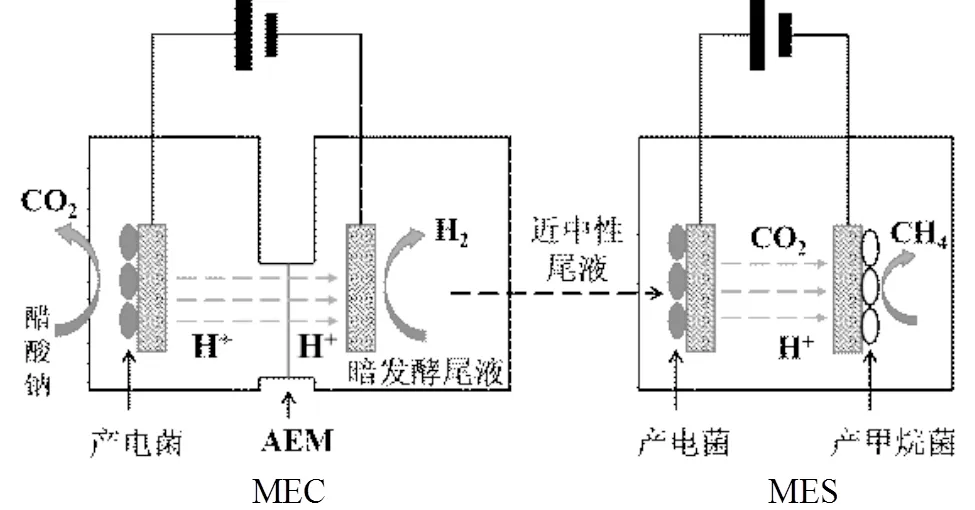
图1 BES处理暗发酵尾液流程示意
实验中所用暗发酵产氢尾液取自容积为400mL的发酵罐,其接种产氢细菌80mL(沼泥在121℃高压灭菌锅中灭菌15min后剩下的细菌即为产氢菌),以1:1物质的量比的葡萄糖和甘氨酸作为底物(每天加载10g/L 的COD量)进行暗发酵,整个暗发酵过程的水力停留时间(HRT)为2d.由于在暗发酵过程中累积了大量的脂肪酸,本研究中所采用暗发酵尾液pH值为4.5.通过对尾液进行测量后,得到其主要脂肪酸浓度依次为乙酸(28.32±1.83)mmol/L,丙酸(0.93±0.0)mmol/L,丁酸(29.05±2.67)mmol/L,戊酸(1.55±0.41)mmol/L.实验开始前,为了确保发酵产氢彻底停止,先将该暗发酵产氢尾液静置2d,期间保持严格厌氧状态,并防止细菌污染.
1.3 实验操作流程
实验中先启动双室型MEC,随后将pH值为4.5的产氢暗发酵尾液通入到双室MEC阴极腔室,通过阴极侧反应消耗H+(2H++2e-=H2↑)以调控其pH值;随后将暗发酵尾液转移到单室MES中,伴随着阳极将尾液中有机物的降解,阴极发生二氧化碳还原成甲烷的反应,最后实现降解有机物和生成燃料的目的.整个流程图如图1所示.
双室MEC启动过程中,在双室MEC阴极腔室内加入250mL pH为4.5的暗发酵尾液,阳极腔室加入100mL具有电化学活性的菌液(COD 2000mg/L)和140mL培养基.为保证严格厌氧,上述操作均在厌氧手套箱内完成.实验中所采用电化学活性菌液取自实验室内长期运行的MEC反应器,原始菌种为重庆郊区养猪场的厌氧活性污泥.培养基成分为醋酸钠溶液(COD 500mg/L)(11.82g/L Na2HPO4×12H2O, 2.64g/L KH2PO4, 1.17g/L CH3COONa×3H2O)进行高温灭菌后,再加入2.5mL Wolfe矿物溶液[17].上述操作完成后,对阴阳极腔室依次持续鼓入20min高纯氮气(纯度99.99%)以去除溶解氧,通过加载0.9V外电压来启动双室MEC(电源正极接MEC阳极,负极接MEC阴极).
单室MES启动过程中,在其反应腔室内依次加入80mL菌液和120mL pH值已经调控的暗发酵产氢尾液,通过持续鼓入纯二氧化碳(99.999%)20min,使得气相初始为纯二氧化碳构成,操作完成后加载0.9V外电源启动(电源正极接MES阳极,负极接MES阴极).
1.4 测试方法
为监测电流,在电路中串联1Ω的电阻,通过安捷伦数据采集仪(34970A, Agilent Technology, Santa Clara, CA, US) 每隔60s记录电阻两端电压,并通过欧姆定律()计算出电流,同时通过安捷伦数据采集记录下阴极相对于参比电极的电势.
采用气相色谱(Thermo Scientific, Waltham, MA, USA)测定在电解池气室中氢气和甲烷的峰面积(气密进样针分别抽取3次,每次抽取0.2mL),接着通过标准曲线计算氢气和甲烷气体含量[18].通过电化学工作站(Bio-Logic, VMP3,法国)扫描获取电极循环伏安(CV)曲线.生物阳极的扫描区间为-0.6到0.4V vs. Ag/AgCl,扫速为1mV/s,重复扫描3次.
电极表面生物膜形貌特征可通过扫描电子显微镜(SEM)(SU8020,中科百测, 北京,中国)进行表征.拍摄前需要先将样品放进2.5%的戊二醛固定液进行生物膜固定,然后进行酒精和叔丁醇脱水,最后使用喷金设备进行喷金处理.电极表面生物膜上活性生物量的计算主要依据Findlay等[19]提出的磷脂法进行测算.
2 结果与讨论
2.1 双室MEC系统产氢运行模式
由图2A可知,在接种启动之后,双室MEC系统电流随时间呈现指数上升趋势,这主要是因为接种启动之后,具有电化学活性的微生物开始在阳极表面附着并繁殖;且由于微生物繁殖为分裂繁殖,所以电流呈现指数上升趋势.在1.2d之后,MEC电流开始达到稳定值,主要是因为电极表面电化学活性微生物的增长和营养物质的供给开始达到一个平衡状态.在2.5d之后,电流开始逐渐下降,根本原因是从阳极至阴极室的阳离子(包括H+)迁移数下降.
在为期6d的实验周期中,该双室MEC的电流密度呈现先增加后下降的趋势,最大电流密度约为2.0A/m2.氢气最大产量约为3.65mmol.由图2B可知,MEC阴极腔室内产氢发酵尾液的原始pH为4.5,而经过MEC处理后,其pH值增至8.7,表明通过MEC将H+还原为H2,是一种有效调控产氢发酵尾液pH值的方法.
在阴极腔室中,氢离子来源分为两部分,一部分是阳极有机物降解产生H+传递到阴极;另外一部分是暗发酵尾液含有H+以及有机物进一步水解产生含有H+的脂肪酸.在第1d内,由于微生物的繁殖,阴极发生H+还原成H2的反应逐渐变得剧烈,并伴随氢气产量提升,这也导致电流增大,溶液pH不断增大,由此进一步使得在低pH(<4.5)尾液中活性受到抑制的微生物在中性及偏碱性的溶液环境中恢复活性[20],进而继续参与阴极液中有机物水解活动,水解过程中产生脂肪酸及氢气.从第2.5d开始,由于阳极底物逐渐消耗殆尽,导致阳极氧化有机物产生的电子和H+逐渐减少,因此传递到阴极的电子和H+逐渐减少;而另一方面,在阴极尾液中,有机物水解成脂肪酸的反应也由于底物消耗而逐渐停止;两方面原因导致阴极液中的H+迅速减少,进而导致H+还原成H2的反应剧烈程度逐渐减缓,氢气产率开始减缓,故而电流逐渐减小,但是阴极液pH和阴极产氢量依旧在增长.然而,在为期6d的实验周期中,发酵产氢尾液的pH值并未降低至酸性,表明电化学消耗H+的速率比产生H+的速率更快,因此发生在电极表面生物电化学反应是该系统内的主要反应过程.
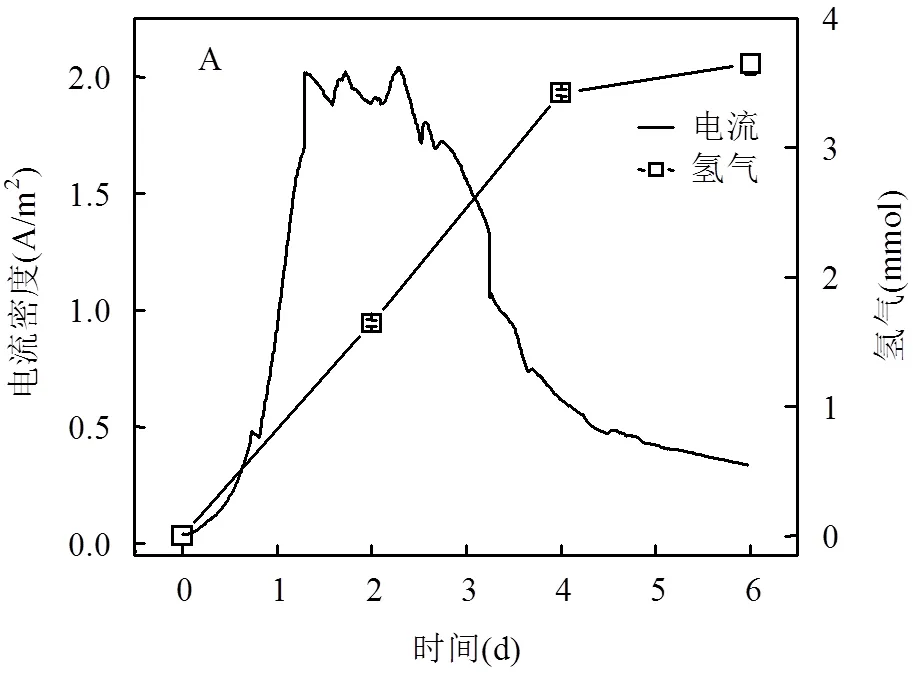
图3A为MEC阳极表面微生物形貌特征,可见在生物阳极表面形成了一层致密的生物膜,可推断生物阳极在经过6d的生长后变得相对成熟稳定.作为对比,阴极表面的微生物比较稀疏,这主要是因为相对于阳极测的产电菌,阴极侧的产氢功能菌群生长速度相对缓慢[21-22].

图3 MEC阳极(A)和阴极(B)SEM图
2.2 单室MES系统产甲烷性能特性
2.2.1 单室MES启动特性 由图4A可知,在为期21d的实验周期中,实验样的电流密度呈现先增加后降低的趋势,将经过pH调控的产氢发酵尾液加入单室MES中并运行8d后,实验样电流密度开始增长,并在15d时达到最大电流密度6.1A/m2,随后其电流密度降低至0.3A/m2,实验样2也呈现了相同趋势.然而,对照样在整个实验周期中几乎没有电流产生,表明对照样中没有电化学反应的发生.这主要因为对照样中pH值过低(~4.5),溶液中的微生物活性受到抑制,难以启动成功[8].由于微生物电合成系统中外电路的电子来源于阳极表面电化学活性微生物对有机物的氧化,因此上述结果表明,产氢发酵尾液中的确存在大量未降解有机物,其主要以小分子有机酸形式存在[5].由图4B可知,对照样在整个实验周期中没有甲烷产生,进一步证实了较低的pH值对具有电化学活性的微生物起到抑制作用.

实验样:采用单室MES处理经过pH值调控的暗发酵尾液(初始pH=8.7);对照样:采用单室MES处理未经pH调控的暗发酵尾液(初始pH=4.5);厌氧发酵:采用发酵处理未经pH值调控的尾液(初始pH=4.5)
2.2.2 单室MES反应器性能特性 为了进一步研究通过MEC调控pH值是一种有效的降解暗发酵尾液并提高产甲烷率的方式,实验对暗发酵尾液经过微生物电解池处理前后的pH值、COD及COD移除率进行了研究.由图5A可知,初始暗发酵尾液的pH值为4.5,暗发酵尾液经过双室MEC阴极产氢,接着转移到单室MES进行降解并伴随着甲烷的生成,经过降解后尾液最终的pH为7.5,而厌氧发酵样和对照样的暗发酵尾液pH基本没有变化.由图5B与C可知,实验样在反应前后的21d内, COD由5889mg/L显著降低至670mg/L,COD移除率高达89%.作为对比,在60d内对照样和单纯厌氧发酵样(AD)的COD从5889mg/L依次降低到5210mg/ L,5063mg/L,COD移除率依次为11%和14%.通过对比可见,实验样比厌氧发酵和对照样在单位时间内具有更加快速的产气速率级更高COD移除效率.上述结果表明,经过MEC调控pH值后再通过MES降解处理尾液产甲烷确有利于溶液中有机物的移除.

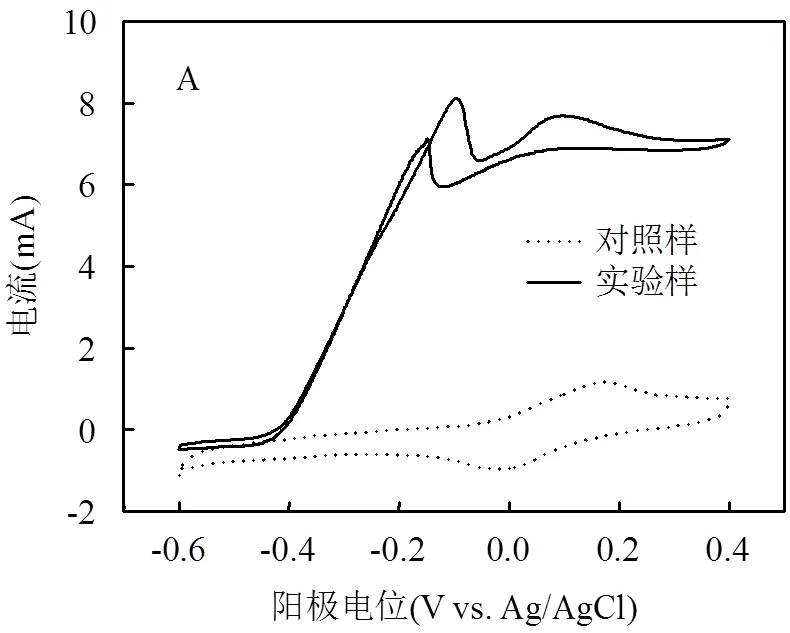
2.2.3 MES电极特性表征 从图6A可见,实验样开始出现氧化反应的起始电位是-0.4V,随着电位增加到-0.1V,出现氧化峰,此时电流达到最大为8.4mA.然而,在未经pH调控的对照样CV中开始出现氧化反应的起始电位为-0.1V,且直到0.2V才出现氧化峰,此时峰值电流只有1.2mA.可见,pH值对MES中电化学微生物影响很大. 图6B为MES阴极CV特性曲线,图中实验样和对照样阴极都是在-0.7V时开始发生还原反应,随着电位变得更负,还原反应更加剧烈.
为进一步研究电极表面生物膜情况,对MES阴阳两极进行SEM表征,如图6C, D, E, F所示.可见,对照样阴阳两极表面附着比较稀疏的生物膜,而实验样的阴阳两极表面均形成了致密的生物膜. 对于阳极表面微生物主要是长条椭圆形和短粗椭圆形构成的成片致密膜层,而阴极微生物主要是长条椭圆形微生物构成团簇分布在电极表面.
通过图6实验样和对照样的对比发现,低pH值(4.5)的产氢发酵尾液严重抑制微生物在MES中活性,即使经过60d培养,微生物在电极上的生长依旧极为缓慢;而经过产氢移除质子后的尾液,适合微生物生长,仅仅21d,在电极上形成了致密的生物膜,其电极也具有更好性能.
3 结论
3.1 在MEC中,随着阴极不断将H+还原为H2,发酵尾液pH值逐渐从4.5上升到8.7,pH的提高使得微生物活性恢复,这促进有机物进一步水解并伴随氢气产生,整个过程既实现调控暗发酵尾液pH值的目的,还实现氢气的回收(产氢3.65mmol).
3.2 使用厌氧发酵与MES构成的耦合系统处理调控后的尾液,在21d的降解处理时间内,甲烷产量达到18.8mmol,COD去除率达89%;反之,未经pH调控的暗发酵尾液在该系统中,60d内几乎无法被降解,甲烷产量几乎为零.与此同时,实验样也表现出更好的电流、电极性能,这一系列结果表明,经过pH调控后的尾液,更适合微生物生长,使得耦合系统具有更高的降解效率和产甲烷速率.
[1] Zhang D, Wang J, Lin Y, et al., Present situation and future prospect of renewable energy in China [J]. Renewable and Sustainable Energy Reviews, 2017,76:865-871.
[2] Chu S, Majumdar A, Opportunities and challenges for a sustainable energy future [J]. Nature, 2012,488(7411):294-303.
[3] 刘晶晶,孙永明,孔晓英,等.不同接种条件下微生物燃料电池产电特性分析 [J]. 中国环境科学, 2011,31(10):1651-1656. Liu J J, Sun Y M, Kong X Y, et al. Power-generation performance of microbial fuel cells with different inoculations [J]. China Environmental Science, 2011,31(10):1651-1656.
[4] 冯雅丽,于 莲,李浩然,等.微生物燃料电池降解焦化废水过程研究 [J]. 中国环境科学, 2018,38(11):4099-4105. Feng Y L, Yu L, Li H R, et al. The degradation process of coking wastewater by microbial fuel cells [J]. China Environmental Science, 2018,38(11):4099-4105.
[5] Kumar G, Shobana S, Nagarajan D, et al., Biomass based hydrogen production by dark fermentation-recent trends and opportunities for greener processes [J].Current Opinion in Biotechnology, 2018,50: 136-145.
[6] Seifert K, Zagrodnik R, Stodolny M, et al., Biohydrogen production from chewing gum manufacturing residue in a two-step process of dark fermentation and photofermentation [J]. Renewable Energy, 2018,122:526-532.
[7] Himmel M E, Ding S-Y, Johnson D K, et al., Biomass recalcitrance: engineering plants and enzymes for biofuels production [J]. Science, 2007,315(5813):804-807.
[8] Hwang M H, Jang N J, Hyun S H, et al., Anaerobic bio-hydrogen production from ethanol fermentation: the role of pH [J]. Journal of Biotechnology, 2004,111(3):297-309.
[9] Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: a review [J]. Bioresource Technology, 2008,99(10):4044- 4064.
[10] Hanaki K, Hirunmasuwan S, Matsuo T, Protection of methanogenic bacteria from low pH and toxic materials by immobilization using polyvinyl alcohol [J]. Water Research, 1994,28(4):877-885.
[11] Cai W, Han T, Guo Z, et al. Methane production enhancement by an independent cathode in integrated anaerobic reactor with microbial electrolysis [J]. Bioresource Technology, 2016,208:13-18.
[12] Ghimire A, Valentino S, Frunzo L, et al. Biohydrogen production from food waste by coupling semi-continuous dark-photofermentation and residue post-treatment to anaerobic digestion: A synergy for energy recovery [J]. International Journal of Hydrogen Energy, 2015,40(46): 16045-16055.
[13] Tao B, Passanha P, Kumi P, et al. Recovery and concentration of thermally hydrolysed waste activated sludge derived volatile fatty acids and nutrients by microfiltration, electrodialysis and struvite precipitation for polyhydroxyalkanoates production [J]. Chemical Engineering Journal, 2016,295:11-19.
[14] Dou Z, Dykstra C M, Pavlostathis S G. Bioelectrochemically assisted anaerobic digestion system for biogas upgrading and enhanced methane production [J]. Science of the Total Environment, 2018,633: 1012-1021.
[15] Park J, Lee B, Tian D, et al. Bioelectrochemical enhancement of methane production from highly concentrated food waste in a combined anaerobic digester and microbial electrolysis cell [J]. Bioresource Technology, 2018,247:226-233.
[16] Rabaey K, Rozendal R A. Microbial electrosynthesis - revisiting the electrical route for microbial production [J]. Nature Reviews Microbiology, 2010,8(10):706-716.
[17] Balch W, Fox G, Magrum L, et al. Methanogens: reevaluation of a unique biological group [J]. Microbiological reviews, 1979,43(2):260.
[18] Nichols E M, Gallagher J J, Liu C, et al. Hybrid bioinorganic approach to solar-to-chemical conversion [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015,112(37): 11461-11466.
[19] Findlay R H, King G M, Watling L. Efficacy of phospholipid analysis in determining microbial biomass in sediments [J]. Applied and Environmental Microbiology, 1989,55(11):2888-2893.
[20] Lee Y J, Miyahara T, Noike T. Effect of pH on microbial hydrogen fermentation [J]. Journal of Chemical Technology & Biotechnology, 2002,77(6):694-698.
[21] Jourdin L, Freguia S, Donose B C, et al. Autotrophic hydrogen- producing biofilm growth sustained by a cathode as the sole electron and energy source [J]. Bioelectrochemistry, 2015,102:56-63.
[22] Katuri K, Ferrer M L, Gutiérrez M C, et al. Three-dimensional microchanelled electrodes in flow-through configuration for bioanode formation and current generation [J]. Energy & Environmental Science, 2011,4(10):4201.
Degradation of dark fermentation effluents for biogas production using bioelectrochemical systems.
LU Jian-hong1,2, LI Zhuo1,2, SUN Chi-He1,2, FU Qian1,2*, LI Jun1,2, ZHANG Liang1,2, LIAO Qiang1,2, ZHU Xun1,2
(1.Key Laboratory of Low-grade Energy Utilization Technologies and Systems, Ministry of Education, Chongqing University, Chongqing 400030, China;2.Institute of Engineering Thermophysics, School of Energy and Power Engineering, Chongqing University, Chongqing 400030, China)., 2019,39(10):4157~4163
Dark fermentation for H2production was a promising bioenergy, as it could use straw and/or wastewater containing high organics as raw materials. The accumulated volatile fatty acids (VFAs), which were produced during the process of hydrogen fermentation, significantly inhibit the process of hydrogen production in the dark fermentation. Herein, bioelectrochemical system (BES) was used to treat the effluent of dark fermentation. A microbial electrolysis cell (MEC) was firstly used to treat the effluents of dark fermentation. Accompanied with hydrogen production in MEC, the pH value of the effluents increased from 4.5 to 8.7. Then the near-neutral effluents were used for methane production using a single-chamber microbial electrosynthesis system (MES), in which methanogens acted as biocatalysts to reduce CO2to CH4. The results showed that the chemical oxygen demand (COD) removal efficiency and CH4production rate of single-chamber MES were 89% and 4.5mmol/(L×d), respectively, significantly higher than that without any treatment.
bioelectrochemical system;dark fermentation effluents;adjusting pH;degradation of organic solutions;methane
X703
A
1000-6923(2019)10-4157-07
卢建宏(1991-),男,广西桂林人,重庆大学硕士研究生,主要从事微生物电化学系统阴极还原二氧化碳成甲烷的研究.
2019-03-18
国家自然科学基金资助项目(51776025,51622602,51606022);重庆市留学人员创业创新支持计划(cx2017017);中央高校基本科研业务经费项目(2018CDXYDL0001)
* 责任作者, 研究员, fuqian@cqu.edu.cn
