厌氧反硝化产甲烷体系中喹啉与吲哚共基质的降解特性
2019-10-23高艳娟岳秀萍段燕青张智春罗艳红
高艳娟,岳秀萍,段燕青,张智春,张 潇,罗艳红
厌氧反硝化产甲烷体系中喹啉与吲哚共基质的降解特性
高艳娟,岳秀萍*,段燕青,张智春,张 潇,罗艳红
(太原理工大学环境科学与工程学院,山西 太原 030024)
研究了厌氧反硝化产甲烷体系中,典型含氮杂环化合物喹啉、吲哚作为共基质碳源,厌氧生物对二者的降解特性,及群落分析.结果表明:在共基质条件下,喹啉的存在对吲哚的生物降解有抑制作用,且抑制随喹啉浓度的升高而升高;吲哚的存在对喹啉的生物降解有促进作用,但吲哚浓度过高(150mg/L)抑制了喹啉的降解;喹啉、吲哚共基质时,二者的降解都遵循零级反应动力学;通过GC-MS分析,喹啉的主要中间代谢产物分别为2(1H)喹诺酮与8-羟基-2(1H)喹诺酮;吲哚的主要代谢产物为2-吲哚酮与靛红;通过高通量测序对共基质体系的微生物群落进行分析,发现厌氧功能菌群得到富集,细菌菌门以变形菌门Proteobacteria为主,菌纲以Gammaproteobacteria和Betaproteobacteria为主,菌属以,,,和为主.
厌氧;反硝化产甲烷;共基质;中间产物;微生物群落
含氮杂环化合物普遍存在于焦化废水、制药废水、染料废水和农药废水中,具有致突变性,致癌性,致畸性等特点,是一种难降解的有毒有机污染物[1],对其无害化处理非常难,如何使其被微生物利用,降低毒性,解决出水水质多年来难以达标的难题,一直是工业废水处理的热点. 当前,关于含氮杂环化合物的处理方法主要有物理化学法和生物法.物理化学法的成本过高,且有些方法会造成二次污染,不适用于大量废水的处理[2].生物法是利用污泥中的微生物进行降解,其成本低、管理方便及对有机物可有效利用[3],其中生物降解中的厌氧耦合反硝化产甲烷技术由于其较高的降解率,对含氮杂环化合物的高效处理,且可以在单一反应器内实现同时除碳脱氮,具有节约成本,能源回收等优点日益被人们关注[4].
喹啉、吲哚作为典型的含氮杂环化合物,已经引起了广泛关注[1,5].Berry等[6-7]研究了厌氧反硝化情况下,含氮杂环化合物的生物降解特性,揭示了杂环化合物的降解途径.Li等[8]研究了喹啉、吲哚单基质在厌氧反硝化下的降解特性,发现降解速率为吡啶>吲哚>喹啉.国内外大部分研究都是用喹啉、吲哚作为单独碳源,但在实际废水中,含氮杂环化合物通常是以共基质的状态存在的,了解共基质体系中的降解十分重要.Li等[9]研究了在缺氧反应器中,利用活性污泥法,在共基质条件下,吡啶对吲哚的降解具有促进作用.Zhao等[10]利用活性炭的吸附,分析了苯酚与吲哚共基质的降解特征,发现苯酚促进了吲哚的降解.但有关喹啉、吲哚共基质间的共代谢作用、两者降解过程中的相互影响研究报导甚少,且在共基质体系中代谢产物的转化、微生物群落结构的特征亟待研究.
因此,本文在厌氧反硝化产甲烷体系中,选取喹啉与吲哚共基质作为碳源与电子供体,NO3−-N作为电子受体,考察喹啉、吲哚在共基质条件下的降解特性和降解动力学特征,对中间降解产物进行分析,且利用高通量技术研究微生物菌群群落特征,以期为基于厌氧反硝化产甲烷技术在降解含氮杂环化合物的实际应用提供理论依据.
1 材料与方法
1.1 装置与材料
实验采用序批式有机玻璃反应器,容积为500mL,上部设有取样口,取样口用止水夹使其密封.反应器放入恒温摇床培养箱中,进行恒温培养,摇床温度为35℃,转速为40r/min.取样间隔时间为1d,每次取上清液5mL,以转速10000r/min离心10min后测定喹啉、吲哚的浓度.
实验接种污泥取自稳定运行的焦化废水厂厌氧段污泥(MLVSS=3000g/L),对接种污泥进行预处理,先曝气1h以上,再用蒸馏水反复冲洗污泥,将污泥中的杂质、无机物与有机物去除干净,再用N2曝气20min,去除污泥中的溶解氧,使ORP低于-120mV以下.预处理完后,将污泥与配水以1:3的比例加入到反应器中,再用N2曝气10min,去除溶液中的氧气.
实验配水采用人工配水,以喹啉、吲哚作为共同碳源,分2个实验组,第一实验组吲哚浓度不变(150mg/L),喹啉浓度递增:0,50,100,150mg/L;第二个实验组喹啉浓度不变(150mg/L), 吲哚浓度递增:0,50,100,150mg/L.每个小组设置3个平行.以NaNO3为氮源,同时添加微生物生长所必需的微量元素与常量元素.固定NaNO3浓度为30mg/L,投加常量元素KH2PO4、CaCl2、MgSO4,投加量按N:P: Ca:Mg=28:6:1:1[8];投加微量元素的组成与含量(g/L): FeCl2•4H2O(1.422),ZnSO4•7H2O(0.23), CuSO4•5H2O (0.39),CoCl2•6H2O(0.05),NaMoO4(0.23),NiCl2•6H2O (0.081),Na2SeO3(0.011), H3BO4(0.02), EDTA(5), MnCl2•4H2O(0.2).维生素的组成与含量(g/L):生物素(2.00),硫胺素(5.00),盐酸吡哆醇(10.00),D-泛钙酸(5.00),硫辛酸(5.00),叶酸(2.00),核黄素(5.00),烟酸(5.00),对氨基苯甲酸(5.00), 维生素B12(0.10).溶液的初始pH用1mol/L NaOH 溶液和 ( 1+9) HCl调节到7.0.
1.2 实验方法
1.2.1 污泥的驯化与测量指标 接种污泥在厌氧反应器中,经过60d的驯化培养,每间隔7d换1次水,使喹啉、吲哚的降解率达到90%以上,反应体系基本到稳定状态.此后进行喹啉、吲哚共基质的降解研究.喹啉、吲哚的测量用液相色谱(HPLC),流动向为甲醇与水(60:40),流动速率为1mL/min,喹啉的测量波长为313nm,吲哚的测量波长为270nm;喹啉的代谢产物2(1H)喹诺酮的测量波长为276nm; 吲哚代谢产物2-吲哚酮的检测波长是247nm.本实验所用的药品均为可购买的分析纯药品.
1.2.2 高通量群落分析 厌氧反硝化产甲烷污泥对喹啉、吲哚的去除率达到100%后,取接种污泥样品(S0),共基质实验组中污泥样品(S1)进行高通量微生物群落分析.污泥样品以12000r/min离心10min,置于-20℃保存以备DNA提取.DNA的提取与PCR的扩增均通过上海生工技术公司进行,方法按照之前报道的文章[11],细菌引物为341F (5′-CCCTACA- CGACGCTC-TTCCGATCTG-3′) and 805R(5′-GA- CTGGAGTTCCTTGGCACC-CGAGAATTCCA-3′).
1.2.3 中间代谢产物分析 采用GC-MS技术分析吲哚、喹啉降解过程中的代谢产物.GC-MS色谱柱为石英毛细管柱(30m×0.25mm×0.25µm),GC-MS分析条件:载气为氦气,流速为1.0mL/min;进样口温度为310℃,采用程序升温,气化室温度为100℃保持1min,再以5℃/min 增到210保持2min,采集模式采用全扫检测模式,范围为50~600.
2 结果与分析
2.1 吲哚与喹啉共基质条件下降解特性
在厌氧反硝化产甲烷体系中,吲哚与喹啉共基质时,两物质均能被很好地降解,吲哚(150mg/L)随喹啉浓度变化(0,50,100,150mg/L)的生物降解情况如图1(a).由图1可知,吲哚单基质时,其在48h内降解完,降解率达到100%;共基质时,当喹啉浓度从50mg/L升高到150mg/L,吲哚的降解率从100%降低到92.8%,降解时间从72h 延长到96h.分析得随着喹啉浓度的提高,喹啉对吲哚的降解产生抑制作用,且浓度越高,抑制作用越强,这是由于喹啉的毒性较大[12],喹啉的存在对微生物产生毒性,减弱了菌群对吲哚的利用.
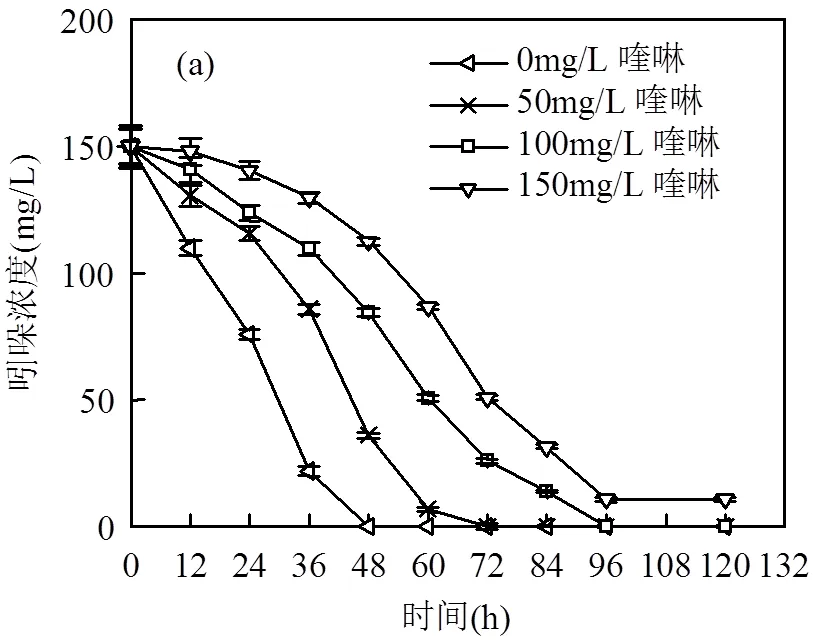
喹啉(150mg/L)随吲哚浓度变化(0,50,100, 150mg/L)的生物降解情况如图1(b).分析图1(b)可知,喹啉单基质时,其在72h降解完,降解率达100%;共基质时,吲哚浓度为50,100mg/L,喹啉降解时间减少到60、48h,而吲哚为150mg/L时,喹啉降解时间延长到84h.分析得当吲哚低于100mg/L,对喹啉的降解有促进作用,且促进作用随浓度的升高而增大,这是由于吲哚的降解速率较快[8],吲哚降解过程中,促进了微生物的新陈代谢,增加了生物量,致使喹啉降解速率加快;反之达到150mg/L时,吲哚对喹啉的降解产生抑制,这由于吲哚过量时,其毒性变大,影响了微生物的活性,降低了喹啉的降解速率.
2.2 喹啉与吲哚共基质时降解动力学方程
喹啉与吲哚共基质时的降解速率按零级反应进行曲线拟合,结果见表1、2.从表中可以看出,两者生物降解都遵循零级反应动力学.在表1中,吲哚单基质时,反应速率常数为3.23mg/(L·h),加入50,100, 150mg/L喹啉后,反应速率分别降低到2.31,1.72, 1.43mg/(L·h),进一步说明了在共基质中,喹啉对吲哚的降解有抑制作用,且这种抑制作用随喹啉投加量的增加而增大.在表2中,喹啉单基质时,反应速率常数为2.32mg/(L·h),而加入50,100mg/L吲哚后,喹啉降解速率加快,反应速率常数显著增加,升高到2.69, 3.19mg/(L·h),说明了吲哚的存在,对喹啉的降解有促进作用;但吲哚浓度升高到150mg/L,喹啉的反应速率常数为1.92mg/(L·h),反映了吲哚浓度过高,促进作用消失,对喹啉的降解产生了抑制,这是由于吲哚降解提高了的生物量产生对喹啉降解的促进作用,小于过高浓度吲哚对微生物的毒性的抑制作用,导致喹啉降解减慢.结果与之前研究类似,苯酚浓度的增长(100~200mg/L)促进了吲哚中间产物的形成,但是由于苯酚的毒性,过高浓度的苯酚(>200mg/L)反而抑制了吲哚中间产物的产生[13].
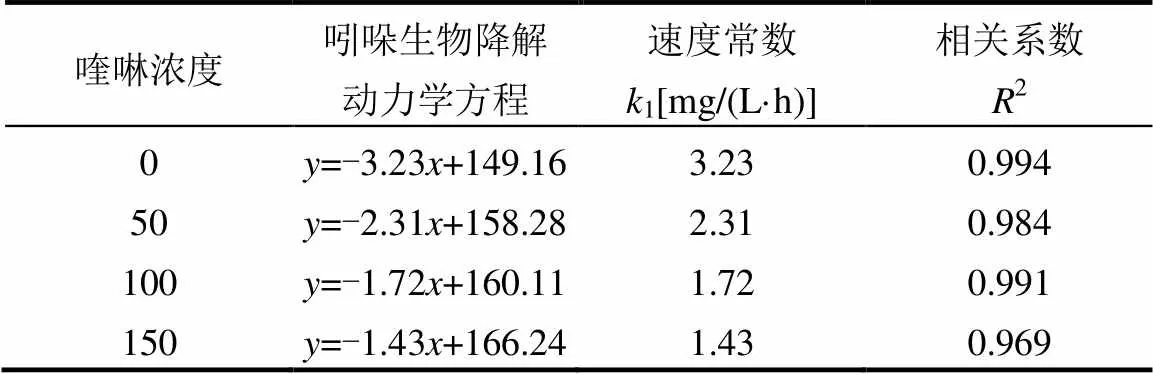
表1 吲哚降解随喹啉浓度变化的动力学方程
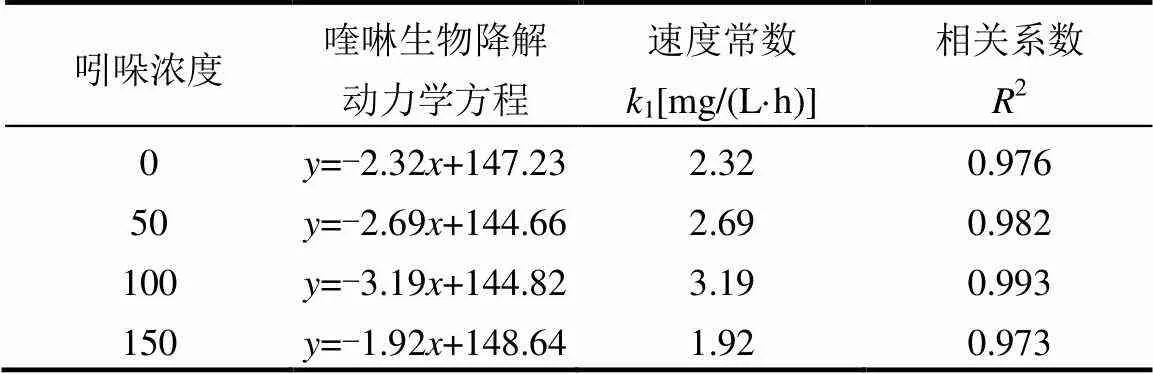
表2 喹啉降解随吲哚浓度变化的动力学方程
2.3 喹啉与吲哚共基质时的降解产物分析
由GC-MS分析(图2)可见,在喹啉厌氧降解过程中,·OH攻击2位生成2(1H)喹诺酮,其继续被氧化生成8-羟基-2(1H)喹诺酮.此途径与Shukla报道的喹啉的降解途径一致[14],随后氮杂环开环,最后被转化为二氧化碳和水.吲哚在降解过程中,在C-2位与×OH形成中间产物2-吲哚酮,再羟基化形成靛红,此途径与Madsen报道的,厌氧反硝化中吲哚降解途径相似[15],其随后羧基化形成邻氨基苯甲酸,最后转化成二氧化碳与水.但是本试验中并未检测到2,3-二羟基苯丙酸与邻氨基苯甲酸,可能与化合物自身的不稳定性或者中间代谢产物较快的代谢速率有关.
为了研究共基质下中间产物的代谢情况,选取最初的代谢产物2(1H)喹诺酮与2-吲哚酮,分析二者的代谢情况,见图3.从图3(a)可见,吲哚的中间产物2-吲哚酮均先升高后降低,随着喹啉浓度的增高(0~150mg/L),2-吲哚酮积累量增高且降解时间延长,降解速率逐渐变慢(1.87~0.75mg/(L×h)).说明共基质时,喹啉抑制了吲哚中间产物的形成和转化.由图3(b)可见,喹啉的中间代谢产物2(1H)喹诺酮同样呈现先升高后降低的趋势,随着吲哚浓度的增加(0~100mg/L),2(1H)喹诺酮的积累量减少、降解时间缩短及速率加快(1.14~1.45mg/(L×h)),但吲哚增到150mg/L,2(1H)喹诺酮积累量增高,降解速率变慢(0.83mg/(L×h)).说明了适量的吲哚促进了喹啉中间产物的形成和降解,提高了中间产物的代谢速率.
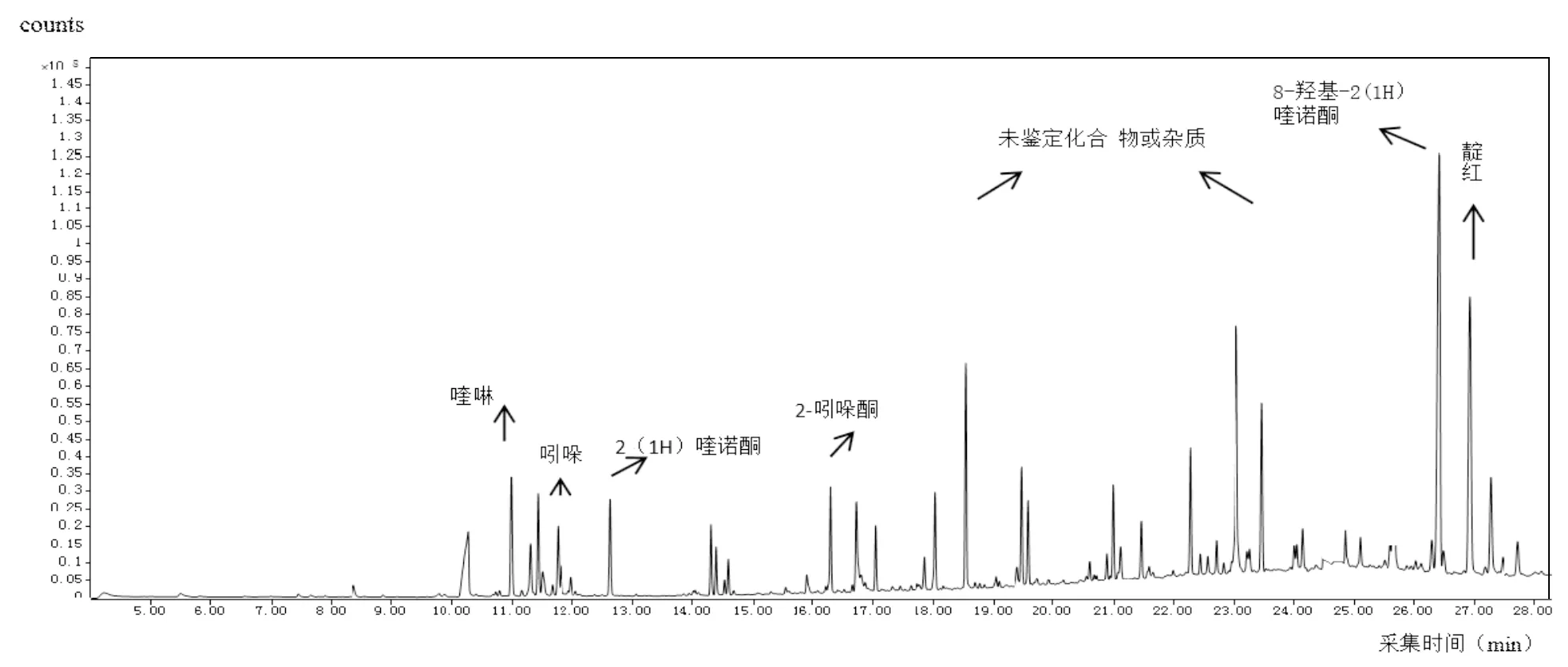
图2 喹啉与吲哚降解过程过程中72h的GC-MS谱图
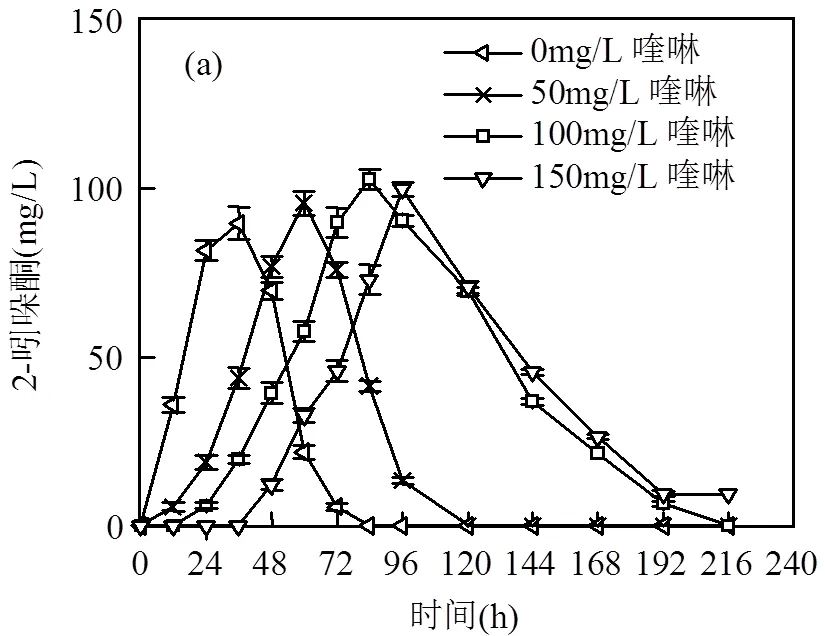
图3 在厌氧反硝化产甲烷条件下,喹啉与吲哚共基质时中间产物的形成与降解
2.4 喹啉与吲哚共基质下微生物群落分析
选取共基质下的厌氧污泥(S1)与接种污泥(S0),进行高通量群落分析,微生物的门、纲、属结果见图4.从图4(a)看出,在厌氧反硝化产甲烷体系中,细菌菌门以变形菌门Proteobacteria为主,这种菌门具有在反硝化过程中,利用硝酸盐氮为电子受体,降解杂环化合物的功能[16],在共基质污泥体系中, Proteobacteria的相对丰度从32.35%(S0)富集到56.88%(S1),成为喹啉、吲哚共基质体系中优势菌门.Chloroflexi是绿弯菌门,它是一种厌氧菌,被普遍发现存在于厌氧反硝化产甲烷体系中,在喹啉、吲哚共基质体系中,也占用较高丰度(14.23%).菌门Bacteroidetes是拟杆菌门,研究者发现,拟杆菌门是污水生物处理细菌菌群的重要组成成分[17]; Acidobacteria是酸杆菌门,据报道它是厌氧发酵产甲烷体系中的重要菌群[18],在厌氧反硝化产甲烷共基质体系中,Bacteroidetes和Acidobacteria 相对丰度均分别从S0中4.73%和1.73%升高到S1中5.85%和3.68%,成为重要菌群.Bacteroidetes和Acidobacteria这两个菌门可以将喹啉、吲哚等难降解的大分子含氮杂环化合物转化为小分子等易降解有机物,例如乙酸、丙酸、戊酸等,容易被菌种利用,进而进行产甲烷[19].
从图4(b)中看出,共基质体系中,细菌菌纲以Gammaproteobacteria, Betaproteobacteria和Alphaproteobacteria为主,这三个菌纲都属于变形菌门(Proteobacteria).这类型菌群在厌氧污水处理,污染物的降解与厌氧污泥形成的过程中发挥着十分重要的代谢功能,适用于降解多环芳烃等多种有机物的降解[20].菌纲Gammaproteobacteria和Betaproteobacteria的相对丰富均分别从11.4%、8.52%(S0)升高到24.16%、16.69% (S1),说明对比接种污泥,经过长时间驯化,共基质体系中降解喹啉、吲哚的功能菌群得到富集.
对细菌的菌属做了进一步的分析,结果见图4(c).属于菌纲Gammaproteobacteria,它具有一定的反硝化能力,可将硝酸盐氮还原为氮气,并且在厌氧污泥中矿化芳香族化合物的功能[21-22],常存在于降解含氮杂环化合物的厌氧污泥中.据报道,在合适的生存体系中,可以通过IifC酶对吲哚、喹啉进行氧化和降解[21].因此,菌属成为共基质体系中相对丰度最高的功能菌属,从S0中2.57%升高到S1中15.73%.的相对丰度从0.02%(S0)升高到5.06%(S1),研究发现具有一定的反硝化功能,被发现存在于吲哚和喹啉的降解污泥中,可以在反硝化过程中利用硝酸盐氮作为电子受体,氧化有机物[23].菌属的相对丰度升高到3.26%(S1),它常存在于厌氧有机物降解的污泥中,具有反硝化功能[24],成为共基质降解的重要菌属.菌属普遍存在于厌氧发酵污泥中,研究发现它是一种H2利用细菌,可以利用丙酮酸、乳酸、甲酸盐和H2作为电子供体,在发酵反应中产甲烷[25].菌属从0.34%(S0)增高到1.65% (S1),反映了它利用喹啉、吲哚降解产生的小分子物质,进行发酵反应,产甲烷的特性.其他功能菌属如:,等,都具有一定的反硝化,降解有机物的功能[26],在共基质群落中占有十分重要的作用.

(a) 菌门;(b) 菌纲;(c) 菌属
综上所述,在厌氧反硝化产甲烷体系中,喹啉、吲哚共基质条件下,其微生物种群分属于菌门Proteobacteria, Chloroflexi, Bacteroidetes和Acidobacteria;菌纲以Gammaproteobacteria, Betaproteobacteria和Alphaproteobacteria为主;功能菌属中最重要的是、、和,其他功能菌属也在喹啉、吲哚降解中发挥着重要作用.
3 结论
3.1 在厌氧反硝化产甲烷共基质体系中,喹啉对吲哚的降解产生抑制作用,浓度越高,抑制作用越强;吲哚(<100mg/L)对喹啉的降解有一定的促进作用,但达到150mg/L后,促进作用消失.
3.2 喹啉、吲哚共基质下的降解均符合零级反应动力学.
3.3 共基质时喹啉的主要代谢产物为2(1H)喹诺酮与8-羟基-2(1H)喹诺酮;吲哚的主要代谢产物为2-吲哚酮与靛红.
3.4 喹啉、吲哚共基质时,微生物菌门主要以: Proteobacteria、Chloroflexi、Bacteroidetes和Acidobacteria为主菌纲以Gammaproteobacteria, Betaproteobacteria和Alphaproteobacteria为主,菌属以、、和为主.
[1] 张玉秀,朱康兴,柴团耀,等.喹啉降解菌sp.的降解特性与生物强化作用 [J]. 中国环境科学, 2017,37(6):2340-6. Zhang Y X, Zhu K X, Cai T Y, et al. Bioaugmentation and characteristics of a quinoline-degrading strainsp. [J]. China Environmrntal Science, 2017,37(6):2340-6.
[2] Mandal T, Maity S, Dasgupta D, et al. Advanced oxidation process and biotreatment: Their roles in combined industrial wastewater treatment [J]. Desalination, 2010,250(1):87-94.
[3] Schwarz G, Senghass E, Erben A, et al. Microbial metabolism of quinoline and related compounds : I. Isolation and characterization of quinoline-degrading bacteria [J]. Systematic and Applied Microbiology, 1988,10(2):185-90.
[4] Mosquera-corral A, Sanchez M, Campos J L, et al. Simultaneous methanogenesis and denitrification of pretreated effluents from a fish canning industry [J]. Water Research, 2001,35(2):411-8.
[5] 周洪政,刘 平,张 静,等.微气泡臭氧催化氧化-生化耦合处理难降解含氮杂环芳烃 [J]. 中国环境科学, 2017,37(8):2978-85. Zhou H Z, Liu P, Zhang J, et al. Removal of refractory nitrogen- containing heterocyclic aromatics by combination treatment of microbubble catalytic ozonation and biological process [J]. China Environmrntal Science, 2017,37(8):2978-85.
[6] Berry D F, Francis A J, Bollag J M, et al. Microbial metabolism of homocyclic and heterocyclic aromatic compounds under anaerobic conditions [J]. Microbiological Reviews, 1987,51(1):43.
[7] Berry D F, Madsen E L, Bollag J M. Conversion of indole to oxindole under methanogenic conditions [J]. Applied and Environmental Microbiology, 1987,53(1):180-2.
[8] Li Y M, Gu G W, Zhao J F. Anoxic degradation of nitrogenous heterocyclic compounds by acclimated activated sludge [J]. Process Biochemistry, 2001,37(1):81-6.
[9] Li Y, Li W, Gu G. Promotive effect of pyridine on indole degradation by activated sludge under anoxic conditions [J]. Frontiers of Environmental Science and Engineering in China, 2007,1(4):493-7.
[10] Zhao Q, Han H, Jia S, et al. Adsorption and bioregeneration in the treatment of phenol, indole, and mixture with activated carbon [J]. Desalination and Water Treatment, 2015,55(7):1-9.
[11] Zhou A, Zhang J, Varrone C, et al. Process assessment associated to microbial community response provides insight on possible mechanism of waste activated sludge digestion under typical chemical pretreatments [J]. Energy, 2017,137.
[12] 全向春,王建龙,韩力平,等.喹啉与葡萄糖共基质条件下生物降解的动力学分析 [J]. 环境科学学报, 2001,21(4):416-9. Quan X C, Wang J L, Han L P, et al. Biodegradation kinetics of a mixture containing quinoline and glucose by burkholderia pickettii strain [J]. Act Scientiae Circumstantiae, 2001,21(4):416-9.
[13] Wang J, Zhang X, Fan J, et al. Indigoids biosynthesis from Indole by two phenol-degrading strains,sp. PI1 andsp. PI2 [J]. Applied Biochemistry and Biotechnology, 2015,176(5): 1263-76.
[14] Shukla O P. Microbial transformation of quinoline by asp. [J]. Applied and Environmental Microbiology, 1986,51(6):1332.
[15] Madsen E L, Bollag J M. Pathway of indole metabolism by a denitrifying microbial community [J]. Archives of Microbiology, 1988,151(1):71-6.
[16] Zhang X, Hua X, Yue X. Comparison of bacterial community characteristics between complete and shortcut denitrification systems for quinoline degradation [J]. Applied Microbiology and Biotechnology, 2016,101(4):1-11.
[17] Juretschko S, Loy A, Lehner A, et al. The microbial community composition of a nitrifying-denitrifying activated sludge from an industrial sewage treatment plant analyzed by the full-cycle rRNA approach [J]. Systematic and Applied Microbiology, 2002,25(1): 84-99.
[18] Chen K C, Lin Y F. The relationship between denitrifying bacteria and methanogenic bacteria in a mixed culture system of acclimated sludges [J]. Water Research, 1993,27(12):1749-59.
[19] Keyser M, Witthuhn R C, Lamprecht C, et al. PCR-based DGGE fingerprinting and identification of methanogens detected in three different types of UASB granules [J]. Systematic and Applied Microbiology, 2006,29(1):77-84.
[20] Moura A, Tacao M, Henriques I, et al. Characterization of bacterial diversity in two aerated lagoons of a wastewater treatment plant using PCR-DGGE analysis [J]. Microbiological Research, 2009,164(5): 560-9.
[21] Lin G H, Chen H P, Shu H Y. Detoxification of indole by an indole- induced flavoprotein oxygenase from acinetobacter baumannii [J]. Plos One, 2015,10(9):e0138798.
[22] Su J F, Zheng S C, Huang T L, et al. Simultaneous removal of Mn(II) and nitrate by the manganese-oxidizing bacteriumsp. SZ28 in anaerobic conditions [J]. Geomicrobiology, 2016,33(7):586- 591.
[23] Vaz-moreira I, Figueira V, Lopes A R, et al.gen. nov., sp. nov. andsp. nov., isolated from sewage sludge compost [J]. Int. J. Syst. Evol. Microbiol., 2011,61(9):2238-46.
[24] Nam J-H, Ventura J-R, Tae I, et al. A novel perchlorate- and nitrate-reducing bacterium, Azospira sp. PMJ [J]. Applied Microbiology & Biotechnology, 2016,100:1-14.
[25] Krumholz L R, Harris S H, Tay S T, et al. Characterization of two subsurface H2-utilizing bacteria,sp. nov. andsp. nov., and their ecological roles [J]. Applied and Environmental Microbiology, 1999, 65(6):2300.
[26] Leahy J G, Olsen R H. Kinetics of toluene degradation by toluene‐oxidizing bacteria as a function of oxygen concentration, and the effect of nitrate [J]. Fems Microbiology Ecology, 1997,23(1):23–30.
Degradation of quinoline and indole co-substrate under anaerobic denitrification and methanogenesis conditions.
GAO Yan-juan, YUE Xiu-ping*, DUAN Yan-qing, ZHANG Zhi-chun, ZHANG Xiao, LUO Yan-hong
(College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan 030024, China).e, 2019,39(10):4150~4156
Bath experimrnts were conducted to study the degradation characteristics and microbial community of quinoline and indoles co-substrate under anaerobic denitrification and methanogenesis conditions, which were known as typical N-heterocyclic compounds.The results showed that the presence of quinolone could inhibit the degradation of indole, and the inhibition effect was enhanced with the increase of quinoline concentration; the presence of indole could promote the degradation of quinoline, but the high concentration of indole (150mg/L) inhibited the degradation of quinolone; the kinetics of quinoline and indole was followed the zero-order kinetics model; through GC-MS analyses, the intermediate metabolites of quinoline were 2-hydroxyquinoline and 2,8-dihydroxyquinoline; and metabolites of indole were oxindole and isatin. The high-throughput sequencing technology was used to analyze the microbial community structure, and results indicated that the functional bacterial were enriched in the anaerobic denitrification and methanogenesis system. The bacterial phylum was Proteobacteria, the dominant classes were Gammaproteobacteria and Betaproteobacteria, and the dominant genera were,,,and.
anaerobic;denitrification and methanogenesis;co-substrate;intermediate metabolites;microbial communit
X703
A
1000-6923(2019)10-4150-07
高艳娟(1988-),女,山西吕梁人,博士,主要从事水污染控制与研究方面研究.发表论文1篇.
2019-03-27
国家自然科学基金资助项目(51378330)
* 责任作者, 教授, yuexiuping@tyut.edu.cn
