酯基链微增长对咪唑类离子液体的导电行为和热稳定性影响
2019-10-22赵亚梅刘星悦忽卫鑫
赵亚梅,杨 靖,刘星悦,忽卫鑫,邵 旭
(1.西安工程大学 环境与化学工程学院,陕西 西安 710048;2.西安工程大学 城市规划与工程学院,陕西 西安 710048)
0 引 言
作为新型的反应介质和软功能材料[1],离子液体(ILs)是由有机阳离子和有机/无机阴离子构成的低温熔融盐[2],具有极低的蒸汽压、良好的离子导电性、较宽的电化学窗口及较高的热稳定性、结构可设计性等特性,引起研究者的广泛关注。通过阳离子和阴离子的不同组合,或在其结构上引入不同的功能基团,如羟基[3-4]、磺酸基[5]、氨基[6-7]、亚硫酸氢基[8]、羧基[9-10]等,用以实现其结构与性能的调控,离子液体功能化是其领域研究的重要内容之一。结构调变使得离子液体的阴阳离子之间相互作用发生了变化,对阴阳离子对的有序分布、离子迁移能力等产生了一定的影响,在溶液中形成某种特殊的离子型微观环境,为新型材料制备[11-15]、分离新技术[16-17]、化学反应[18-19]等方面提供了一种的新思路和方法。
近年来,本课题一直致力于咪唑类和吡啶类离子液体的功能化研究[20-23],在前期研究基础上,文中采用一步合成法,将乙酸甲酯基和乙酸乙酯基分别引入以1,2-二甲基咪唑分子结构中,合成了2种具有良好离子导电功能的新型咪唑类离子液体:氯化1-乙酸甲酯基-2,3-二甲基咪唑离子液体(IL1)和氯化1-乙酸乙酯基-2,3-二甲基咪唑离子液体(IL2)。利用1H NMR、IR和元素分析对2种离子液体化学结构进行表征,并研究IL-H2O溶液体系的导电动力学、IL1和IL2的电化学窗口和热分解行为等。
1 实 验
1.1 试剂与仪器
1.1.1 仪器 Bruker Avance III 400 MHz型核磁共振仪(瑞士布鲁克公司);FT-IR 8400型红外光谱仪(KBr压片,日本岛津公司);Vario EL III型元素分析仪(德国Elementar公司);Bio-Logic SP-200型电化学工作站(法国比奥罗杰公司);DDS-11A型电导率仪(DJS—1铂黑电导电极,上海雷磁创益仪器仪表有限公司);TGA/SD TA85型热重分析仪。
1.1.2 试剂 1,2-二甲基咪唑(化学纯,北京百灵威科技有限公司);氯代乙酸甲酯、氯代乙酸乙酯、丙酮(均为化学纯,国药集团化学试剂有限公司)。
1.2 合成及制备


IL1及IL2离子液体的合成过程及结构如图1所示。

(a) 合成过程(n=1,2)

(b) IL1 (c) IL2图 1 离子液体的合成Fig.1 Synthesis of ionic liquids
2 结果与讨论
2.1 温度、浓度对体系电导率的影响
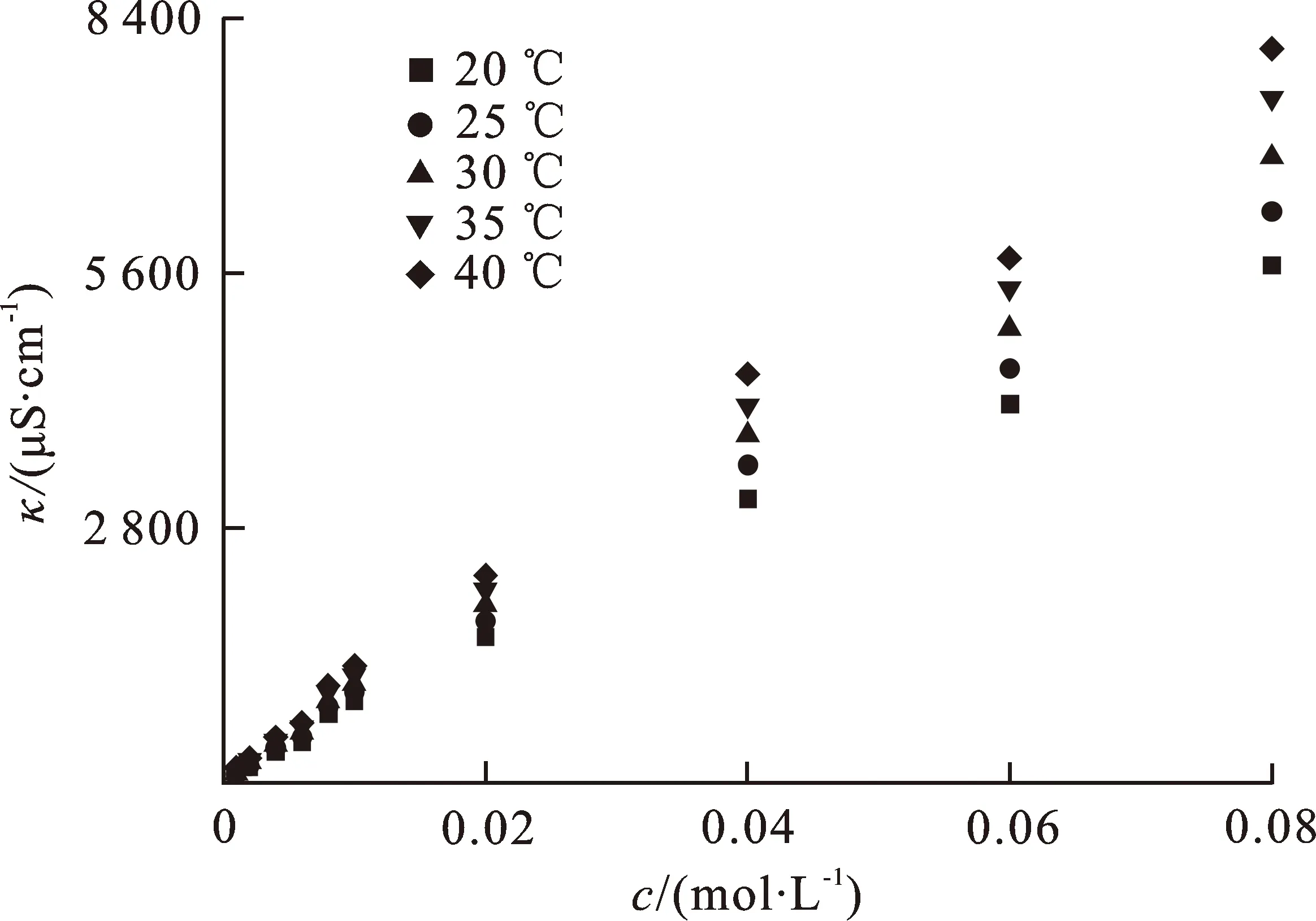
在温度20~45 ℃(293.15~318.15 K)范围内,低浓度条件下IL1-H2O和IL2-H2O体系的电导率κ值随离子液体IL1和IL2的浓度(c)变化如图2所示。
(a) IL1-H2O

(b) IL2-H2O图 2 体系导电率随温度和浓度变化Fig.2 Influence of concentration and temperature on the conductivity of systems
从图2可看出,该条件下IL1-H2O和IL2-H2O体系的电导率随温度的升高显著增大。温度升高有助于离子液体IL1和IL2在水中解离,增大了阴阳离子的迁移速度。同时,在相同温度下IL1-H2O和IL2-H2O体系的电导率随其离子液体浓度的增大而增大。原因是低浓度下IL-H2O的黏度较低,体系中离子液体主要以解离的阴阳离子形式存在,分子间相互作用较弱,浓度增大使得体系的离子数目显著增多,导致其电导率增大。
2.2 IL1-H2O和IL2-H2O体系的导电动力学
将IL-H2O体系的电导率对数lnκ与1 000T-1进行拟合,拟合曲线如图3所示。由图3可知,在20~45 ℃(293.15~318.15K),lnκ与1 000T-1的拟合曲线呈良好的线性关系,表明这两个体系的导电行为符合阿伦尼乌斯经验公式,即
lnκ=-E/(RT)+lnA
(1)
式中:A为指前因子;E为电导活化能(离子跃迁到自由空穴所需要的能量);R为摩尔气体常量;-E/R为斜率。E及A的数值见表1。

(a) IL1-H2O

(b) IL2-H2O(a—0.01 mL·L-1;b—0.02 mL·L-1; c—0.04 mL·L-1;d—0.06 mL·L-1; e—0.08 mL·L-1;f—0.2 mL·L-1)图 3 ln κ 与1 000T-1的拟合曲线Fig.3 The curves of ln κ and 1 000T-1of the systems
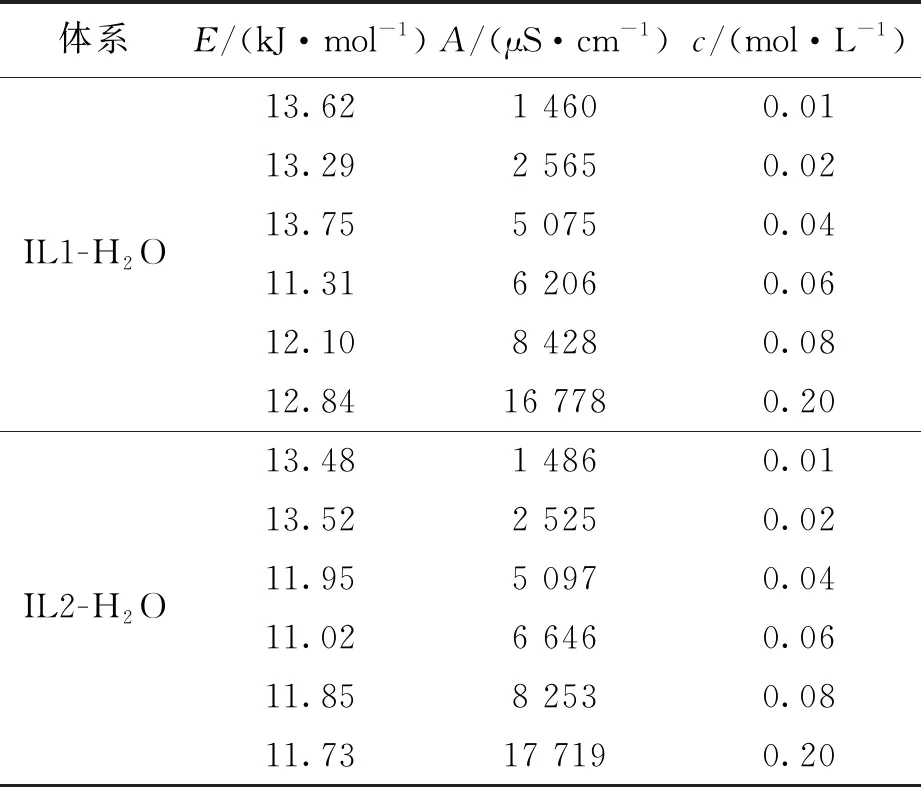
体系E/(kJ·mol-1)A/(μS·cm-1)c/(mol·L-1)IL1-H2O13.621 4600.01 13.292 5650.02 13.755 0750.04 11.316 2060.06 12.108 4280.08 12.8416 7780.20IL2-H2O13.481 4860.01 13.522 5250.02 11.955 0970.04 11.026 6460.06 11.858 2530.08 11.7317 7190.20
从表1可以看出,随着离子液体的酯基侧链增长,体系的电导活化能呈相对降低趋势,电导率及指前因子则呈增加的趋势,而IL1-H2O和IL2-H2O的指前因子均随着体系中离子液体浓度的增加而增加。可能是由于在阴离子相同的条件下,阳离子的酯基链增长使离子液体的位阻效应及疏水性有所增大,降低了体系中阴、阳离子的活动能力,影响了离子的迁移率,减小了IL2-H2O的电导率及指前因子。同时,相比较IL1,IL2的酯基链较长,其阴阳离子间的静电作用相对减弱,IL2解离成自由离子所需能垒低,其体系的电导活化能呈现略微下降趋势。
2.3 IL1和IL2离子液体的电化学窗口(EW)
离子液体的电化学窗口与阴阳离子结构、官能团种类、烷基链数目及电极种类有关。电化学窗口是表征离子液体的一项重要指标[24],是指在电解液中发生氧化与还原反应所对应的极限电位的差值,电化学窗口的数值越大,离子液体的电化学稳定性越高,离子液体中电沉积金属的使用范围较宽。采用Li电极为工作电极,Ag电极为参比电极,Pt电极为对电极的三电极体系,在手套箱中通过循环伏安曲线法对IL1和IL2的电化学窗口进行测定,扫描速率为50 mV/s,其循环伏安曲线如图4所示。
图4表明,阳离子的结构变化对电化学窗口的影响相对较大。IL1和IL2离子液体的电化学窗口分别为2.66 V和3.41 V。两者在二甲亚砜(DMSO)中均具有较宽的电化学窗口,随着咪唑环上酯基侧链的微增长,离子液体的化学窗口相对更宽且电化学稳定性增强。从IL1和IL2的结构上分析,一方面咪唑环上的侧链数目较多有助于电荷分散,提高了电化学稳定性;另一方面,酯基侧链上氧原子的电负性较大,容易得电子,使得咪唑阳离子的还原电位增大较为明显,这可能是其电化学窗口变宽的原因之一。

(a) IL1

(b) IL2图 4 在二甲亚砜中的循环伏安曲线Fig.4 Cyclic voltammograms of IL in the solution(DMSO)
2.4 IL1和IL2离子液体的热稳定性
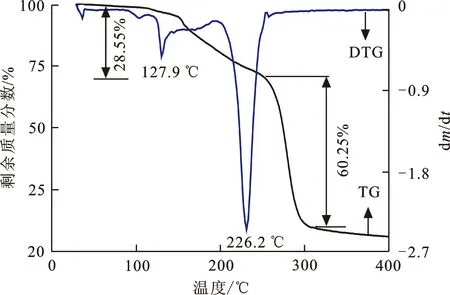
良好的热稳定性为离子液体在化学反应、材料制备等应用方面提供了较大的温度操作空间。在30~500 ℃,升温速度为10 ℃/min的条件下,对所合成的离子液体IL1和IL2进行热失重研究,其热失重曲线如图5所示。
图5表明, IL1和IL2具有相对较好的热稳定性,分子结构相似导致其热失重的过程具有相似性,在0~400 ℃之间均存在两次明显的热失重现象。IL1和IL2第一次的快速热失重分别发生在127.9 ℃和175.1 ℃,主要为离子液体的侧链热分解;第二次快速热失重分别发生在226.2 ℃和291.6 ℃,主要为咪唑环变形后热分解。酯基链较长的IL2具有相对高的稳定性,这可能是由于酯基链的增长有助于分子内的氢键形成。
(a) IL1

(b) IL2图 5 离子液体的TG-DTG曲线Fig.5 TG-DTG curves of ionic liquids
3 结 论
合成了两种新型咪唑类离子液体:氯化1-乙酸甲酯基-2,3-二甲基咪唑离子液体(IL1)和 氯化1-乙酸乙酯基-2,3-二甲基咪唑离子液体(IL2)。研究表明:
(1) IL1和IL2具有良好导电性,在20~45 ℃,其IL-H2O二元体系的电导行为符合阿伦尼乌斯方程,导电活化能随着咪唑环上的酯基侧链微增长呈现下降趋势。
(2) 酯基的氧原子电负性较大,使得IL1和IL2具有宽的电化学窗口(2.66 V和3.14 V)。
(3) IL1和IL2具有较高的热稳定性,两次快速的热失重温度分别为127.9 ℃和226.2 ℃,175.1 ℃和291.6 ℃,在材料制备和电化学沉积等方面具有一定的应用潜力。
