食管癌患者来源异种移植模型的构建及组织学观察
2019-10-22王佩文鞠前前蒋茂荣
王佩文,柏 文,鞠前前,史 辉,蒋茂荣
食管癌是较为常见的恶性肿瘤之一,2017年,国家癌症中心发布了中国最新癌症数据,其中食管癌位居第4位[1]。在全世界范围内,食管癌的年平均发病率为30/100 000,5年生存率为15%~25%。由于多方面的因素(包括饮食、环境和生活习惯等),中国是世界上食管癌发病率最高的国家。尽管医疗水平一直在进步,食管癌依然是死亡率较高的一种疾病,传统治疗方案(如手术切除、化疗、放疗)难以达到满意的治疗效果[2-3]。
人源肿瘤异种移植(patient-derived xenograft,PDX)模型是指把临床患者新鲜的肿瘤组织移植到免疫缺陷小鼠体内,依靠小鼠的内环境进行生长而形成的移植瘤模型。PDX模型基本复制了患者肿瘤的异质性,能较好保留原发肿瘤的组织病理结构和遗传特性,因此被认为是最接近临床患者肿瘤的体内模型[4]。但是经过传至第2代的PDX模型,组织学特性与细胞形态是否保留原发肿瘤组织的病理特性,是否能较好体现原发肿瘤的特征,仍需要进一步研究。本研究旨在研究不同代的移植瘤与初代患者肿瘤病理学特性有无明显差别,以及传代之后的移植瘤的成瘤速度和表观差异。
1 材料与方法
1.1 材料
1.1.1 食管癌组织标本 患者来源的食管癌组织均来自南通大学附属医院心胸外科,患者平均年龄70岁。患者术前均签署知情同意书,研究方案经本院伦理委员会批准。
1.1.2 实验动物 取用SPF级BALB/c裸鼠9只,体重20~22 g,购自中国科学院上海实验动物中心[实验动物许可证编号:SCXK(沪)2017-0005],动物实验和饲养在南通大学医学院实验动物中心SPF屏障环境内[实验动物许可证编号:SYXK(苏)2017-0046],实验和饲养条件严格遵守标准化操作规程的规范要求(南通大学实验动物使用与管理委员会批准号:20170303-004),并按实验动物使用的3R原则给予人道的关怀。
1.1.3 主要试剂 多聚甲醛、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒购自于上海碧云天生物技术有限公司南通分公司。DMEM培养基和胎牛血清购于美国Invitrogen公司。
1.2 实验方法
1.2.1 食管癌组织的收集 临床手术刚切除的食管癌肿瘤组织,立刻置于提前预冷的含10%胎牛血清DMEM完全培养基(4 ℃)中,冰上保存运输(0 ℃)。
1.2.2 病理鉴定 食管癌肿瘤组织病理鉴定均由南通大学附属医院病理科进行。根据美国癌症联合委员会第8版TNM分期系统标准进行肿瘤分期[5]。
1.2.3 食管癌PDX模型的建立 收集的食管癌肿瘤组织于实验室无菌超净台中去除肿瘤周围坏死组织和部分毛细血管,将部分肿瘤组织在培养基中切成2 mm×2 mm×2 mm的小块,置于4%的多聚甲醛中固定。裸鼠腹腔内注射戊巴比妥钠溶液,剂量为50 mg/kg,取组织块于套管针内,于裸鼠右腋下接种,裸鼠苏醒前放入饲养笼内,此为食管癌PDX模型初代(P0)。每2~3天观察成瘤情况,将P0代移植瘤取出后再次接种于裸露皮下生长的肿瘤为第1代(P1)。待裸鼠皮下肿瘤生长至500 mm3,裸鼠经CO2窒息处死,取出肿瘤组织,重复上述方法,传代至第2代(P2),取部分P0、P1、P2代肿瘤组织经4%多聚甲醛固定,进行HE染色并与食管癌患者肿瘤组织进行比较。
1.2.4 PDX模型生长曲线 隔日观察肿瘤体积及小鼠体重变化,肿瘤体积计算公式为V=(D×d2)/2(D为肿瘤表面最长径,d为肿瘤表面最短径),绘制生长曲线。
1.2.5 组织鉴定和HE染色,传代 将食管癌患者取出的肿瘤组织即初代(P0)以及移植瘤P1,P2代用多聚甲醛固定后,石蜡组织包埋,连续厚度6 μm组织切片并HE染色,严格按照HE染色试剂盒进行染色流程。光镜下观察比较病理形态变化。

2 结果
2.1 移植瘤大体表观形态 3名食管癌患者肿瘤组织接种裸鼠皮下后,均生长出近似于球形的移植瘤(P0代)。将其中1名患者P0代移植瘤取出后,再次接种于3只裸鼠皮下,大约1个月后,又生长出比P0代更近似于球形的移植瘤(P1代)。P0代与P1代具体移植瘤大体表观态见图1。P0代与P1代移植瘤表观形态无明显差异。

图1 移植瘤大体表观形态观察
2.2 食管癌PDX模型移植瘤生长情况 食管癌PDX模型P0代移植瘤生长较慢,第10天时裸鼠皮下才出现肉眼可见的小包,第20天时小包长成绿豆大小(直径约为0.3 cm),第30天时长成黄豆大小(直径约为0.5 cm),第40天时已长成明显的移植瘤。对食管癌PDX模型P0代、P1代和P2代移植瘤的瘤体体积进行测量,绘制生长曲线。见图2A、2B和2C。以瘤体体积达到500 mm3时所需的天数进行统计,结果显示,P0代移植瘤达到500 mm3时,约需要60 d;P1代只需要不到40 d;而P2代只需要20 d左右(图2D)。随着食管癌PDX模型移植瘤的传代,瘤体的生长速度明显加快。
2.3 食管癌PDX模型移植瘤HE染色光镜观查结果 通过HE染色,观察比较食管癌PDX模型移植瘤病理形态变化。结果显示,P0代、P1代、P2代移植瘤光镜下组织学结构相似,没有出现形态学改变(图3)。

A:P0代移植瘤生长曲线;B:P1代移植瘤生长曲线;C:P2代移植瘤生长曲线;D:瘤体体积达到500 mm3时所需的天数注:与P0代比较,**P<0.01图2 PDX模型移植瘤生长情况
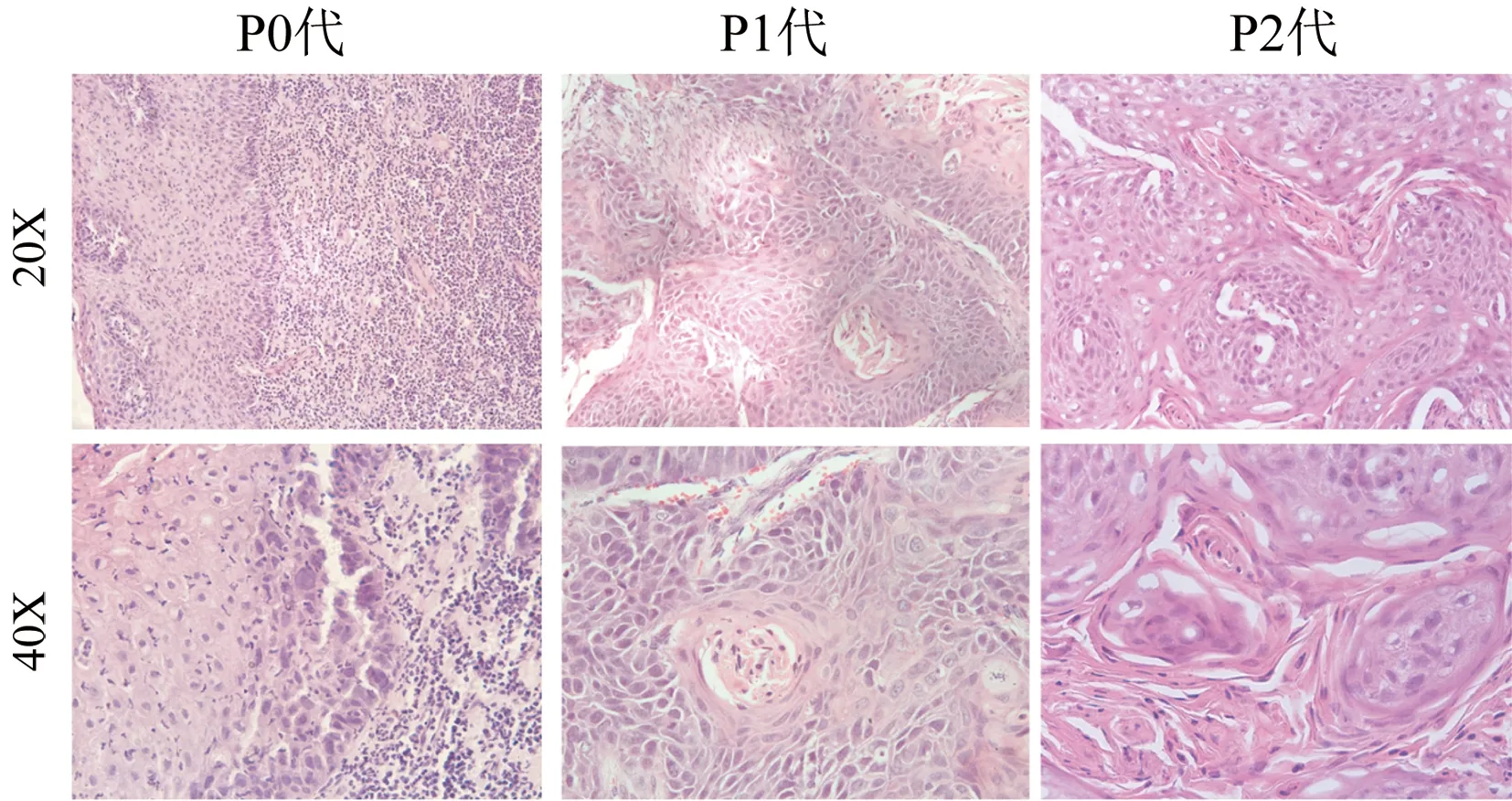
图3 食管癌PDX模型移植瘤HE染色光镜观查结果
3 讨论
PDX模型的构建成功与否与原发肿瘤的恶性程度、移植小鼠的类型、移植部位等因素有关[6]。相关文献报道,卵巢癌肾包膜移植PDX SCID小鼠(T,B细胞均缺陷)模型成功率高达95%[7],非小细胞性肺癌皮下移植PDX SCID小鼠模型成功率为45%[8],而乳腺癌皮下移植PDX模型仅为13%[9]。本研究采用T细胞缺陷的裸鼠,裸鼠右腋下接种,食管癌PDX模型构建成功率较高。由于食管癌PDX模型相关报道较少,其应用价值较高。
本研究选用3名临床食管癌患者,且全部癌组织均能在裸鼠皮下成瘤。P0代成瘤周期约为60 d(以肿瘤体积达到500 mm3为标准),P1代为40 d,P2代为20 d。随着传代次数增加,其成瘤速度加快。这一结果与头颈部鳞状上皮细胞癌PDX模型和涎腺腺样囊性癌PDX模型构建相似[10]。
以往的研究表明,肿瘤PDX模型在病理组织结构、基因谱表达水平、基因的拷贝数均与原移植瘤保持高度的一致性[11]。在本研究中,除了建立起食管癌的PDX移植瘤模型,还比较它们转代后的生长速度。为了检验食管癌PDX模型在生长过程中是否会出现形态学变化,我们做了HE染色,观察比较病理形态变化。结果显示,随着食管癌的传代,未发现病理组织形态学的改变,证实了食管癌PDX模型保持了原发肿瘤的病理组织结构。构建的食管癌PDX模型有利于快速研究人原发食管癌相关特性。
PDX模型可用于精准医疗中,建立肿瘤患者个性化的PDX模型有利于开展体内实验,实现以患者肿瘤基因为靶向的治疗策略[12]。但目前仍存在诸多问题,如连续传代出现原发肿瘤特征丢失的问题[13],需要进一步解决。
