高脂饮食诱导的肥胖对SD大鼠卵泡发育及IGF-1/PI3K/Akt通路的影响
2019-10-22刘莉李金丽邓小艳肖庆吴春林胡雅君
刘莉,李金丽,邓小艳,肖庆,吴春林,胡雅君
肥胖是由于多种原因引发的体内脂肪含量过多而产生的一种临床常见代谢性疾病,目前肥胖症已严重影响人们生活质量[1]。既往研究发现肥胖患者血清中炎性因子表达水平明显升高并可促使脂肪组织产生炎性反应,同时高表达的炎性因子又可参与胰岛素信号转导信号通路进而造成胰岛素抵抗[2]。育龄女性过度肥胖导致不孕、流产及妊娠并发症发生率明显增加,近来研究发现女性卵泡发育、排卵等主要依赖于性激素调节系统,而性激素主要通过脂肪组织进行分泌及代谢[3]。由此推测过度肥胖引发的脂肪组织炎性反应可能影响卵泡发育,深入研究可为肥胖妇女生殖治疗方案的制定提供理论依据。胰岛素生长因子(insulin like growth factor-1,IGF-1)在人体内水平过度升高可通过促使卵泡闭锁、凋亡进而降低卵巢功能[4]。同时IGF-1水平升高还可通过促使胰岛素受体底物表达进而激活磷脂酰肌醇-3激酶/蛋白激酶B(phosphatidylinositol-3 kinase/protein kinase B,PI3K/Akt)信号通路,研究发现多囊卵巢综合征患者血清IGF-1水平升高并可通过激活PI3K/Akt信号通路进而参与多囊卵巢综合征发生过程[5]。关于IGF-1/PI3K/Akt信号通路与肥胖及卵泡发育的关系尚未阐明,因此,本研究通过构建高脂饮食诱导的肥胖大鼠模型检测卵泡发育相关激素水平,初步探讨其对IGF-1/PI3K/Akt信号通路的影响,为降低肥胖育龄女性卵泡发育异常所致的不孕不育发生率及提高辅助生殖治疗效果提供一定依据,报道如下。
1 材料与方法
1.1 实验动物 8周龄清洁级雌性SD大鼠20只,体质量180~270 g,由湖北省疾病预防控制中心实验动物中心提供,分笼喂养且正常饮水摄食,培养条件为室温22~25℃,湿度70%。动物许可证号:SCXK(鄂)2017-0008,动物合格证书编号No.42000600007275,实验动物设施使用证编号No.00133206。该实验于2017年1月—2018年1月在武汉市第一医院中心实验室进行,并获得武汉市第一医院伦理委员会批准。
1.2 主要试剂与仪器 性激素卵泡刺激素(follicle-stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)、雌激素(estrogen, E2)、催乳素(prolactin,PRL)、睾酮(testosterone,T)放射免疫分析试剂均购自天津协和医药科技有限公司;白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C反应蛋白(C reactive protein,CRP)酶联免疫吸附(ELISA)检验试剂盒与三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-C,LDL-C)、总胆固醇(total cholesterol,TC)检测试剂盒均购自上海博谷生物科技有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、酸性磷酸酶(acid phosphatase,ACP)、过氧化氢酶(catalase,CAT)检测试剂盒均购自南京建成生物研究所;兔抗鼠PI3K及其磷酸化p-PI3K、Akt及其磷酸化p-Akt单克隆抗体均购自美国Cell Signaling Technology公司;兔抗鼠IGF-1单克隆抗体购自福州迈新公司;HPR标记的山羊抗兔IgG二抗购自上海生物工程股份有限公司。核酸蛋白测定仪购自普泰生物技术公司;石蜡切片机购自湖北贝诺医疗科技有限公司;G9800全自动生化仪购自北京九强生物技术股份有限公司;DMLS2光学显微镜购自北京普瑞赛司仪器有限公司;SN-697B型智能放射免疫γ测量仪购自上海核所日环光电仪器有限公司。
1.3 建模与分组 20只雌性SD大鼠均进行适应性喂养1周,按照随机数字表法选取10只作为正常饮食组,其余10只大鼠均参照张靓等[6]研究方法进行高脂喂养,喂养10周,大鼠体质量超过正常饮食组20%视为肥胖大鼠模型建模成功[7]。将建模成功的10只大鼠作为高脂饮食组,正常饮食组与高脂饮食组SD大鼠均继续喂养1周后检测各项指标。
1.4 动物麻醉及取材 2组大鼠禁食过夜,次日清晨采用1 ml利多卡因实施腹腔麻醉,分别摘除大鼠眼球后静脉丛取血,采集血液样本,置于离心机内(3 000 r/min转速)离心20 min,收集上层血清,置于-80℃超低温冰箱保存待测。取血后断颈处死大鼠,并摘取卵巢,在无菌水中清洗3次,每组选取5只大鼠卵巢采用福尔马林固定取出包埋于石蜡中。另选取5只大鼠卵巢剪碎后放入匀浆器,在冰盒中匀浆,并将匀浆液分装到2.0 ml EP管中,剩余的卵巢组织冻存在-200℃的液氮中备用。
1.5 观察指标与方法
1.5.1 大鼠卵巢组织病理观察: 取石蜡包埋卵巢组织,采用石蜡切片机切片,厚度约为6 μm,苏木精—伊红(hematoxylin-eosin,HE)染色,100倍显微镜下观察大鼠卵巢组织形态学变化,每组标本随机选取5个视野,计算卵泡总数、成熟卵泡总数、黄体总数等。
1.5.2 血脂水平检测:取采集的血液标本,应用全自动生化分析仪检测2组大鼠血清TC、TG、LDL-C水平,严格按照试剂盒说明书进行操作。
1.5.3 卵泡发育相关激素水平检测: 取采集的血液标本,采用放射免疫法检测血清卵泡发育相关激素水平,应用放射免疫计数器检测大鼠血清中FSH、 E2、P、PRL、LH、T水平。
1.5.4 血清炎性因子检测: 取采集的血液标本,采用ELISA法检测血清炎性因子IL-6、TNF-α、CRP水平,严格按照试剂盒说明书操作。
1.5.5 卵巢组织中氧化应激指标检测:取20 mg卵巢组织,加入生理盐水并研磨成组织匀浆,生理盐水和匀浆液以10∶1混合,置于离心半径为10 cm离心机内以3 000 r/min转速离心15 min,吸取上清液,参照SOD、MDA、ACP、CAT检测试剂盒说明书进行检测。
1.5.6 蛋白免疫印迹法(Western-blot)检测卵巢组织IGF-1/Akt通路相关蛋白:取100 mg大鼠卵巢组织,加入RTPA蛋白裂解液,采用BCA法测定蛋白浓度,取20 μg总蛋白进行10% SDS-PAGE凝胶电泳分离蛋白,之后移至PDVF膜,5%脱脂奶粉封闭,2 h后加入IGF-1/Akt通路相关蛋白一抗,稀释比均为1∶1000,4℃孵育过夜,次日加入二抗(稀释比1∶10 000),室温孵育1 h后采用ECL法进行显影,放入凝胶分析系统观察各蛋白条带并采用Quantity One图像分析系统对各条带进行光密度分析,各蛋白均以β-actin为内参基因,目的蛋白与内参条带积分光密度值的比值即蛋白相对表达量。

2 结 果
2.1 2组大鼠卵巢病理变化及卵泡、黄体变化比较 HE染色结果显示,正常饮食组大鼠卵泡正常发育且内含丰富的颗粒细胞,周围含有原始卵泡与优势卵泡,黄体结构正常;高脂饮食组大鼠卵泡发育不正常且内含的颗粒细胞排列松散,同时向腔内塌陷且无明显卵泡腔结构,含有不良黄体且呈弥漫性筛网状及微囊状结构,同时黄素化颗粒细胞减少,图1见封3。与正常饮食组相比,高脂饮食组大鼠发育不良卵泡比率显著升高(P<0.05),见表1。高脂饮食组黄体总数17个,异常10个(58.52%),正常饮食组黄体总数20个,无异常黄体。
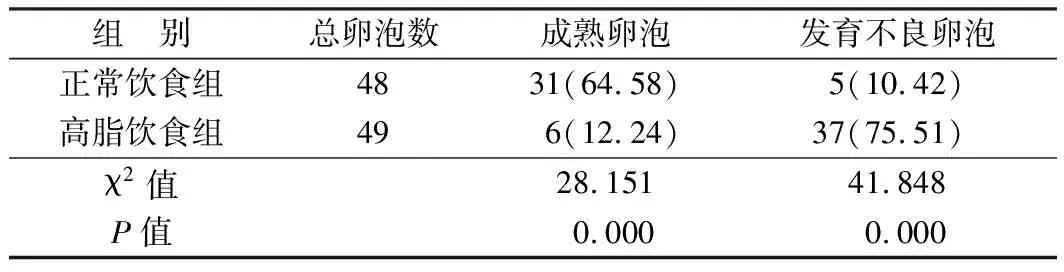
表1 2组大鼠卵泡及黄体变化比较 [例(%)]
2.2 2组大鼠体质量及血脂水平变化比较 与正常饮食组相比,高脂饮食组大鼠体质量、TC、TG、LDL-C水平均显著升高(P<0.01),见表2。
2.3 2组大鼠卵泡发育相关激素水平比较 与正常饮食组相比,高脂饮食组大鼠E2、P、FSH、LH、PRL水平均显著降低(P<0.01),T水平显著升高(P<0.01),见表3。
2.4 2组SD大鼠血清炎性因子及卵巢组织中氧化应激水平比较 与正常饮食组相比,高脂饮食组大鼠血清炎性因子IL-6、TNF-α、CRP水平均显著升高(P<0.01),卵巢组织中MDA、ACP水平均显著升高(P<0.01),SOD、CAT水平均显著降低(P<0.01),见表4。
2.5 2组大鼠IGF-1/Akt通路蛋白表达比较 与正常饮食组相比,高脂饮食组大鼠IGF-1、p-Akt、p-PI3K蛋白表达水平均显著升高(P<0.05),而Akt、PI3K蛋白表达水平比较差异无统计学意义(P>0.05),见图2、表5。

表2 2组大鼠体质量及血脂水平变化
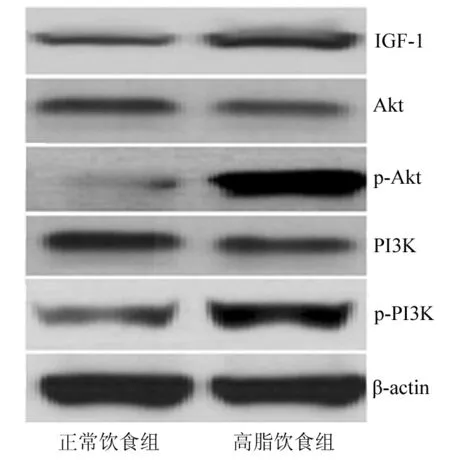
图2 2组大鼠IGF-1/Akt通路相关蛋白表达比较
3 讨 论
女性过度肥胖可引发不孕症、月经异常、排卵障碍及多囊卵巢综合征等疾病,同时可增加自然流产及妊娠期高血压、妊娠期糖尿病等风险,研究显示肥胖女性新生儿先天性心脏病、神经管缺陷等发生风险较高[8]。肥胖患者可能通过胰岛素抵抗、慢性炎性反应等病理过程影响卵母细胞发育及妊娠结局,但其具体作用机制尚未完全阐明。因此,探究肥胖对卵泡发育的影响及其可能作用机制,为提高肥胖女性辅助生殖治疗效果提供依据。
肥胖是指能量摄入超过能量消耗导致脂肪组织过
度增生,TG、TC等血脂水平升高可引起脂代谢紊乱进而产生肥胖[9]。本研究通过高脂饮食诱导构建肥胖SD大鼠模型,检测正常饮食大鼠与肥胖大鼠血脂水平,结果显示高脂饮食组大鼠体质量、TC、TG、LDL-C水平均明显高于正常饮食组,提示高脂饮食诱导的肥胖SD大鼠模型造模成功。HE染色可直接观察卵巢病理组织改变[10]。本研究切取2组大鼠卵巢与子宫组织,HE染色观察其病理改变,结果显示正常饮食组大鼠卵巢原始卵泡、成熟卵泡较高脂饮食组均明显增多,高脂饮食组卵泡发育不良且异常黄体数目较多,提示肥胖能阻碍SD大鼠生殖细胞正常发育并引发生殖功能失调。机体性激素调节系统主要为下丘脑—垂体—卵巢轴(HPOA),HPOA系统还涉及FSH、LH、E2等激素,激素水平变化直接影响卵泡发育[11-12]。本研究结果显示高脂饮食组大鼠E2、P、PRL、FSH、LH水平均明显低于正常饮食组,T水平明显高于正常饮食组,说明E2、P、PRL、FSH、LH、T水平异常可影响卵泡发育,分析原因可能为高脂饮食诱导肥胖大鼠摄入能量过多,引起脂肪细胞堆积导致血液中T水平升高并抑制HPOA功能,进而使肥胖大鼠E2、P、PRL、FSH、LH水平降低。FSH、LH、E2等相关激素异常表达可促使HPOA功能紊乱进而导致卵泡发育停止甚至卵泡闭锁。肥胖还是一种与炎性反应相关的疾病,本研究进一步分析高脂饮食诱导的肥胖对炎性反应及氧化应激反应的影响,结果显示高脂饮食组大鼠血清炎性因子IL-6、TNF-α、CRP水平均明显高于正常饮食组,高脂饮食组大鼠卵巢组织中氧化应激指标MDA、ACP水平均明显高于正常饮食组, SOD、CAT水平均明显降低。有研究显示肥胖型多囊卵巢综合征患者血清中IL-6、TNF-α、CRP水平均明显升高,其中IL-6作为一种前炎性细胞因子与胰岛素抵抗指数呈正相关,IL-6、TNF-α、CRP均与LH、FSH密切相关[13]。同时肥胖大鼠体内炎性反应还可促使卵巢组织发生氧化应激反应,MDA、ACP、SOD、CAT异常表达可反映卵巢组织氧化应激水平变化[14-16]。提示高脂饮食诱导的肥胖可能通过加重大鼠体内炎性反应及氧化应激反应,干扰HPOA功能进而促使FSH、LH、E2等卵泡发育相关激素水平异常从而影响卵泡发育。

表3 2组大鼠卵泡发育相关激素水平变化比较

表4 2组大鼠血清炎性因子及卵巢组织中氧化应激水平比较

表5 2组大鼠IGF-1/Akt通路相关蛋白的表达比较
卵巢组织中IGF-1呈高表达时,通过抑制其表达可改善HPOA调节功能进而促使初级卵泡发育为优势卵泡,同时可通过提高大鼠FSH、LH、E2等激素水平抑制卵巢组织中IGF-1表达进而恢复大鼠排卵功能[17-18]。IGF-1主要由卵巢、肝脏、脂肪组织合成分泌,研究发现IGF-1表达水平升高可促使雄激素过量合成进而扰乱HPOA调节系统[19]。IGF-1/PI3K/Akt信号通路可参与蛋白质合成代谢相关过程,通过激活该信号通路可对糖尿病骨骼肌发育发挥保护作用[20-22]。PI3K/Akt信号通路对炎性反应、肿瘤发生及发展过程均发挥重要作用,研究显示多囊卵巢综合征患者IGF-1表达水平升高可激活PI3K/Akt信号通路[23]。本研究结果显示,高脂饮食组大鼠IGF-1、p-Akt、p-PI3K表达水平均明显高于正常饮食组,分析原因可能为肥胖大鼠IGF-1水平过度升高可增加卵巢对黄体生成素的敏感性进而促使卵泡闭锁并抑制优势卵泡发育,同时IGF-1可通过与胰岛素样生长因子受体结合并促使胰岛素受体底物发生磷酸化进而激活PI3K/Akt信号通路[24]。提示高脂饮食诱导的肥胖可能抑制优势卵泡发育,其可能与IGF-1/PI3K/Akt信号通路激活有关。
综上所述,高脂饮食诱导的肥胖可促使SD大鼠卵泡发育相关激素水平紊乱进而促使卵泡发育停止,其可能与IGF-1/PI3K/Akt信号通路激活有关。肥胖女性生殖治疗过程中抑制IGF-1水平可能有助于卵泡发育。但关于高脂饮食诱导的肥胖与卵泡发育其他信号通路及其可能作用机制均需进一步研究。
利益冲突:无
