猪伪狂犬病毒gE蛋白的酵母表达及其单克隆抗体的筛选
2019-10-21金前跃李旭锋柴永笑丁培阳邢云瑞李艳华郭军庆张改平1
王 垚,金前跃,周 稳,李旭锋,柴永笑,丁培阳,陈 晓,邢云瑞,李艳华,郭军庆,张改平1, ,4
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.西北农林科技大学,陕西 杨凌 712100)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起的急性传染病,临床表现通常为瘙痒、发热、神经症状等[1]。猪是PRV的唯一自然宿主,但该病毒也可以感染其他多种哺乳动物,包括反刍动物、食肉动物和啮齿动物。PRV感染猪群后,猪龄越小其临床症状越严重[2],可引起新生仔猪神经系统紊乱和死亡、怀孕母猪流产和死胎、育肥猪呼吸困难,对全世界的生猪养殖业造成了严重危害。自2012年我国猪场大规模感染突变的PRV以来,PRV流行株毒力增强,PR的感染率不断上升[3]。而且近期有报道PR疑似为人兽共患病,引起了科学家的高度重视[4]。
PRV属于疱疹病毒科、α-疱疹病毒亚科、水痘疱疹病毒属[5]。PRV是双链DNA并具有囊膜的病毒粒子,直径为180 nm,病毒粒子表面具有长8~10 nm的放射状纤突,其基因组长为143 kb[6]。PRV含有11个N-或O-链糖基化修饰的膜蛋白,分别为gB、gC、gD、gE、gG、gH、gI、gK、gL、gM和gN蛋白[7]。gB、gC、gD、gH蛋白为病毒主要的保护性抗原,可以刺激动物宿主产生中和抗体。其中,gB基因在病毒入侵细胞和细胞间的传播中至关重要[8-9],而gE基因为主要的毒力基因,能促进病毒颗粒释放并有嗜神经性。
目前,国内外主要以灭活疫苗和减毒活疫苗进行免疫防控[10],最早的减毒活疫苗为天然gE缺失株,之后人们通过基因工程技术获得了相应的基因缺失疫苗[11],这类疫苗的应用很大程度上减少了该病的流行和扩散。基因缺失疫苗主要以缺失非必需囊膜糖蛋白基因gE为主,它的去除不影响病毒的复制和免疫原性。在部分欧美国家如德国和美国,已经通过gE基因缺失疫苗免疫和相应的抗体检测手段,完全净化了PR[12]。我国生猪养殖情况较为复杂,除了可靠的疫苗免疫之外,需要一种简便快速的gE抗体检测技术,促进猪场伪狂犬病的净化。由于单克隆抗体具有灵敏度高,特异性强等优点,已被广泛应用于病毒学诊断中。本研究通过酵母表达gE蛋白并筛选了针对该蛋白的单克隆抗体,为PRV gE抗体快速检测技术的研发及该病的净化奠定了基础。
1 材料和方法
1.1 病毒、质粒和细胞
PRV(汤阴株)由河南省农业科学院动物免疫学重点实验室分离、鉴定和保存;pPICZαA-gE重组质粒、PK-15细胞均由河南省农业科学院动物免疫学重点实验室保存。
1.2 主要试剂及仪器
X-33菌株购自美国Invitrogen公司,GE Ni填料和Ni柱购自美国GE公司,1640培养基和胎牛血清购自Gibco公司,BCA蛋白质含量测定试剂盒购自北京索莱宝科技有限公司,AEC显色液购自Sigma公司,胰蛋白酶和ECL显色液购自新赛美生物科技有限公司,HRP-羊抗鼠及HRP-羊抗猪二抗购自Santa Cruz Biotechnology公司,PRV gE单克隆抗体购自VMRD公司,His单克隆抗体及鼠源单克隆抗体亚型鉴定试剂盒购自武汉三鹰生物技术有限公司,PRV阴性及阳性血清均来自IDEXX PRV gE检测试剂盒检出的临床样品,其他分析纯试剂均购自国药集团化学试剂有限公司。LLB、YPD、BMGY、BMMY培养基均按Easy SelectTMPichia Expression Kit Manual说明配制。
PowerPac电泳仪、Mini-PROTEAN®Tetra电泳槽、半干转膜仪、AKTA pure纯化仪及电转仪均购自美国BIO-RAD公司,POLARstar Omega全自动多功能酶标仪购自德国BMG Labtech公司。
1.3 重组gE蛋白的表达及纯化
1.3.1 重组gE蛋白的表达 将pPICZαA-gE重组质粒转化到JM109感受态中,涂布于LLB平板(含30 μg/mL博来霉素),37 ℃过夜培养。在LLB平板中挑取单菌落接种于2 mL LLB培养基中,37 ℃振摇5 h,将菌液按1∶50接种于100 mL LLB培养基中过夜振摇培养,10 000 r/min离心2 min,收集菌体后提质粒,并测定其质量浓度。
用PmeⅠ限制性内切酶单酶切使质粒线性化后,取5~10 μg质粒与80 μL X-33酵母感受态(按Easy SelectTMPichia Expression Kit Manual说明制备)混匀。在1.5 kV电压、25 μF电容、200 Ω电阻条件下电击4.7 ms,电转进X-33酵母感受态中,电转结束立即加入1 mL 1 mol/L山梨醇。在30 ℃条件下静置培养3 h后,4 000 r/min离心5 min,弃部分上清,剩余涂布于含博来霉素的YPD平板,30 ℃培养3 d。挑取单个圆润菌落接种于2 mL YPD培养基中,28 ℃振摇培养48 h,按1∶50接种于100 mL YPD培养基中。过夜振摇后,按1∶10接种于BMGY培养基中,振摇36 h后,按1∶5接种于BMMY培养基中,每天加1%甲醇诱导表达。
1.3.1.1 SDS-PAGE鉴定 在诱导表达的第3天取1 mL菌液上清并加入10 μL GE Ni填料,4 ℃下翻转过夜,6 000 r/min离心5 min,弃上清,加入60 μL PBS缓冲液重悬。再向其加入15 μL的5×Loading Buffer,在100 ℃沸水中煮10 min,瞬离并用于上样鉴定。
1.3.1.2 Westen blot鉴定 蛋白质电泳后将聚偏二氟乙烯(PVDF)膜在甲醇中激活10 s,然后依次将滤纸-PVDF膜-蛋白质胶-滤纸放置于半干转膜仪石墨电极,15 V下转1 h。结束后将膜置于5%脱脂奶粉中进行封闭,37 ℃孵育1 h。分别用His单克隆抗体(以下均为1∶5 000稀释)和PRV阳性血清(以下均为1∶200稀释)作为一抗室温孵育1 h后弃去,PBST反复洗5次。再分别用HRP-羊抗鼠(以下均为1∶1 000稀释)和HRP-羊抗猪(以下均为1∶1 000稀释)二抗室温孵育1 h后弃去,PBST反复洗5次。最后滴加ECL显色液(A液、B液1∶1混合)在化学成像仪下显色。
1.3.2 重组gE蛋白的纯化 将鉴定正确并已连续诱导培养5 d的菌液8 000 r/min、4 ℃离心30 min,取上清,用0.45 μm滤膜过滤,以0.5 mL/min的速度流过Ni柱。配制20 mmol/L Tris-HCl(pH值8.0)、150 mmol/L NaCl平衡缓冲液以及20 mmol/L Tris-HCl(pH值8.0)、150 mmol/L NaCl、500 mmol/L咪唑洗脱缓冲液。在AKTA pure纯化仪上设定缓冲液混合比例,用梯度稀释的咪唑进行洗杂和洗脱,收集洗脱峰。通过透析将蛋白质缓冲液置换为20 mmol/L Tris-HCl(pH值8.0)后,用12%的SDS-PAGE进行初步鉴定,同时进行Westen blot分析(参照1.3.1.2),用His单克隆抗体作为一抗孵育进一步鉴定。用BCA蛋白质含量测定试剂盒测定质量浓度后,-40 ℃保存备用。
1.3.3 重组gE蛋白的活性鉴定
1.3.3.1 Dot blot鉴定 分别将1 μL重组gE蛋白和PBS缓冲液(阴性对照)点于硝酸纤维素(NC)膜上,自然风干固定,用5%脱脂奶粉4 ℃封闭过夜。分别用PRV阳性血清和His单克隆抗体作为一抗室温孵育1 h后弃去,PBST反复洗5次。分别用HRP-羊抗猪和HRP-羊抗鼠二抗室温孵育1 h后弃去,PBST反复洗5次。最后用ECL超敏显色液在化学成像仪中进行显色。
1.3.3.2 ELISA鉴定 将重组gE蛋白用CBS溶液1∶100稀释后,按每孔100 μL加入96孔板中,4 ℃过夜包被。5%脱脂奶粉封闭后,用PRV阴性及阳性血清(以下均为1∶200稀释)室温孵育1 h后弃去,PBST反复洗5次。用HRP-羊抗猪二抗室温孵育1 h后弃去,PBST反复洗5次。加入显色液显色后,用2 moL/L H2SO4终止,放入酶标仪中读取OD450数值。
1.4 PRV gE蛋白单克隆抗体的筛选
1.4.1 免疫小鼠 将重组gE蛋白与弗氏完全佐剂按1∶1混合后乳化,以每只小鼠20 μg的剂量对BALB/c小鼠(4只)进行皮下免疫;以弗氏不完全佐剂乳化重组gE蛋白,并按相同方式和剂量于21、42 d进行免疫。最后一次免疫结束后14 d,采用断尾取血法采集小鼠血液。分离血清后用ELISA方法检测血清的抗体效价,效价达标的小鼠在融合前3 d,以每只100 μL的剂量腹腔注射重组gE蛋白。
1.4.2 细胞融合 腹腔注射3 d后,分离出免疫小鼠的脾脏细胞,并将提前培养的SP2/0骨髓瘤细胞与脾细胞按1∶5的比例进行混合,加入37 ℃提前预热的50% PEG-4000(pH值8.0)溶液进行细胞融合,加入无血清1640培养基终止细胞融合。用10% FBS-HAT-1640悬浮稀释细胞,细胞计数后,按每孔300 μL平铺于96孔板中,于5%CO2、37 ℃培养箱中培养7~10 d,待细胞长至孔底面积的1/3~1/2时,取细胞上清进行检测。
1.4.3 免疫过氧化物酶单层细胞试验(IPMA)筛选阳性克隆 将PK-15细胞培养在96孔板中,待长至70%~80%时接种病毒,37 ℃孵育1 h后弃去,加入含2% FBS的1640培养基培养24 h。将上清弃掉后每孔均加入100 μL预冷的无水乙醇,并于-20 ℃固定至少20 min。用5%脱脂奶粉封闭后,取细胞上清作为一抗室温孵育1 h后弃去,PBST反复洗5次。用HRP-羊抗鼠二抗室温孵育1 h后弃去,PBST反复洗5次。加入50 μL的AEC显色液进行显色,作用5~15 min后弃去显色液,加入100 μL超纯水后在显微镜下观察。
1.4.4 亚克隆 选取IPMA反应较强且细胞团较少的孔转入24孔板中培养。待细胞长满后通过有限稀释法亚克隆,直至得到阳性单克隆。
1.4.5 单克隆抗体的腹水制备 以0.5 mL/只的剂量,向BALA/c小鼠腹腔注射液体石蜡预先致敏。注射7 d后,将已筛选到的阳性单克隆细胞注射到小鼠腹腔,在第10天收集小鼠腹水,6 000 r/min离心5 min后取上清,-40 ℃保存备用。
1.5 单克隆抗体的鉴定
1.5.1 单克隆抗体效价的测定 用ELISA测定单克隆抗体的效价,将重组gE蛋白包被(参照1.3.3.2),以10倍倍比稀释的小鼠腹水作为一抗孵育,以HRP-羊抗鼠作为二抗孵育。用显色液显色并用2 moL/L H2SO4溶液终止,最后用酶标仪测定各个稀释度的OD450数值。
1.5.2 单克隆抗体与重组gE蛋白的反应性 重组gE蛋白电泳后,转膜进行Western blot分析(参照1.3.1.2),以4株单克隆抗体细胞上清按1∶100稀释作为一抗孵育,以HRP-羊抗鼠作为二抗孵育,最后用ECL显色液显色。
1.5.3 单克隆抗体与病毒的反应性 用1.4.3中的IPMA法,分别以4株单克隆抗体细胞上清(1∶100)、PRV阴性血清(阴性对照)和PRV gE单克隆抗体(阳性对照)作为一抗孵育,分别以HRP-羊抗鼠、HRP-羊抗猪和HRP-羊抗鼠作为二抗孵育。用AEC显色液显色并用超纯水终止,最后在显微镜下观察结果。
1.5.4 单克隆抗体亚型的鉴定 按照鼠源单克隆抗体亚型鉴定试剂盒说明书进行,鉴定4株单克隆抗体的亚型。
2 结果与分析
2.1 重组gE蛋白的表达及纯化
2.1.1 重组gE蛋白的表达 取酵母菌液上清进行SDS-PAGE和Western blot鉴定。SDS-PAGE检测结果显示,gE蛋白在X-33酵母中获得了表达,蛋白质大小约68 ku,与目的蛋白大小一致;Western blot鉴定结果显示,表达的重组gE蛋白能与His单克隆抗体及PRV阳性血清反应,表明表达蛋白活性良好(图1)。
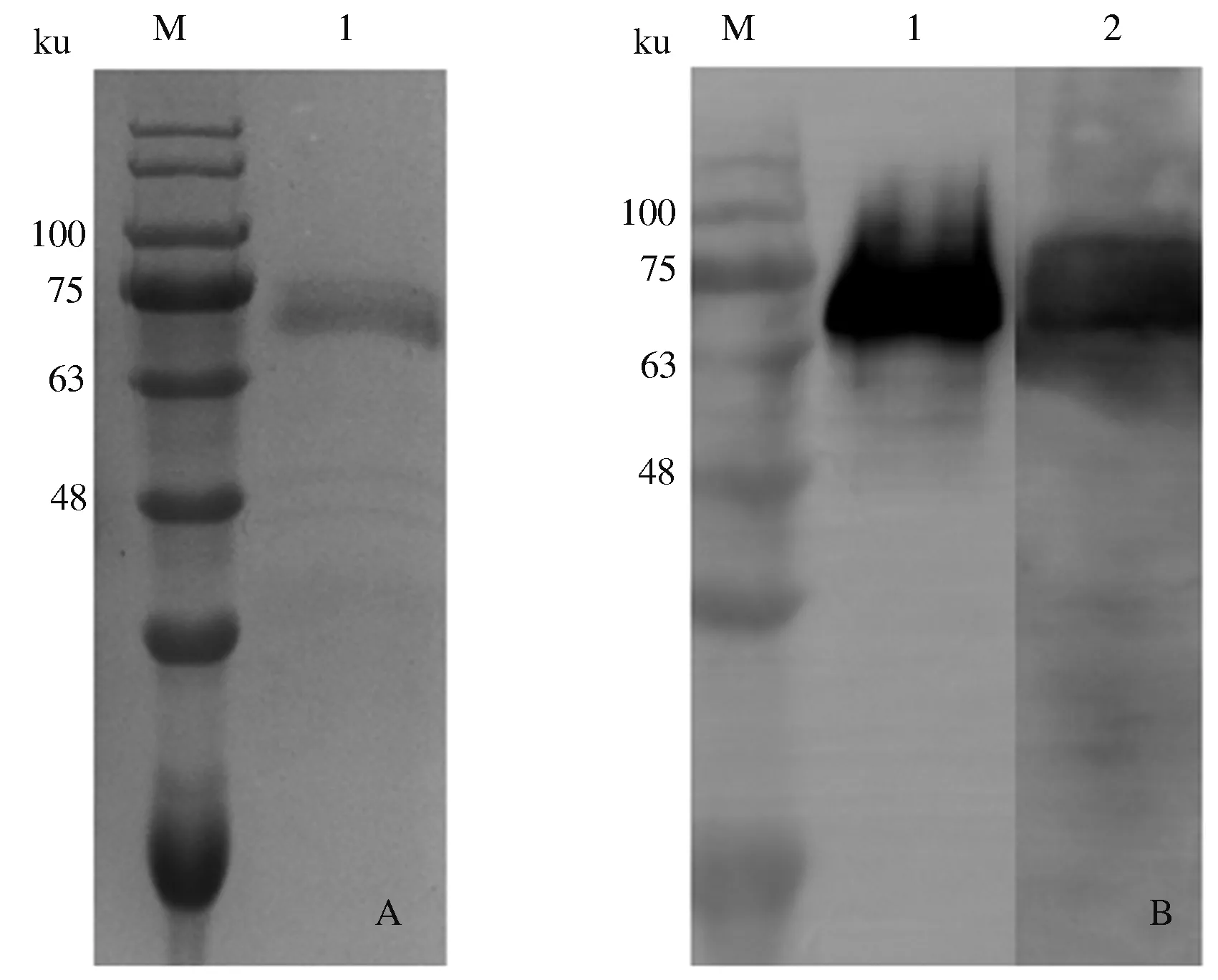
A:SDS-PAGE结果(M:蛋白质预染Marker;1:gE蛋白);
2.1.2 重组gE蛋白的纯化 SDS-PAGE鉴定结果显示,获得了高纯度的gE蛋白,且纯度在90%以上;Western blot鉴定结果显示,纯化的重组gE蛋白与His单克隆抗体反应性较好(图2)。经BCA蛋白质含量测定试剂盒测定,质量浓度为0.8 mg/mL。
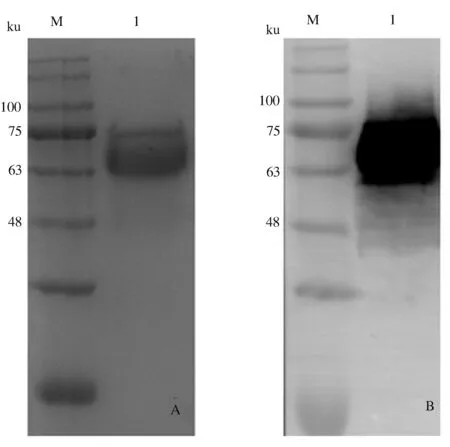
A:SDS-PAGE结果(M:蛋白质预染Marker;1:纯化后gE
2.1.3 重组gE蛋白的活性鉴定 将重组gE蛋白点至NC膜,分别以PRV阳性血清和His单克隆抗体为一抗,通过Dot blot鉴定重组gE蛋白活性,结果表明,重组gE蛋白具有良好的生物学活性(图3)。

A:gE蛋白与阳性血清的反应性(1:gE蛋白;2:阴性对照);
以重组gE蛋白作为包被抗原,以PRV阴性及阳性血清为一抗,通过ELISA鉴定重组蛋白活性,结果显示,重组gE蛋白活性良好并能鉴别PRV阴性及阳性血清(图4)。

图4 重组gE蛋白的ELISA鉴定Fig.4 ELISA identification of recombinant gE protein
2.2 PRV gE蛋白单克隆抗体的制备
用重组gE蛋白免疫小鼠后,分离小鼠脾细胞与SP2/0细胞融合,在第7~10天用IPMA法进行初筛。阳性多克隆经亚克隆后获得4株单克隆,分别命名为2F10、4C10、9E1、10C3。将这4株单克隆细胞分别腹腔注射小鼠,获得了4株gE单克隆抗体的腹水。
2.3 单克隆抗体的鉴定
2.3.1 单克隆抗体的效价 以重组gE蛋白为包被抗原,4株单克隆抗体腹水作为一抗,通过ELISA测定单克隆抗体与重组gE蛋白的反应活性。结果显示,4株单克隆抗体腹水均能与重组gE蛋白反应,效价均达到105以上(图5)。
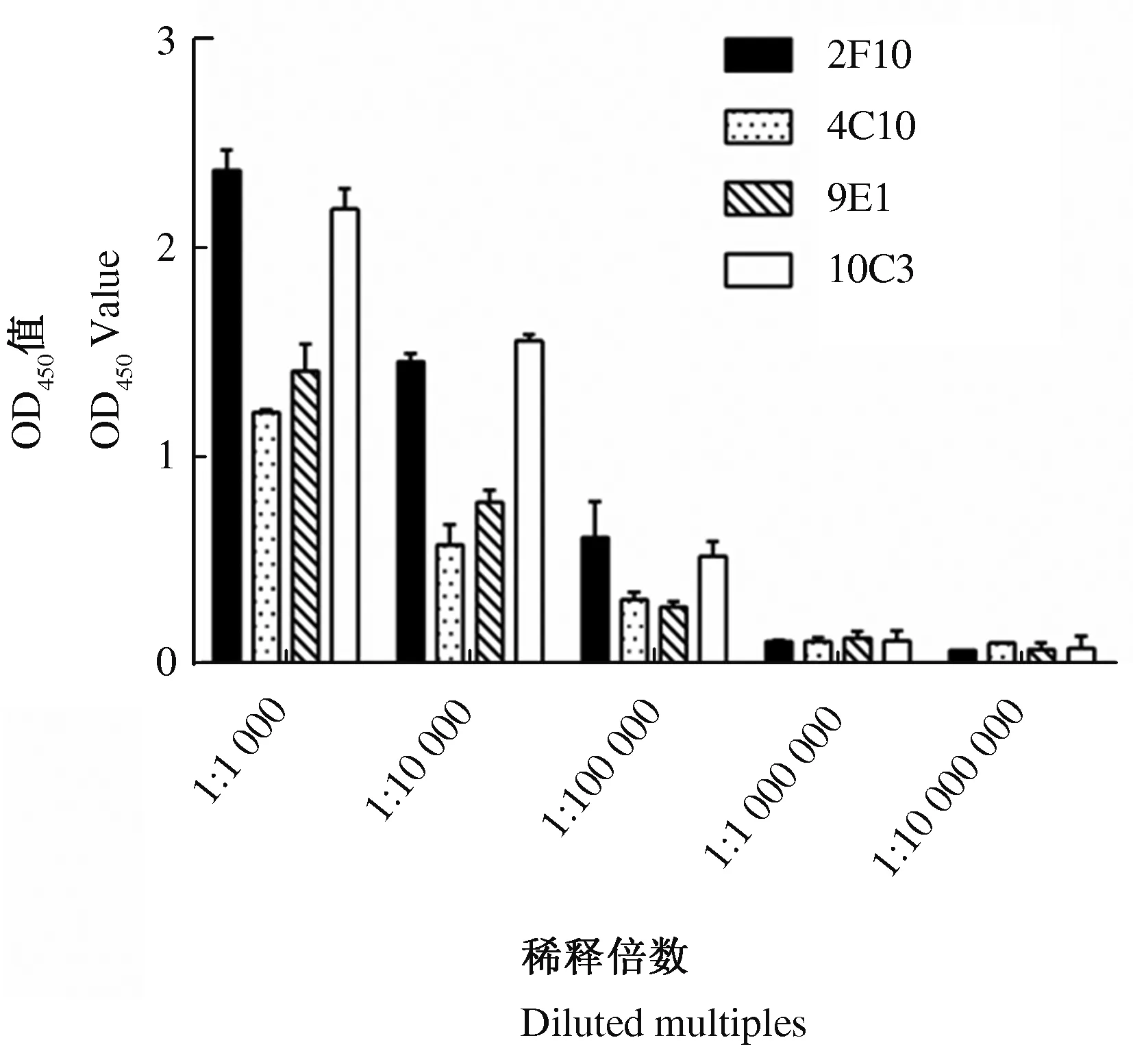
图5 单克隆抗体效价测定结果Fig.5 Detection results of monoclonal antibodies titer
2.3.2 单克隆抗体与重组gE蛋白的反应性 以4株单克隆抗体为一抗,进行Western blot鉴定,结果显示,4株单克隆抗体均能识别重组gE蛋白,且特异性较好(图6)。
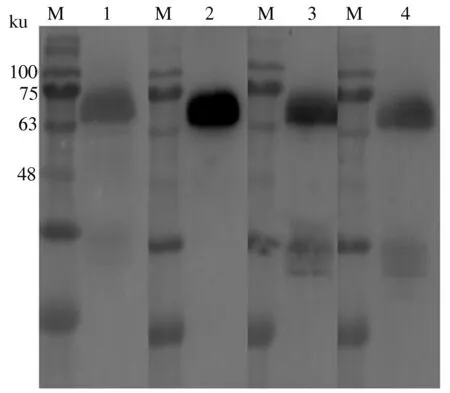
M:蛋白质预染Marker;1:2F10与gE蛋白的反应;2:4C10与
2.3.3 单克隆抗体与病毒的反应性 以4株单克隆抗体为一抗,孵育接种病毒后的PK-15细胞,进行IPMA鉴定,结果显示,4株单克隆抗体均能识别PRV,特异性较好(图7)。

A:2F10与病毒的反应;B:4C10与病毒的反应;C:9E1与病毒的反应;D:10C3与病毒的反应;E:阴性对照;F:阳性对照
2.3.4 单克隆抗体亚型的鉴定 使用鼠源单克隆抗体亚型鉴定试剂盒,鉴定出2F10、4C10、10C3等3株单克隆抗体均为IgG2b亚类,9E1为IgG1亚类;4株单克隆抗体的轻链均为κ链。
3 结论与讨论
PRV能感染圈养和野生动物,但只有猪被认为是PRV动物宿主,因为猪是唯一能在急性感染中存活并潜伏感染的动物。全球曾普遍使用PRV的灭活疫苗和减毒活疫苗,现在通过使用基因缺失疫苗,配合相关检测手段,可以区分野毒感染和疫苗免疫抗体,因而能更好地促进猪场病毒的净化。虽然一些欧美国家,通过基因缺失疫苗及辅助的抗体检测技术已经根除了PRV,但由于我国的畜牧业情况复杂,许多个体养殖户难以管理控制。而且我国新出现的变异株使该病的防控变得更加困难[13],因此,我国仍需要投入大量的研究[14],并通过有效手段尽早地清除PRV,减少猪场的经济损失[15]。
当前,PRV gE抗体ELISA检测技术是养殖场和检测部门鉴别诊断PRV的主要手段[16],其结果可以提示猪群疫苗免疫情况及是否存在野毒感染,为养殖场该病的净化提供极大的帮助。然而,ELISA检测技术成本较高,不便于临床应用,中小猪场使用较少。因此,要研究快速简便的定量检测方法,提高中小养殖场该病检测水平,从而加快我国对该病的净化。
本研究选用毕赤酵母X-33株为宿主菌,pPICZαA为重组表达载体,成功表达了经糖基化修饰的PRV gE蛋白。同时,pPICZαA载体自身携带信号肽及His标签,有利于重组gE蛋白分泌性表达的检测与纯化。利用真核系统表达后,得到了更接近于天然结构的高活性PRV gE蛋白。不足的是,酵母表达周期长且获得目的蛋白的量较低。因此,仍需对该系统的表达条件进行进一步的探索与优化。将PRV gE蛋白免疫小鼠后进行细胞融合,通过IPMA法筛选得到阳性多克隆,并通过有限稀释法亚克隆获得阳性单克隆细胞,将阳性单克隆细胞注射到BALA/c小鼠腹腔,收集小鼠腹水得到针对PRV gE蛋白的特异性单克隆抗体[17]。获得的单克隆抗体特异性强、敏感性良好,能同时识别重组gE蛋白和PRV。本研究成功获得了针对PRV gE蛋白的特异性单克隆抗体,为PRVgE抗体快速检测方法的研究,以及PR的临床鉴别诊断和净化奠定了基础。
