茴拉西坦/介孔二氧化硅的制备及释药性能
2019-10-19吕江维魏亚青王鹏光
吕江维,魏亚青,王鹏光,孙 晗,赵 静
(哈尔滨商业大学药学院,哈尔滨 150076)
1 引 言
2001年Vallet-Regi等[1]首次将具有六方排列均匀孔道的介孔材料MCM-41应用于药物载体领域,此后不同类型的介孔硅材料在药剂学方面的应用一直是研究的热门课题之一[2-6]。介孔二氧化硅是一种性能优良的药物载体材料,因其具有介孔孔径(2~50 nm)均一可调、良好的生物相容性、能够有效负载诊疗制剂等特点,最初被广泛应用于药物的缓控释领域[7-9]。后续研究发现,介孔硅材料在难溶性药物增溶方面也展现出良好的应用前景[10-12]。
在化工制药生产中,很多的药物都属于水难溶性药物[13]。按照生物药剂学分类系统划分,其中的Ⅱ类药物,属于低溶解度高渗透性药物[14-15]。这类药物因其在水中溶解度小,溶出慢,药物难以达到治疗所需的最低浓度,吸收缓慢且不完全从而影响疗效的发挥,限制了临床应用。因此,增加水难溶性药物的溶出度是改善其在体内的吸收,是提高生物利用度的关键因素[16]。目前,制药工业上采用的增溶新技术包括合成水溶性前体药物[17]、形成包合物[18]、制成纳米晶药物[19]、制成微乳[20]等。而介孔二氧化硅材料的出现为增加难溶性药物的溶出度提供了新的选择。介孔二氧化硅属于无机疏水性材料,其疏水性表面对低水溶性药物有良好的吸附性能,介孔孔道可作为水难溶性药物的优良贮库。由于具有较大的比表面积和较高的介孔孔容有利于药物的高度分散与负载[21]。其介孔的孔径较小,当孔径是药物分子直径的10倍左右时,会限制药物在孔道内吸附成结晶态而以无定形态沉积。与结晶型药物相比,无定形态或非晶态药物口服后在与胃肠液接触后可以更快的释放溶出,从而促进药物的吸收[22]。
在多种介孔硅材料中,MCM-41和SBA-15是具有相同的二维六方孔道结构的介孔二氧化硅材料[23-24],孔径均一且比表面积较大,利于难溶性药物的负载。但由于材料合成时使用的作为结构导向剂的模板剂不同,两种材料展现出不同的孔径大小及孔壁厚度,也具有不同的载药及释药性能。介孔材料本身的结构参数是影响药物的负载与溶出的主要因素。本文制备了两种不同孔径、孔容和比表面积但都具有二维六方孔道排列的MCM-41和SBA-15介孔二氧化硅载体,将难溶性药物茴拉西坦负载于载体上,研究相应的载药规律;并通过载药载体与茴拉西坦原料药在体外不同pH值溶出介质中的溶出度研究,探讨了材料结构与药物释放机制之间的关系,本研究为增加难溶性药物的溶出度开发增溶新技术提供了新的思路,也为提高难溶性药物口服生物利用度积累基础数据。
2 实 验
2.1 实验材料
茴拉西坦原料药(纯度99%),湖北兴银河化工有限公司;PEO-PPO-PEO (P123,分子量5800),西格玛奥德里奇(上海)贸易有限公司;十六烷基三甲基溴化铵(CTAB,Cetyl trimethylammonium bromide),分析纯,上海生工生物工程有限公司;正硅酸乙酯(分析纯),天津科密欧化学试剂有限公司;氢氧化钠、盐酸、氨水、乙酸乙酯、磷酸二氢钠,均为分析纯,天津市天力化学试剂有限公司;实验用水为蒸馏水,哈尔滨文景蒸馏水厂。
2.2 分析测试仪器
扫描电镜,ZEISS SUPRA 40型,德国蔡司;透射电镜,Tecnai-G20,美国FEI公司;傅立叶变换红外光谱仪,FTIR-650型,天津港东科技发展股份有限公司;X射线衍射仪,Bruker D8型,德国布鲁克;物理吸附仪,Tristar II Plus 型,美国麦克公司;差热-热重(DTA-TG)同时分析仪,DTG-60型,日本岛津SHIMADZU公司;紫外可见分光光度计,UV-2021PC型,尤尼柯上海仪器有限公司;电子天平,LE204E/02型,梅特勒-托利多仪器(上海)有限公司;烘箱,上海福玛实验设备有限公司;水浴恒温振荡器,SHA-A型,江苏金坛市环宇科学仪器厂。
2.3 介孔二氧化硅的制备
2.3.1 MCM-41的制备
将4.0308 g CTAB溶于100 mL水中,搅拌使其溶解,加入48 mL NH3·H2O调节反应体系pH为弱碱性,再缓慢加入20 mL正硅酸乙酯(TEOS),搅拌4 h,将溶液倒入水热反应釜中,静置24 h,于100 ℃恒温反应48 h,待冷却后将反应产物用去离子水洗涤至中性,抽滤,60 ℃烘干,置马弗炉中550 ℃煅烧4 h,除去模板剂,即得MCM-41。
2.3.2 SBA-15的制备
将4.0515 g P123溶于120 mL 2 mol/L HCl中,置38 ℃水浴恒温磁力搅拌器中加热使其溶解,缓慢加入8.4386 g正硅酸四乙酯(TEOS),于38 ℃水浴搅拌4 h,将溶液倒入水热反应釜中,静置24 h,于100 ℃恒温反应48 h,待冷却后将反应产物用去离子水洗涤至中性,抽滤,60 ℃烘干,置马弗炉中550 ℃煅烧5 h,除去模板剂,即得SBA-15。
2.4 载药介孔二氧化硅载体的制备及载药量测定
采用浸渍法将茴拉西坦负载于介孔二氧化硅上,称取适量茴拉西坦溶于乙酸乙酯溶液,配成一定浓度的茴拉西坦乙酸乙酯溶液。向溶液中加入MCM-41和SBA-15载体,在水域恒温振荡器37 ℃、100 r/min恒温震荡24 h,过滤,收集滤饼。将滤饼于60 ℃真空干燥8 h,即得载药载体(记为Aniracetam/MCM-41和Aniracetam/SBA-15)。
称取载药载体适量,加入乙酸乙酯30 mL,超声30 min,离心,取上清液经0.45 μm微孔滤膜过滤,采用紫外分光光度法测定游离药物浓度,由标准曲线计算药物浓度,按式(1)计算载药量(%)。

(1)
2.5 载药介孔二氧化硅载体溶出度测定
按照《中国药典》2015版(四部)通则0931溶出度与释放度测定法第二法桨法,配置三种不同pH值溶液(pH值为4.5、6.8和7.4)为溶出介质,体积900 mL,转速为50 r/min,温度37±0.5 ℃,分别于5 min、10 min、15 min、30 min、45 min、60 min,取样5 mL(同时补充同温介质5 mL),0.45 μm微孔滤膜过滤,取续滤液,采用紫外可见分光光度法测定茴拉西坦的浓度,计算累积溶出度,比较Aniracetam/MCM-41和Aniracetam/SBA-15与茴拉西坦原料药的释放规律。
3 结果与讨论
3.1 介孔二氧化硅形貌与骨架结构分析
采用SEM对介孔二氧化硅的表面形貌进行观察,从图1可知,MCM-41外形大体为球形,球形粒径接近1 μm,但球形颗粒间有粘连。SBA-15外形近似圆柱形短棒,棒长度在1~2 μm左右。

图1 不同介孔二氧化硅的扫描电镜(SEM)Fig.1 Scanning electron microscope (SEM) images of different mesoporous silica

图2 不同介孔二氧化硅的高分辨透射电镜(HRTEM)Fig.2 High resolution transmission electron microscopy (HRTEM) images of different mesoporous silica
为了获得更详细的介孔孔道结构信息,采用高分辨的TEM对两种介孔材料的孔道结构进行观察。MCM-41具有二维六方结构,从图2(a)和(b)能够观察到沿孔道方向[001]c轴方向显示的六方对称的孔道排列。而SBA-15也为二维六方结构,如图2(c)和(d)能够观察到垂直于孔道方向沿c轴方向规则排列的长孔道平行于其柱状外形,且孔壁较厚,具有规则的孔结构、孔道均匀且有序性良好。比较可以发现,SBA-15的孔径及孔壁均比MCM-41的大。
图3(a,c)是未载药的空白MCM-41和SBA-15的红外光谱,可以看出,两种介孔二氧化硅的红外光谱比较相似,其中对应于介孔二氧化硅材料骨架结构的吸收峰为1081 cm-1处的Si-O-Si的反对称伸缩振动峰(vasSi-O-Si)、798 cm-1处的Si-O-Si的对称伸缩振动峰(vsSi-O-Si)及457 cm-1处的Si-O-Si的弯曲振动峰(δSi-O-Si)。上述三个吸收峰是典型的介孔二氧化硅的特征吸收峰,与文献报道相符[25-26]。968 cm-1处的特征吸收峰为端基硅羟基Si-OH的对称伸缩振动[25]。而位于1645 cm-1的吸收峰是由硅表面的硅羟基的弯曲振动引起的;3460 cm-1处出现的宽的吸收峰为硅羟基与水形成的氢键或者是硅羟基与硅羟基之间形成氢键所引起的伸缩振动吸收峰[27-28],这几处吸收峰表明制备的介孔二氧化硅具有较大的比表面积和丰富的硅羟基。图3(b,d)分别为载药后的MCM-41和SBA-15的三组红外光谱图,也出现了与空白载体相同的硅骨架的吸收峰。曲线e为茴拉西坦原料药红外光谱,其中1249 cm-1处吸收峰为C-O-C的不对称的伸缩振动(vasC-O-C);1030 cm-1处为C-O-C的对称的伸缩振动(vsC-O-C);1728 cm-1处为C=O的振动 (vC=O酮);1660 cm-1处为C=O的振动 (vC=O酰胺);1604 cm-1、1514 cm-1、1464 cm-1、1443 cm-1均为苯环骨架振动;858 cm-1、824 cm-1处为=CH苯环二取代的变形振动(δ=CH)[29]。比较载药前后的红外光谱可以看出,载药后介孔二氧化硅的谱图还是以硅基载体的主要特征吸收峰为主,说明载药后没有影响硅的骨架结构,载药后出现的其他吸收峰均为茴拉西坦的吸收峰,没有出现除药物和载体以外的新峰,说明药物与载体未发生化学反应,药物在载体上的存在状态属于物理吸附。
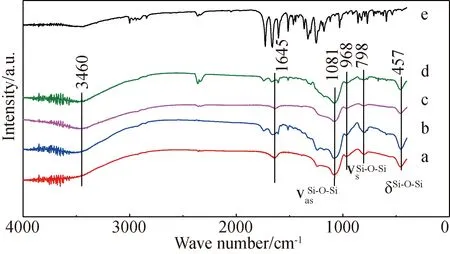
图3 不同介孔二氧化硅的红外光谱图(IR)Fig.3 Infrared spectra (IR) of different mesoporous silica

图4 不同介孔二氧化硅的小角度XRD图谱Fig.4 Small angle XRD patterns of different mesoporous silica
3.2 介孔二氧化硅孔道结构分析
介孔二氧化硅的孔壁是非晶态的,在广角XRD没有明显的衍射峰出现。但由于介孔材料的孔道属于周期性有序排列的,并且材料本身的晶胞参数一般都很大,所以在小角度(2θ=0~5°)XRD会有明显的衍射峰出现,该衍射峰的产生是基于介孔孔道的有序性,可以确定孔道的结构类型。因此这里采用小角度XRD测试将由孔道对称性决定的面称为介孔材料的晶面,并沿用晶体学中的晶面指数、晶面间距、晶胞参数等概念来分析介孔材料的结构。从图4可以看出,茴拉西坦原料药在小角度0.5°~5°之间没有衍射峰。而两种介孔二氧化硅均出现了可指认的不同晶面的衍射峰,MCM-41的3个衍射峰位于2.2°、3.8°和4.4°附近,与标准卡片比对,对应于二维六方相(P6mm)的(100)、(110)、(200)晶面;SBA-15的3个衍射峰位于0.8°、1.5°和1.7°附近,对应二维六方相(P6mm)的(100)、(110)和(200)晶面,均与文献报道相符[9,23]。载药前后材料的衍射峰位没有明显变化,说明药物载入介孔硅中没有影响孔道结构的有序性,骨架结构没有变化,孔道的有序性良好。
对MCM-41和SBA-15载体的XRD数据,利用MDI JADE 6软件,采用布拉格公式,根据衍射峰位(2θ)及晶面指数(hkl)计算载体各衍射峰对应的晶面间距d值及晶胞参数如下表所示。

表1 两种介孔二氧化硅晶胞参数Table 1 Cell parameters of two kinds of mesoporous silica
MCM-41与SBA-15结构类似,都具有二维六方结构孔道,但SBA-15较MCM-41峰位明显向低衍射角方向移动,说明其晶胞比MCM-41要大。按照二维六方点阵(P6mm)标定,计算得到SBA-15晶胞参数a=11.84279 nm,是MCM-41的晶胞参数a=4.63593 nm的二倍多。

图5 载药前后介孔二氧化硅的N2吸附-脱附等温线及孔径分布图Fig.5 Nitrogen adsorption/desorption isotherms and pore width distribution(insets) of drug unloaded and loaded mesoporous silica
这里进一步采用N2吸附-脱附测试孔道结构,从图5的N2吸附-脱附等温线可知,不同的介孔二氧化硅在载药前后的吸附等温线均符合都具有IV型吸附曲线,是典型的介孔材料吸附曲线[30-32],并且曲线上出现不同程度的滞后环。
对于MCM-41,当P/P0<0.3时,N2的吸附量随着分压的增大而缓慢增加,这是N2在样品表面的单分子与多分子吸附所致;当0.3
0.9时,曲线上出现一个较大的突越,这是N2在样品颗粒之间的凝聚所致。
对于SBA-15,载药前后的滞后环都很明显。在吸附等温线分支上,当P/P0<0.7时,N2的吸附量随着分压的增大而缓慢增加,为单分子与多分子吸附所致;当0.7
0.85时,N2在毛细管内的吸附已经达到饱和状态;其中在0.7
采用Barrett-Joyner-Halenda (BJH) 法计算介孔材料的孔径和孔容,采用 Brunauer-Emmett-Teller (BET) 模型计算介孔材料的比表面积,将计算得到的孔径、孔容和比表面积的结果列于表2。
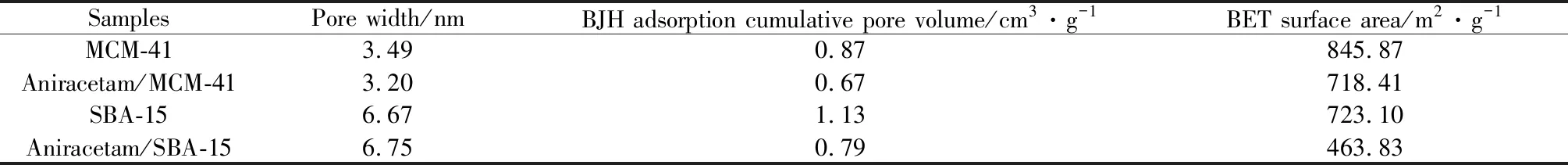
表2 载药前后介孔二氧化硅的孔道参数计算结果Table 2 Mesoporous parameters of drug unloaded and loaded mesoporous silica
从表2可以看出,两种介孔二氧化硅载药前后的孔径基本不变,MCM-41载药前后孔径在3 nm左右,而SBA-15载药前后的孔径在6 nm左右,从图5孔径分布图也可以看出两种材料孔径分布非常集中均一,表明所制备的两种载体材料孔径均在介孔范围(2~50 nm),但载药后的孔径分布曲线的尖锐程度有所降低,说明药物装载进入了介孔孔道,使孔道的孔径分布范围略有分散。载药后两种材料的孔容和比表面积较载药前均有明显下降,说明药物分子吸附进入孔道,降低了孔道空间和比表面积。
MCM-41和SBA-15具有相同的二维六方的晶体结构,但MCM-41的孔径小、孔容小使得单位质量的比表面积大,SBA-15的孔径大、孔容大但单位质量的比表面积要小。结合XRD分析结果,MCM-41的晶胞参数为a=4.63593 nm,孔径3.49 nm,其壁厚约1 nm左右;SBA-15的晶胞参数a=11.84279 nm,孔径6.67 nm,其壁厚约5 nm左右。这一结果与TEM测试观察到的孔径及孔壁大小相符。孔壁越厚,材料的稳定性也相对越好,骨架结构坍塌的可能越小。
3.3 介孔二氧化硅载药及释药性能分析
对载药后两种介孔二氧化硅载体的载药量进行测试,结果如表3所示,SBA-15载药量高于MCM-41,两种介孔材料的孔径、孔容分别为6.67 nm 1.13 cm3/g(SBA-15)、3.49 nm 0.87 cm3/g(MCM-41),表明载药量与介孔孔径及孔容大小成正相关,孔径越大有利于浸渍法载药时药物扩散进入孔道内,孔容越大能容纳药物分子的量也越多。

表3 载药后不同介孔二氧化硅的载药量Table 3 Drug loading rate of different mesoporous silica
借助热重分析,通过对两种材料的热重曲线变化进一步研究载药量大小。图6曲线e为茴拉西坦原料药的热重曲线,从室温升至接近300 ℃,原料药基本分解,失重接近100%。曲线a、c分别为空白MCM-41和SBA-15载体的热重曲线,升温至接近600 ℃时,失重分别为12%、10%,该重量变化是载体吸附的少量水分等的失重。曲线b、d分别为载药后MCM-41和SBA-15的热重曲线,600 ℃时的失重分别为26%、34%,与空白载体的差值反映的是载体中茴拉西坦原料药升温导致的失重,差值大小顺序也为SBA-15>MCM-41,与载药量的测试结果顺序相符。
为了明确药物吸附于介孔孔道内的状态,采用差热分析测试了材料的差热曲线。图7是载药前后介孔二氧化硅、茴拉西坦原料药和物理混合物的差热曲线,其中物理混合物是将药物与载体按照载药量的比例进行的物理混合。曲线a(茴拉西坦原料药)在122.5 ℃出现的特征峰为茴拉西坦的熔融吸热峰,两种空白介孔二氧化硅载体(曲线d MCM-41和e SBA-15)没有特征峰出现。两种物理混合物(曲线b MCM-41物理混合物和c SBA-15物理混合物)在122.5℃均出现了茴拉西坦的熔融吸热峰,而载药后的两种载体(曲线f Aniracetam/MCM-41和g Aniracetam/SBA-15)该处的特征峰均消失,说明茴拉西坦负载在载体上是由结晶型转变成了无定形的非结晶态装载进入了介孔孔道内。
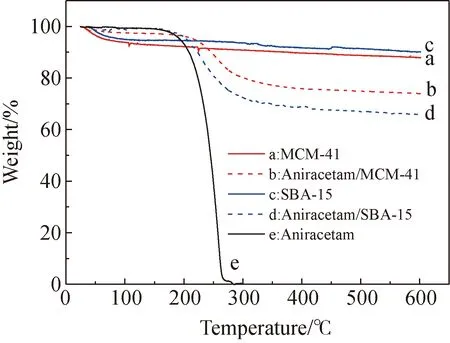
图6 载药前后介孔二氧化硅的热重曲线Fig.6 Thermal gravimetric (TG) curves of drug unloaded and loaded mesoporous silica
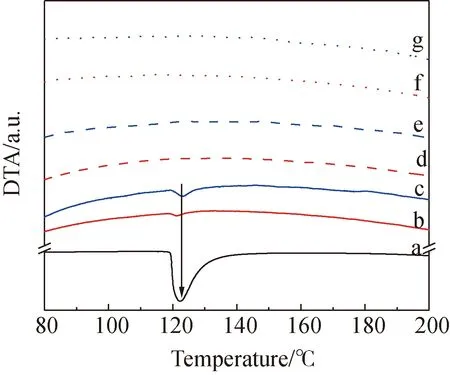
图7 载药前后介孔二氧化硅、茴拉西坦原料药和物理混合物的差热曲线Fig.7 Differential thermal analysis (DTA) curves of drug unloaded and loaded mesoporous silica, aniracetam drug substance and physical mixture

图8 载药介孔二氧化硅载体在不同pH溶出介质中的溶出曲线Fig.8 Dissolution curves of drug-loaded mesoporous silica in different pH dissolution
在pH值为4.5、6.8、7.4三种溶出介质中测定载药载体材料的释药溶出度,并与茴拉西坦原料药进行对比。比较图8(a)和(b)载药后两种介孔二氧化硅载体在pH=4.5和pH=6.8的溶出介质中的溶出曲线可以看出,在60 min之内MCM-41和SBA-15载体的溶出曲线比较接近,而原料药的溶出最慢,溶出快慢的顺序为SBA-15≈MCM-41>原料药。图8(c)为两种介孔二氧化硅载体在pH=7.4的溶出介质中的累积溶出曲线,溶出快慢的顺序为SBA-15>MCM-41>原料药。茴拉西坦原料药负载于两种介孔二氧化硅载体后均能够能明显提高药物的溶出速率,在不同pH介质中均能够快速释放溶出,并且在初始的5 min载体上的药物就能够达到80%以上的快速溶出。释放的机制是由于负载在介孔二氧化硅孔道内的茴拉西坦以非结晶态的分子状态存在,与介孔二氧化硅表面相互作用力较弱,当载体材料分散在溶液中时,水分子占据介孔二氧化硅的吸附位点,将茴拉西坦分子快速置换出来,使茴拉西坦更易从孔道内向外扩散。对于BCSⅡ类药物,提高溶出速率可以提高药物的口服吸收,从而利于提高药物的生物利用度。
结合两种材料的结构分析,MCM-41和SBA-15都具有类似的二维六方的晶体结构,但孔径孔容不同,孔径与孔容较大的SBA-15的载药量高于MCM-41。对于溶出介质为pH=4.5和pH=6.8时,即使在相近的累积溶出度结果下,由于载药量较高SBA-15释放的药物量也会高于MCM-41;而pH为7.4时,SBA-15的溶出较MCM-41更快。对于SBA-15,其较厚的孔壁结构更有利于提高材料结构的稳定性。因此综合评价比较两种介孔二氧化硅的性能结果为SBA-15优于MCM-41。
4 结 论
采用水热合成法制备了具有相同二维六方孔道结构但不同孔径及孔容的MCM-41(3.49 nm 0.87 cm3/g)和SBA-15(6.67 nm 1.13 cm3/g)载体材料,负载难溶性药物茴拉西坦的载药量分别为17%和22%,与介孔孔径及孔容成正相关。与茴拉西坦原料药相比,在不同溶出介质(pH=4.5、6.8和7.4)中,茴拉西坦负载于两种介孔二氧化硅载体均能够明显提高药物的溶出速率,这是由于药物分子以非结晶态装载于在介孔孔道内,因而更易从孔道向外扩散所致。结合材料表征、载药量及溶出度综合比较,SBA-15载体的载药及释药性能均优于MCM-41载体。
