p62蛋白在大肠癌中的表达及对大肠癌细胞生物学特性的影响
2019-10-18王晓明梁国栋王岩杨玉波刘峰
王晓明,梁国栋,王岩,杨玉波,刘峰
吉林省肿瘤医院结直肠胃腹部外科,长春130012
大肠癌是常见的消化系统恶性肿瘤,位居全球肿瘤发病率和病死率的第2位,全球每年新发大肠癌病例约140万例[1],中国大肠癌的发病率和病死率增长迅速,且发病年龄明显提前[2-3]。结肠癌的发生、发展是一个多靶点参与的复杂过程。p62蛋白为原癌基因c2myc的表达产物,其作为一种肿瘤基因编码的蛋白,调控着细胞周期、增殖、凋亡及自噬过程[4-6],在多种肿瘤的发生、发展过程中发挥重要作用[7-9]。然而,关于p62蛋白在大肠癌中作用及具体作用机制的生物学研究鲜有报道。本研究探讨了60例大肠癌患者大肠癌组织和细胞中p62蛋白的表达情况及其在大肠癌细胞中的生物学特性,分析了p62蛋白在大肠癌发生、发展及转移过程中的作用,旨在为大肠癌患者的临床个体化治疗提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年1月至2016年1月吉林省肿瘤医院收治的大肠癌患者的临床资料。纳入标准:经病理学检查确诊为大肠癌;术前未接受过放疗、化疗等抗肿瘤治疗;临床资料完整。排除标准:合并其他部位恶性肿瘤;因其他原因在随访3个月内死亡。根据纳入、排除标准,本研究共纳入60例大肠癌患者,其中,男29例,女31例;年龄为42~60岁,中位年龄为52岁;临床分期:I期11例,Ⅱ期14例,Ⅲ期20例,Ⅳ期15例。收集60例大肠癌患者的大肠癌组织及癌旁组织石蜡标本。
1.2 细胞与试剂
人大肠癌HT29和SW480细胞均购自美国模式菌种收集中心(American Type Culture Collection,ATCC);胎牛血清、胰蛋白酶均购自美国Hy-Clone公司;鼠抗人p62单克隆抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠抗体均购自美国Santa Cruze公司;即用型免疫组化试剂盒、枸橼酸盐缓冲液、通用型二抗、二氨基联苯胺(diaminobenzidine,DAB)显色液及一抗稀释液均购自北京中杉金桥生物技术有限公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂和LipofectamineTM2000转染试剂均购自美国Sigma公司;干扰小RNA(small interfering RNA,siRNA)由上海生工生物工程股份有限公司合成;电化学发光(electrochemiluminescence,ECL)试剂购自美国Millipore公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)和碘化丙啶(propidium iodide,PI)凋亡试剂盒购自美国BD公司。
1.3 细胞培养及转染
将人大肠癌HT29和SW480细胞接种于含20%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的IMDM培养液中,置于37℃、5%CO2的培养箱中进行培养,每2~3天传代一次。将处于对数生长期的HT29细胞按照每孔5×104个细胞接种于6孔板中,待细胞生长至70%左右时,选择p62蛋白表达水平高的HT29细胞进行转染,细胞转染步骤严格参照LipofectamineTM2000转染试剂盒操作说明书进行。将转染72 h的HT29细胞分为3组:siRNA/p62组,转染p62特异性siRNA;阴性对照组,不做任何处理;siRNA/SCR组,转染阴性对照序列,即UU序列——5'-AUGUUUGCCAUGAGUAUUA-3'。转染48 h后收集细胞进行后续实验。
1.4 免疫组织化学染色法检测不同组织中p62蛋白的表达情况及结果判定
将石蜡切片置于65℃烤箱内烘烤6~8 h,待脱蜡返水后,采用枸橼酸盐缓冲液(pH=7.4)高压抗原修复2 min,待温度降至室温后,采用3%过氧化氢室温封闭30 min,去除内源性过氧化物酶,4℃孵育一抗过夜,室温复温后加入通用型二抗,37℃孵育30 min,采用DAB进行显色,苏木素复染,脱水、透明、封片后于显微镜下观察并拍照。采用磷酸盐缓冲液(phosphate buffered saline,PBS)作为阴性对照代替一抗。p62蛋白主要定位于细胞核,以细胞核出现明显的黄色或棕黄色颗粒判定为细胞阳性。根据阳性细胞所占比例和染色强度判定免疫组织化学染色结果[10]。
1.5 蛋白质印迹法(Westernblot)检测不同细胞中p 62蛋白的表达情况
采用RIPA裂解液分别提取HT29和SW480细胞总蛋白,筛选出p62蛋白表达水平高的细胞系,提取3组HT29细胞的总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacryl amide gel electrophoresis,SDS-PAGE)后将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;在5%脱脂奶粉中封闭1 h;加入鼠抗人p62单克隆抗体(稀释浓度为1∶1000),4℃孵育过夜,采用三乙醇胺缓冲盐水溶液(tris buffered saline tween,TBST)清洗3次,每次10 min;加入HRP标记的羊抗鼠二抗(稀释浓度为1∶500),室温轻度振荡1 h,应用ECL法于暗室显色,曝光胶片并扫描。实验重复3次。蛋白的相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.6 MTT法检测HT29细胞增殖率
分别取处于对数生长期的3组细胞,加入培养板中培养5 h,每组设3个复孔,24、48、72 h后每孔加入MTT,检测490 nm波长处的光密度(optical density,OD)值,计算细胞增殖率。实验重复3次。
1.7 划痕实验检测HT29细胞的迁移能力
取对数生长期的3组细胞,采用无血清培养基培养12 h,在6孔板中分别轻划2条垂直线,应用PBS清洗未贴壁的细胞。荧光显微镜下分别记录不同时间点(12、24 h)的细胞迁移距离,每个实验组设3个复孔,取其平均值。实验重复3次。
1.8 随访
采用电话随访的方式对所有大肠癌患者进行随访,每月进行1次电话随访,随访时间为0~12个月,随访内容为患者的生存情况。
1.9 统计学分析
采用SPSS 13.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验,多个时间点重复测量数据采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 p62蛋白在不同组织中表达情况
免疫组织化学染色结果显示,大肠癌组织细胞核中的棕黄色颗粒较多。大肠癌组织中p62蛋白的阳性表达率为66.7%(40/60),明显高于癌旁组织的36.7%(22/60),差异有统计学意义(χ2=10.812,P<0.01)。
2.2 不同临床特征大肠癌患者大肠癌组织中p62蛋白的阳性表达情况
不同远处转移情况的大肠癌患者大肠癌组织中p62蛋白阳性表达率比较,差异有统计学意义(P<0.01);不同年龄、性别、肿瘤直径、分化程度和临床分期的大肠癌患者大肠癌组织中p62蛋白阳性表达率比较,差异均无统计学意义(P>0.05)。(表1)
2.3 p62蛋白表达与大肠癌患者预后的关系
p62阳性表达的大肠癌患者的1年累积生存率为22.9%,p62阴性表达的大肠癌患者的1年累积生存率为72.0%。p62阳性表达和p62阴性表达的大肠癌患者的生存情况比较,差异有统计学意义(χ2=10.525,P<0.01)。(图1)
2.4 p62蛋白在大肠癌细胞中的表达情况
Western blot检测结果显示,p62蛋白在SW480和HT29细胞中均表达,HT29细胞中p62蛋白的表达水平为(0.73±0.06),明显高于SW480细胞的(0.43±0.09),差异有统计学意义(t=5.684,P<0.01)(图2A)。HT29细胞中转染p62蛋白72 h后,siRNA/p62组HT29细胞中p62蛋白的表达水平为(0.323±0.024),siRNA/SCR组HT29细胞中p62蛋白的表达水平为(1.510±0.216),阴性对照组HT29细胞中p62蛋白的表达水平为(1.730±0.114),3组比较,差异有统计学意义(F=85.561,P<0.01)。siRNA/p62组HT29细胞中p62蛋白的表达水平明显低于siRNA/SCR组和阴性对照组,差异均有统计学意义(t=15.281、17.035,P<0.01)(图2B)。
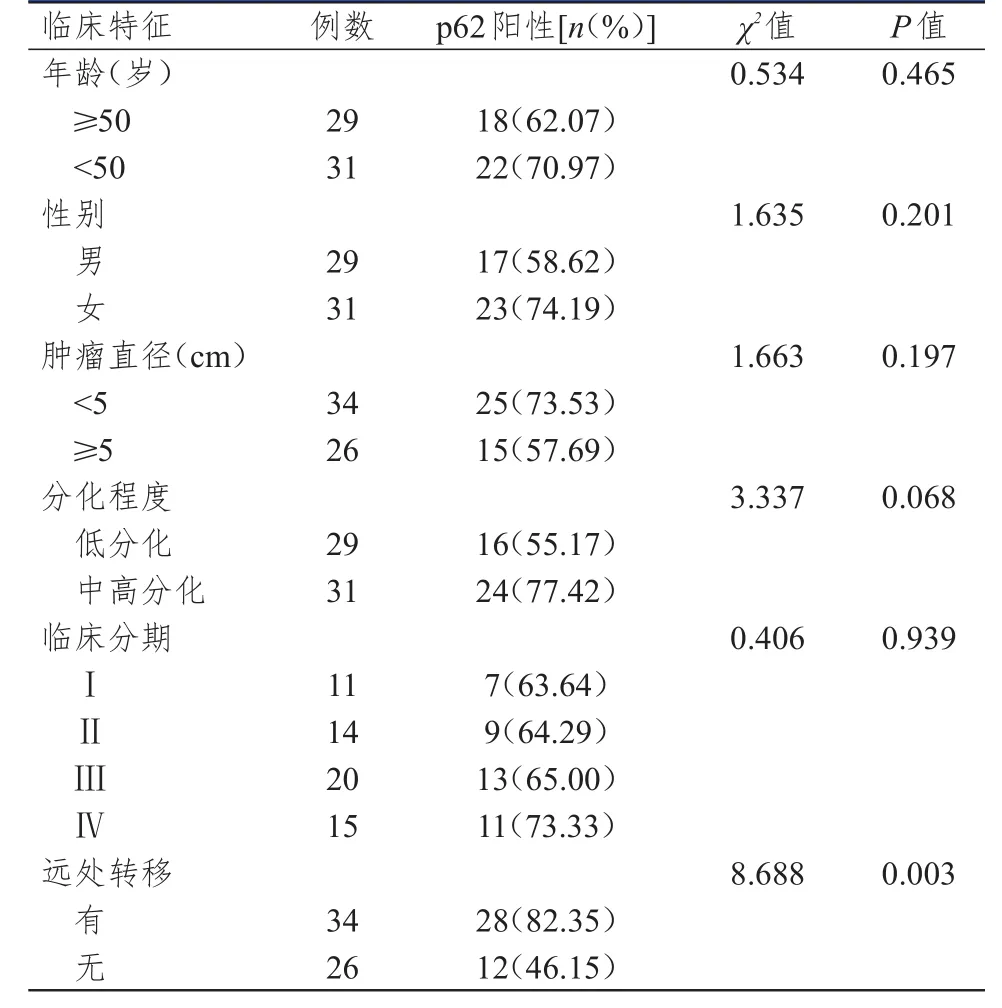
表1 不同临床特征大肠癌患者大肠癌组织中 p62蛋白的阳性表达情况
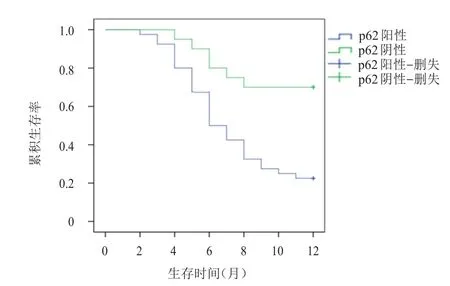
图1 p62蛋白阳性表达患者(n=40)与阴性表达(n=20)患者的生存曲线

图2 Western blot法检测p62蛋白在大肠癌HT29和SW480细胞中的表达情况
2.5 p62蛋白对HT29细胞增殖能力的影响
随着时间的增加,3组HT29细胞的OD值不断升高,差异有统计学意义(F时间=1.644,P时间<0.01);组间比较,差异有统计学意义(F组间=65.016,P组间<0.01)。0 h时,3组HT29细胞的OD值比较,差异无统计学意义(P>0.05);72 h时,3组HT29细胞的OD值比较,差异有统计学意义(F=28.27,P<0.01)。24~72 h时,siRNA/p62组HT29细胞的OD值均明显低于阴性对照组和siRNA/SCR组,差异均有统计学意义(t=7.047、7.047、5.774,P<0.01)。(表2)
表2 转染后不同时间点 3组HT29细胞的OD值(±s)

表2 转染后不同时间点 3组HT29细胞的OD值(±s)
时间0 h 24 h 48 h 0.20±0.01 0.58±0.10 0.97±0.14 0.20±0.02 0.51±0.18 0.75±0.17 0.20±0.01 0.61±0.14 0.95±0.19 72 h阴性对照组1.25±0.05 siRNA/p62组0.90±0.07 siRNA/SCR组1.23±0.07
2.6 下调p62的表达对HT29细胞迁移能力的影响
随着时间的增加,3组HT29细胞的迁移距离逐渐升高,差异有统计学意义(F时间=35810.143,P时间<0.01);组间比较,差异有统计学意义(F组间=318.778,P组间<0.01)。12 h时,3组HT29细胞的迁移距离比较,差异无统计学意义(P>0.05)。24 h时,siRNA/p62组HT29细胞的迁移距离均短于阴性对照组和siRNA/SCR组,差异均有统计学意义(t=5.852、8.154,P<0.01);siRNA/SCR组和阴性对照组HT29细胞的迁移距离比较,差异无统计学意义(P>0.05)。(表3)
表3 转染后不同时间点 3组HT29细胞的迁移距离(mm,±s)

表3 转染后不同时间点 3组HT29细胞的迁移距离(mm,±s)
时间阴性对照组siRNA/p62组siRNA/SCR组12 h 24 h 0.64±0.13 2.08±0.12 0.57±0.12 1.53±0.11 0.60±0.08 2.05±0.10
3 讨论
p62蛋白是一种参与自噬、凋亡和肿瘤发生的关键蛋白,深入研究p62蛋白以及自噬与大肠癌的关系,对阐明大肠癌的发病机制以及寻找新的大肠癌的治疗策略具有积极意义。研究发现,p62蛋白在启动细胞存活信号以及细胞的增殖、分化和抗凋亡基因诱导方面发挥着重要的作用,并且在多种肿瘤中异常表达[11-13]。Inoue等[14]采用免疫组织化学染色法分析p62蛋白在109例非小细胞肺癌患者中的表达情况,结果发现,p62在37%的非小细胞肺癌中表达,并与非小细胞肺癌患者的不良预后有关,提示p62蛋白可能是影响非小细胞肺癌患者预后的重要因素。Schläfli等[15]、吴文涌等[16]分别通过免疫组织化学法检测人肝细胞癌中p62蛋白的表达情况,均发现其与肝细胞癌患者的不良预后密切相关。本研究结果发现,大肠癌组织中p62蛋白的阳性表达率明显高于癌旁组织,且p62阳性表达患者与p62阴性表达大肠癌患者的生存情况比较,差异均有统计学意义(P<0.01),提示p62蛋白在大肠癌中的表达水平较高,且p62蛋白的表达情况与患者的预后密切相关。本研究还探讨了大肠癌组织中p62蛋白的表达情况与患者临床特征的关系,结果发现,不同远处转移情况的大肠癌患者大肠癌组织中p62蛋白的表达情况比较,差异有统计学意义(P<0.01);不同年龄、性别、肿瘤直径、分化程度和临床分期的大肠癌患者大肠癌组织中p62蛋白的表达情况比较,差异均无统计学意义(P>0.05),提示大肠癌的发生可能与大肠癌患者的年龄、性别、肿瘤直径、分化程度和临床分期无关,这为临床大肠癌的治疗提供了重要的实验数据。相关研究结果显示,p62蛋白在结肠癌化疗耐药机制中发挥着重要的作用,下调p62的表达可抑制结肠癌细胞的体外增殖和体内生长[17],这与本研究的结果基本一致,本研究结果显示,p62蛋白在结直肠癌细胞中的表达水平较高,且p62蛋白在HT29细胞中的表达水平高于SW480细胞,并证实了下调p62蛋白的表达对细胞的增殖具有抑制作用,表明p62蛋白可能参与调控大肠癌细胞的生长。为了进一步探讨p62蛋白与肿瘤转移的关系,本研究下调p62蛋白的表达后应用细胞划痕实验进行了验证,结果显示,下调p62蛋白的表达后,HT29细胞的迁移能力受损,表明p62蛋白不仅参与大肠癌细胞的生长,还参与大肠癌细胞的转移。
综上所述,p62蛋白参与大肠癌的生长和转移,可能成为大肠癌进展和预后不良的潜在标志物之一。但本研究的不足之处在于纳入的样本量不足,因此,在后续的研究中将进一步补充临床资料、扩大样本量,深入研究p62蛋白在磷脂酰肌醇3-羟激酶/蛋白激酶B信号通路中的作用,以进一步阐明大肠癌发生、发展的潜在分子机制。
