脑部放疗联合替莫唑胺治疗非小细胞肺癌脑转移疗效和安全性的Meta分析
2019-10-18陈达展周成崔海忠徐细明
陈达展,周成,崔海忠,徐细明
1湖北文理学院附属枣阳市第一人民医院肿瘤科,湖北枣阳441200
2武汉大学人民医院肿瘤科,武汉430060
脑转移瘤是非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的一种神经系统并发症。研究表明,25%~40%的NSCLC患者表现出一定程度的脑转移现象[1]。脑部放疗(brain radiotherapy,BRT)作为一种治疗NSCLC脑转移最常用的方法,主要包括立体定向放射外科(stereotatic radiosurgery,SRS)治疗和全脑放射治疗(whole-brain radiotherapy,WBRT)两种方法,但其中位生存期仅为3~6个月[2]。也有研究显示,化疗联合放疗可使NSCLC脑转移患者的中位生存期上升至6~12个月,而如果不经治疗,其中位生存期可能小于7周[2-4]。对于脑转移瘤患者而言,化疗具有很大的局限性,其原因是绝大多数化疗药物会被机体内的血脑屏障阻挡,无法发挥很大的疗效[5]。替莫唑胺(temozolomide,TMZ)作为一种常见的口服型烷基化剂,已有研究显示其可以通过血脑屏障[6]。TMZ治疗大部分实体瘤(包括原发性脑肿瘤和转移癌)具有较好的疗效[7-8]。Qin等[9]研究表明,WBRT联合化疗(包括TMZ、卡铂)可提高NSCLC脑转移患者的客观缓解率,因此TMZ联合WBRT是一种合理的治疗选择。然而也有研究表明,与单纯WBRT相比,TMZ联合WBRT治疗并未延长患者的生存时间,且增加了不良反应的发生率[10]。本研究进行了随机对照研究的系统回顾和荟萃分析,系统评价BRT联合TMZ与单纯BRT治疗NSCLC脑转移患者的近期疗效、远期疗效及不良反应发生情况,现报道如下。
1 资料与方法
1.1 检索策略
全面检索CHKD期刊全文数据库、万方、维普、PubMed和EMbase等数据库,中文检索词:替莫唑胺、非小细胞肺癌、脑转移、放疗;英文检索词:temozolomide、TMZ、NSCLC、radiotherapy。检索时间为从建库至2018年3月1日。
1.2 文献的纳入和排除标准
纳入标准:①国内文献须发表于中文科技核心期刊,国外文献采用英文全文发表;②文献中所有患者均确诊为NSCLC脑转移;③包含统计需要的原始数据或生存曲线;④文献比较了BRT联合TMZ(观察组)和单纯BRT(对照组)治疗的临床疗效;⑤文献中的统计学方法可以精确表示数据且应用恰当,能准确得出优势比(odds ratio,OR)和相应的95%置信区间(confidence interval,CI)。排除标准:①仅有摘要或前言的文献;②文献中的患者合并淋巴瘤和乳腺癌脑转移症状;③单臂研究。
1.3 文献的质量评估
从以下几个方面对各独立研究进行质量评估:①研究对象的纳入标准及其治疗模式是否符合本研究主题;②统计学方法是否正确;③研究设计是否严谨、科学;④是否就本研究存在的偏倚进行了讨论;⑤该研究是否为前瞻性随机对照研究。以上5项,每满足1项为1分,总分≥3分视为质量可靠。选2名研究者对文献质量进行独立评估,同时对文献资料进行核查,如果遇到有分歧的问题,应通过讨论解决,如有必要,还可选择第3名研究者协助解决。
1.4 异质性检验
采用RevMan 5.2软件对各研究的两组患者客观缓解率、6个月生存率、1年生存率、2年生存率、3级及以上血液和非血液系统不良反应发生率的OR值进行异质性检验,I2表示异质性程度。I2<50%时,采用固定效应模型进行分析;I2≥50%时,采用随机效应模型进行分析。
1.5 发表偏倚评估
分别以纳入分析的客观缓解率、6个月生存率、1年生存率、3级及以上血液和非血液系统不良反应发生率的OR值作为横坐标,以SE(log[OR])作为纵坐标绘制漏斗图,对数据分布的对称性进行观察,评价发表偏倚。
2 结果
2.1 检索结果
共检索出8篇符合要求的随机对照试验[11-18],共668例患者,其中346例患者接受BRT联合TMZ治疗(观察组),322例患者接受单纯BRT治疗(对照组)。(表1)
2.2 疗效分析
2.2.1 近期疗效的比较经筛选,共8篇文献报道了NSCLC脑转移患者的近期疗效[11-18]。共668例患者被纳入,其中,观察组患者的客观缓解率为58%(200/346),对照组患者的客观缓解率为43%(137/322)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.91,I2=0%)。采用固定效应模型进行Meta分析,结果显示,对照组和观察组患者的客观缓解率比较,差异有统计学意义(OR=2.24,95%CI:1.59~3.15,P<0.01)。(图1)
2.2.2 6个月生存率的比较经筛选,共8篇文献报道了NSCLC脑转移患者的6个月生存率[11-18]。共668例患者被纳入,其中,观察组患者的6个月生存率为71%(247/346),对照组患者的6个月生存率为54%(173/322)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.06,I2=48%)。采用固定效应模型进行Meta分析,结果显示,对照组和观察组患者的6个月生存率比较,差异有统计学意义(OR=2.46,95%CI:1.74~3.47,P<0.01)。(图2)
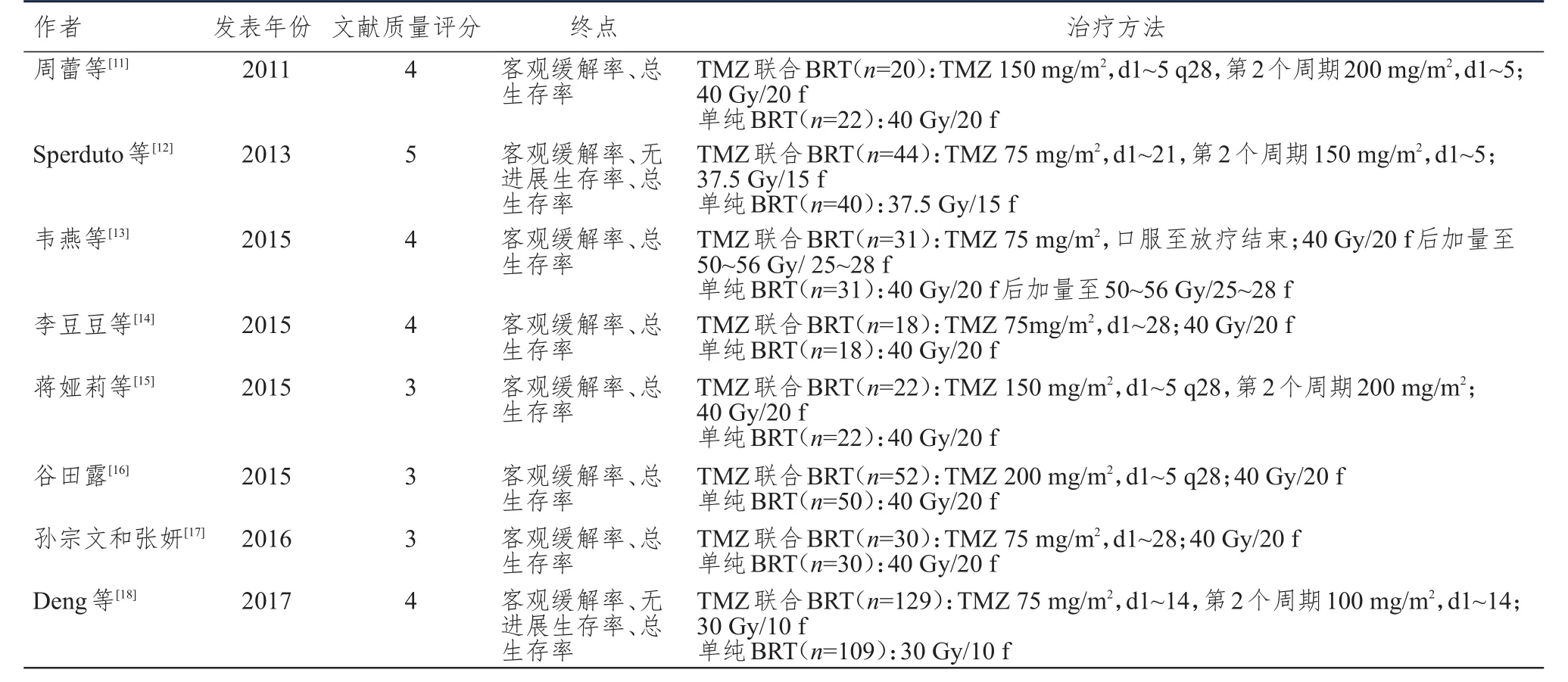
表1 文献检索结果

图1 观察组和对照组患者客观缓解率的Meta分析结果
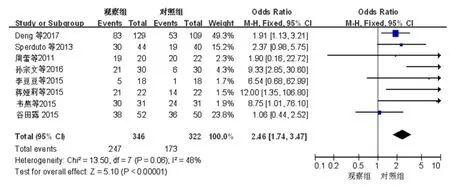
图2 观察组和对照组患者 6个月生存率的Meta分析结果
2.2.3 1年生存率的比较经筛选,共7篇文献报道了NSCLC脑转移患者的1年生存率[11-13,15-18]。共632例患者被纳入,其中观察组患者的1年生存率为36%(118/328),对照组患者的1年生存率为22%(67/304)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.49,I2=0%)。采用固定效应模型进行Meta分析,结果显示,对照组和观察组患者的1年生存率比较,差异有统计学意义(OR=2.09,95%CI:1.45~3.01,P<0.01)。(图3)
2.2.4 2年生存率的比较经筛选,共2篇文献报道了NSCLC脑转移患者的2年生存率[12,18]。共纳入322例患者,观察组患者的2年生存率为6%(11/173),对照组患者的2年生存率为9%(13/149)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.46,I2=0%),采用固定效应模型进行Meta分析,结果显示,对照组和观察组患者的2年生存率比较,差异无统计学意义(OR=0.71,95%CI:0.29~1.73,P=0.45)。(图4)
2.3 不良反应分析
2.3.1 3级及以上血液系统不良反应发生率的比较共8篇文献报道了NSCLC脑转移患者3级及以上血液系统不良反应[11-18],主要为白细胞减少、血小板减少、贫血。共668例患者被纳入,观察组和对照组患者3级及以上血液系统不良反应发生率分别为12%(41/346)和7%(23/322)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.58,I2=0%)。采用固定效应模型进行Meta分析,结果显示,对照组和观察组患者3级及以上血液系统不良反应发生率比较,差异无统计学意义(OR=1.71,95%CI:1.01~2.89,P=0.05)。(图5)
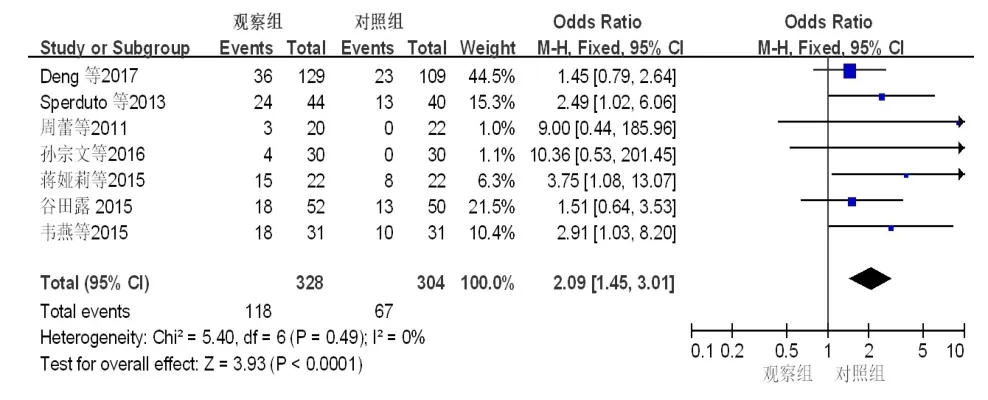
图3 观察组和对照组患者 1年生存率的Meta分析结果

图4 观察组和对照组患者 2年生存率的Meta分析结果
图5 观察组和对照组患者 3级及以上血液系统不良反发生率的Meta分析结果
2.3.2 3级及以上非血液系统不良反应发生率的比较共7篇文献报道了NSCLC脑转移患者3级及以上非血液系统不良反应[11-15,17-18],主要包括恶心、呕吐、乏力、腹泻、脱发、眩晕、头痛等。共566例患者被纳入,观察组和对照组3级及以上非血液系统不良反应发生率分别19%(56/294)和13%(35/272)。异质性分析结果显示,所有被纳入的患者在异质性方面无显著性差异(P=0.57,I2=0%)。采用固定效应模型进行Meta分析,结果显示,观察组与对照组患者3级及以上非血液系统不良发生率比较,差异无统计学意义(OR=1.54,95%CI:0.97~2.44,P=0.07)。(图6)

图6 观察组和对照组患者 3级及以上非血液系统不良反应发生率的Meta分析结果
2.4 发表偏倚
将所纳入的文献通过绘制漏斗图可见,散点分布在直线两侧,并靠近漏斗中部,对称性尚可(图7)。所纳入的文献在客观缓解率、6个月生存率、1年生存率、2年生存率及3级及以上血液和非血液系统不良反应方面存在发表偏倚的可能性较小。

图7 观察组与对照组患者的客观缓解率漏斗图
3 讨论
研究显示,对NSCLC脑转移患者给予BRT联合TMZ治疗和单纯BRT治疗,患者的中位生存期分别为8.6个月和7.0个月[19]。本研究中,NSCLC脑转移患者的2年生存率极低,故本研究未对2年以上生存率进行系统分析评价。
BRT联合TMZ和单纯BRT治疗NSCLC脑转移患者的近期疗效和远期生存情况尚存在争论。Zhao等[19]研究结果显示,对于NSCLC脑转移患者,WBRT+TMZ的近期疗效优于单纯WBRT,但无进展生存期和总生存期比较,差异均无统计学意义(P>0.05)。Bai等[20]的系统性分析结果显示,对于脑转移患者,WBRT联合TMZ治疗的客观缓解率高于单纯WBRT治疗,总生存期长于单纯WBRT治疗。另有随机临床试验结果表明,接受TMZ联合WBRT治疗的乳腺癌脑转移患者的客观缓解率高于接受单纯WBRT治疗的患者,但客观缓解率的增加并未转化为无进展生存期和总生存期的延长,且伴随着不良反应的增加,接受TMZ联合WBRT治疗后,生存期>12个月的患者非常少,说明联合治疗使患者生存期获益较少[21]。
本研究分析表明,观察组患者的客观缓解率、6个月生存率和1年生存率均明显高于对照组患者(P<0.01)。经过分析发现,其原因可能如下:①作为一种小分子脂溶性物质,TMZ的生物利用度较高,口服后能够快速吸收,而且容易穿透体内的血脑屏障。一般情况下,TMZ在患者脑组织及脑脊液中的浓度是血浆中的30%~40%。TMZ在神经系统中具有较高的杀灭肿瘤的作用;②TMZ联合BRT具有一定的协同作用。主要表现在前者能够破坏患者的血脑屏障,导致进一步开放血脑屏障,使得TMZ更容易通过血脑屏障,进入中枢神经系统,增强抗肿瘤效果。两组患者的3级及以上血液和非血液系统不良反应发生率比较,差异均无统计学意义,有待于更多随机临床试验验证。
本研究纳入的8篇文献不仅在放射剂量方面存在一定的差异,且TMZ用量及放疗的分割方式均存在一定的差异。由此可知,对于NSCLC脑转移,目前并没有一套标准的治疗模式。有研究表明3 Gy/f的放射剂量较2 Gy/f更为常见[22]。本研究纳入的文献大多采用40 Gy/20 f或30 Gy/10 f的治疗模式。此外,本研究纳入的文献均显示TMZ的最适用药量为每天75~200 mg/m2,患者一般连续用药5天,28天为1个周期。但是,由于没有原始数据,本研究并未考虑TMZ和BRT剂量的亚组分析。
综上所述,与单纯BRT治疗相比,BRT联合TMZ治疗NSCLC脑转移患者的客观缓解率、6个月生存率、1年生存率均较高,但2年生存率未见明显增加,且3级及以上血液系统和非血液系统不良反应发生率在一定程度上升高。因此,BRT联合TMZ治疗NSCLC脑转移的效果还有待进一步深入研究。
