血清炎症因子水平与慢性阻塞性肺疾病严重程度的相关性
2019-10-18林冠旭
林冠旭,李 翠
(琼海市人民医院急诊科,海南 琼海 571400)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)为气流受限不完全可逆疾病,临床可导致患者出现肺脏损伤,另外易导致肺外(全身)的不良效应,如抑郁、心血管疾病、骨质疏松症、代谢综合征、肌肉骨骼功能异常等并发症。COPD患者支气管壁组织内存在以中性粒细胞和淋巴细胞为主的浸润细胞,在急性发作时,炎症细胞病理性增多,可进展成化脓性炎症,造成黏膜充血,水肿、变性与坏死等,进而上皮细胞增生,造成气道壁的组织损伤- 修复过程反复循环发生,并最终造成细支气管壁变厚,气道壁结构重建。患者一般为进行性发展,受损肺脏对有害气体与气体颗粒等吸入物反应强烈,如有害气体、职业粉尘及污染等[1]。目前关于COPD发病因素的研究显示,炎症细胞特异性表达与患者病情发生、进展存在相关性[2]。Celli等[3]于2004年提出体重气流呼吸运动综合指数(body- mass,airflow obstruction,dyspnea,exercise capacity index,BODE)对COPD患者病情及预后测评有较好的临床参考价值。相关研究显示,BODE与COPD患者痰培养阳性率、急性发作次数、住院时长、急性发作时长等呈正相关,说明BODE对COPD患者病情程度有预测作用[4]。慢性阻塞性肺疾病的全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)评估COPD分为4级,分别为A、B、C、D级,综合评估患者合并症、症状、急性加重风险及肺功能[5]。本研究主要探究炎症因子水平与COPD患者病情程度的相关性,现报道如下。
1 资料与方法
1.1一般资料 选取2017年2月至2019年2月琼海市人民医院急诊科收治的COPD稳定期患者114例为研究对象,其中男64例、女50例,年龄52~78岁,平均(64±8)岁。均符合2013年中华医学会呼吸病学分会所编写COPD诊治指南[6],COPD患者于稳定情况下(既往6周内无任何情况住院或者急性加重)评估气流受限为舒张药吸入支气管后第1秒用力呼气量所占用力肺活量(fored expiratory volume in first second/forced vital capacity,FEV1/FVC%)低于70%;排除活动性肺结核、支气管扩张和其他限制性肺通气受限者,合并恶性肿瘤、肝脏、肾脏及心脏等慢性疾患者,无法沟通交流者。选取同期健康体检者100名作为对照组,其中男58例、女42例,年龄53~76岁,平均(64±7)岁。两组受试者性别、年龄比较差异无统计学意义(P>0.05)。本研究经琼海市人民医院伦理委员会批准,患者或家属均签署了知情同意书。
1.2方法
1.2.1BODE评估 ①体质指数(body- mass index,B),BMI≤21 kg/m2计1分,BMI>21 kg/m2计0分;②气流阻塞程度(degree airflow obstruction,O),检测前24 h内禁止使用支气管舒张剂,患者吸入400 g沙丁胺醇后20 min,采用肺功能仪检测FEV1/FVC%,≤35%计3分,36%~49%计2分,50%~64%计1分,≥65%计0分;③呼吸困难(dyspnea,D),使用呼吸困难量表(modified medical research council scale,MMRC)检测,除剧烈均匀外,无显著呼吸困难为0级(0分),上缓坡或快走出现气短为1级(0分),平地上以自己速度行走需停下呼吸,或比同龄人步行速度慢为2级(1分),平地步行数分钟或100 m需停下呼吸为3级(2分),穿脱衣时气短,或者呼吸困难无法离开房屋为4级(分);④运动能力(exercise capacity,E),依据“6 min步行试验”,6 min步行距离≤149 m计3分,150~249 m计2分,250~349 m计1分,≥350 m计0分。BODE分级:0~2分为1级,3~4分为2级,5~6分为3级,7~10分为4级[7]。急性加重标准:患者症状包含痰量增加、咳嗽、气促加重,且持续2 d以上。
1.2.2GOLD分级 依据GOLD分级指南(2015年版)[8]进行分级,患者症状较轻,1年内无急性加重入院,MMRC评分为0~1分,或者慢性阻塞性肺疾病评估量表(chronic obstructive pulmonary disease assessment test,CAT)评分低于10分,判定为A级;患者症状较重,1年内无急性加重入院,MMRC评分≥2分,或CAT评分≥10,判定为B级;患者症状较轻,1年内由于急性加重入院1次及以上,MMRC评分为0~1分,或CAT评分低于10分,判定为C级;患者症状较重,1年内由于急性加重入院1次及以上,MMRC评分≥2分,或者CAT评分≥10,判定为D级。
1.2.3血清炎症因子水平检测 采集COPD患者和对照组空腹静脉血6 mL,采用酶联免疫吸附测定法检测血清白三烯B4(leukotriene B4,LTB4)、肿瘤坏死因子- α(tumor necrosis factor- α,TNF- α)、白细胞介素- 8(interleukin- 8,IL- 8)及IL- 17水平,试剂盒均购自上海酶联生物科技有限公司,具体步骤依据试剂盒说明书进行。
2 结 果
2.1COPD患者GOLD分级与BODE分级的相关性 114例COPD患者行BODE分级,BODE 1级15例,BODE 2级19例,BODE 3级35例,BODE 4级45例;经GOLD分级A级9例,B级24例,C级45例,D级36例。Spearman相关分析结果显示,GLOD分级与BODE分级呈正相关(r=0.812,P=0.005),见表1。
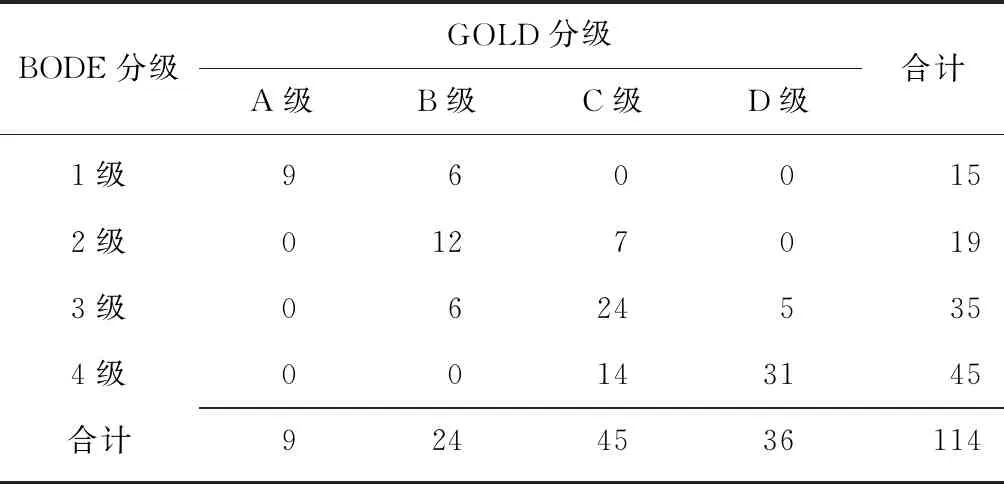
表1 COPD患者GOLD分级与BODE分级的相关性 (例)
COPD:慢性阻塞性肺疾病;BODE:体重气流呼吸运动综合指数;GOLD:慢性阻塞性肺疾病的全球倡议
2.2COPD患者不同BODE分级和对照组BODE得分及血清炎症因子水平比较 COPD患者不同BODE分级和对照组BODE得分及血清LTB4、TNF- α、IL- 8及IL- 17水平比较差异有统计学意义(P<0.05),不同BODE分级患者血清LTB4、TNF- α、IL- 8及IL- 17水平高于对照组,随着患者BODE分级升高,其血清炎症因子水平逐渐升高(P<0.05)。见表2。
2.3血清炎症因子与COPD患者严重程度的相关性 Spearman相关分析结果显示,不同分级COPD患者BODE、血清LTB4、TNF- α、IL- 8及IL- 17水平与病情严重程度呈正相关(r=0.640,P=0.001;r=0.935,P=0.003;r=0.885,P=0.006;r=0.770,P=0.008;r=0.761,P=0.007)。
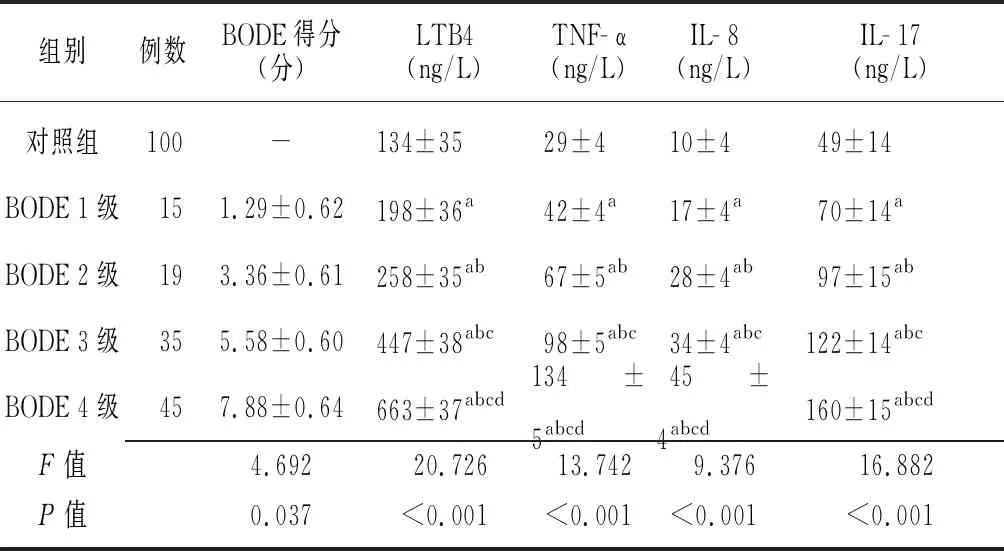
组别例数BODE得分(分)LTB4(ng/L)TNF-α(ng/L)IL-8(ng/L)IL-17(ng/L)对照组100-134±3529±410±449±14BODE 1级151.29±0.62198±36a42±4a17±4a70±14aBODE 2级193.36±0.61258±35ab67±5ab28±4ab97±15abBODE 3级355.58±0.60447±38abc98±5abc34±4abc122±14abcBODE 4级457.88±0.64663±37abcd134±5abcd45±4abcd160±15abcdF值4.69220.72613.7429.37616.882P值0.037<0.001<0.001<0.001<0.001
COPD:慢性阻塞性肺疾病;BODE:体重气流呼吸运动综合指数;LTB4:白三烯B4;TNF- α:肿瘤坏死因子- α;IL:白细胞介素;GOLD:慢性阻塞性肺疾病的全球倡议;a与对照组比较,P<0.05;b与BODE 1级比较,P<0.05;c与BODE 2级比较,P<0.05;d与BODE 3级比较,P<0.05
3 讨 论
当前临床多依据2013年中华医学会呼吸病学分会慢性阻塞性肺疾病学组所编纂的慢性阻塞性肺疾病诊治指南,参考支气管舒张试验后FEV1占预计值百分比标准对COPD患者的严重程度进行评估,近年来相关研究显示,FEV1占预计值百分比仅为单纯气流受限指标,并不能准确地预测患者病死率和呼吸困难程度等[9]。因此,单一采用FEV1占预计值百分比评估COPD患者严重程度和预后有局限性,无法全面地反映患者疾病发展状况,同时GOLD综合诊断和评估办法较复杂,包含合并症评估、COPD评估测试问卷、COPD急性加重评估、肺功能评估和COPD控制问卷等,临床操作困难,且多为患者主观判断,无法作为客观评估指标。GOLD分级为2011年提出评估COPD患者的新概念,以期对患者起到更好的指导作用与疾病治疗效果,BODE也是综合的评估系统,涉及患者多方面的参数[10]。本研究结果显示,COPD患者GOLD分级与BODE呈正相关,说明BODE评估患者病情也是一个较好的指标,适合在临床应用。国外有研究显示,采用BODE对COPD患者病情、预后、肺移植、肺减容术效果和患者生活质量评估效果优于其他评分系统[11]。
目前关于COPD的发病机制尚未完全明确,有研究显示[12],临床COPD患者肺部有炎症细胞活化,进而将更多炎症细胞因子释放,上述炎症因子还可调控、趋化中性粒细胞,进而导致气道内存在激活的中性粒细胞,影响气道炎症的发展,并最终造成机体肺血管、肺实质与气道等部位出现慢性炎症,LTB4、IL- 8、IL- 17及TNF- α等炎症因子参与COPD病情发展。TNF- α为单核- 巨噬细胞所形成的单核因子,为机体内主要免疫反应与炎症反应的介质,与感染联系紧密,可局部杀伤、浸润、吞噬病原体及诱引中性粒细胞趋化的影响,从而启动炎症反应。TNF- α有多种功能,可激活中性粒细胞、巨噬细胞,造成中性粒细胞分解IL- 8,使患者血清内IL- 8水平升高,IL- 8为细胞趋化因子的主要成员,为炎性疾病的主要介质之一,可使中性粒细胞趋化、活化[13- 15]。中性粒细胞被IL- 8、TNF- α激活后还能使细胞内外的蛋白分解功能加强,导致肺气肿。IL- 17为T细胞所诱导的炎症反应前期的启动因子,是由T细胞所形成的一种前炎症细胞因子,同时也是一种炎症反应的微调因子,不仅可在呼吸道内诱导并活化中性粒细胞募集,还可诱导形成IL- 8、TNF- α等细胞因子,使中性粒细胞的趋化、活化进一步加重。IL- 17可加强肺部弹性蛋白活性,通过增加气道内分泌物参与COPD发病进程。LTB4为当前已知的最强细胞趋化剂,可使中性粒细胞趋化并活化,至机体炎症部位导致更多炎症介质释放,使局部的炎症反应扩大。巨噬细胞作为COPD气道重建与气道炎症反应的靶细胞,可加速小气道内炎症反应。巨噬细胞能够形成LTB4,而LTB4可增加毛细血管的通透性,加大气道阻力,使支气管平滑肌收缩,进而造成渗出的水分与蛋白质增加,导致气道黏膜水肿[16- 20]。本研究结果显示,不同BODE分级患者血清LTB4、TNF- α、IL- 8及IL- 17较对照组升高,伴随患者BODE分级升高各血清炎症因子水平逐渐上升,BODE与血清LTB4、TNF- α、IL- 8及IL- 17呈正相关,说明COPD患者病情和血清炎症因子水平联系密切,能作为评估患者病情的生物学指标。但炎症细胞因子容易受到机体其他疾病影响,当前在临床应用还较为困难。生物学指标为COPD研究的新方向,可经分子生物学、动物实验等进一步分析其相关机制,为临床COPD患者的治疗提供新思路。
综上所述,临床COPD患者血清炎症因子水平与疾病严重程度呈正相关,检测血清炎症因子水平有利于评估患者病情并指导治疗。
