碳包覆磁性Fe3O4的制备及其对废水中铀的吸附行为研究
2019-10-18刘付平
张 雨,花 榕,李 阳,任 鹏,刘付平,孔 杰
(东华理工大学核资源与环境国家重点实验室,江西南昌 330013)
核能利用及铀矿开采过程中会产生大量含铀废水。由于铀具有天然化学毒性和长期放射性,其对环境的污染问题越来越受到关注[1-4]。研制新型高效吸附材料并用于从含铀废水中去除放射性铀一直都是科研工作者关注的重点[5-6]。近几十年来,已合成许多吸附材料,如磁性吸附材料[7]、氧化石墨烯复合材料[8]、Fe(OH)3胶体[9]等,但对于浓度低、体积大、背景本底离子多且复杂的放射性含铀废水来说,可用的吸附材料依然很少。
纳米碳包覆磁性材料具有纳米材料的高比表面积和磁性等优点,因此这一类材料具有良好的吸附性能和运用磁场的便捷收集功能[10-11],如用于吸附Cr(Ⅵ)[12]、U(Ⅵ)[13],都有较好的效果。试验采用水热合成法制备改性碳包覆纳米磁流体,并用以吸附分离放射性废液中的铀酰离子,以期为含放射性核素的废水治理提供新型复合材料。
1 试验部分
1.1 仪器与试剂
仪器:PHS-3C型酸度计,上海精密科学仪器有限公司;SP-721E型紫外-可见分光光度计,上海光谱仪器公司;DF-101S型磁力搅拌器,巩义市予华仪器有限公司;FTS-65A型红外光谱仪,美国Bio-RAD公司;Nova Nano 450型扫描电镜,荷兰FEI公司;PMX 400型Zeta电位仪,美国Microtrac公司。
试剂:硝酸铀酰;蔗糖(上海泰坦);双氧水,硝酸(国药集团);氢氧化钠(西陇化工);2,4-二硝基苯酚(三爱司化学试剂);氯乙酸(成都西亚);偶氮胂Ⅲ(格雷西亚);乙酸钠,碳酸氢钠,硝酸钙(阿拉丁)。上述试剂均为分析纯。水为去离子水。
1.2 复合材料的制备
1.2.1 四氧化三铁粉体的制备
制备纳米四氧化三铁微粒的反应式为

将2.76 g FeCl3·6H2O和1.00 g FeCl2·4H2O按n(Fe3+)/n(Fe2+)=2.0溶于100 mL去离子水中,转入250 mL磨口三颈烧瓶中,在氮气保护下高速搅拌,快速加入20 mL浓氨水,反应30 min后,升温至60 ℃继续搅拌30 min[14-15],用永磁铁沉降后弃去上层清液,所得黑色颗粒转入高压反应釜中于150 ℃下加热反应4 h,反应产物用蒸馏水洗涤,离心机分离,弃去上层清液后重复洗涤,直至上清液pH为7左右。取出黑色粉末,干燥、研磨,得到黑色四氧化三铁纳米粉体[16]。
1.2.2 改性碳包覆磁性Fe3O4颗粒复合材料(Fe3O4@HTC-NaOH)的制备
1)碳包覆磁性基体材料的制备:称取0.4 g磁性Fe3O4颗粒置于100 mL烧杯内,加6.67 g蔗糖、50 mL去离子水,超声振荡30 min确保磁性颗粒在水中完全分散后,转至高压反应釜内,在180 ℃下反应16 h。固液分离后对固体洗涤、烘干,获得碳包覆磁性Fe3O4颗粒(Fe3O4@HTC)。
2)改性碳包覆磁性Fe3O4颗粒复合材料的制备:称取0.2 g Fe3O4@HTC于100 mL三口烧瓶内,加50 mL浓度为1 mol/L氢氧化钠溶液,100 ℃下回流反应4 h。反应所得固体集产物即为改性碳包覆磁性Fe3O4颗粒复合材料(Fe3O4@HTC-NaOH),所获材料表面含有丰富吸附位点。
1.3 复合材料对U(Ⅵ)的吸附
称取0.01 g复合材料Fe3O4@HTC-NaOH投于250 mL锥形瓶中,加入50 mL铀标准溶液,用1 mol/L盐酸溶液和3 mol/L氢氧化钠溶液调pH,在振荡器中振荡、静置。移取2 mL上清液,用偶氮胂Ⅲ分光光度法,在波长λ=652 nm处测定吸光度,根据工作曲线计算吸附后溶液铀质量浓度,计算铀吸附量。计算公式为
(1)
式中:q为铀吸附量,mg/g;ρ0、ρe为吸附前、后溶液中铀质量浓度,mg/L;V为铀溶液体积,mL;m为复合材料质量,g。
2 试验结果与讨论
2.1 材料的微观结构表征
通过TEM、FT-IR和Zeta-电位等对碳包覆磁性基体材料改性前、后的微观结构、官能团组成及表面电负性进行表征。结果如图1~3所示。

a—Fe3O4@HTC;b—Fe3O4@HTC-NaOH。
由图1看出:基体材料具有规整的球形外貌,中心为Fe3O4磁性颗粒,外部包裹一层碳外壳,形成鲜明的核-壳结构;用氢氧化钠改性处理后,核-壳结构未被破坏,仅颗粒之间的距离有所增大,比表面积有所增加,但原有磁性依然保持。
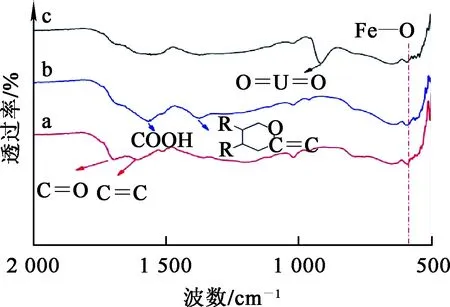
a—Fe3O4@HTC;b—Fe3O4@HTC-NaOH;c—Fe3O4@HTC-U。
由图2看出:在580 cm-1附近出现了明显的Fe—O振动峰,表明复合材料中含有Fe3O4;曲线a中1 725、1 620 cm-1处的2个峰分别是C=O键和C=C键的伸缩振动峰,说明在水热条件下蔗糖发生了碳化;曲线b中1 595、1 410 cm-1附近出现了—COOH和内酯的振动峰,说明氢氧化钠可丰富碳表面的含氧官能团,而这些官能团将在吸附过程中与铀酰离子形成氢键,有利于吸附铀酰离子;吸附铀之后(曲线c),在917 cm-1处出现了很强的O=U=O伸缩振动峰,同时1 595、1 410 cm-1处的峰减弱,表明溶液中的铀与复合材料中的羧基和内酯以配位成键形式被吸附。
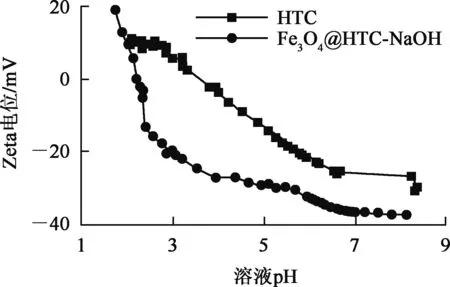
图3 不同溶液pH条件下材料的Zeta电位对比
由图3看出:Fe3O4@HTC-NaOH在溶液pH为5~8之间带有很多的负电荷,Zeta电位绝对值较高,体系比较稳定;HTC与Fe3O4@HTC-NaOH分别在溶液pH为3.6和2.2附近出现等电点,由于Fe3O4@HTC-NaOH表面含有丰富的—COOH官能团,在溶液中易电离出H+,留下带负电的表面,故等电点较HTC左移,且电位绝对值变大,可以判断,复合材料拥有HTC的吸附功能,在一定程度上提高了材料的分散能力。
2.2 复合材料对U(Ⅵ)的吸附
2.2.1 溶液pH的影响
在25 ℃条件下,称取Fe3O4@HTC-NaOH复合材料0.01 g,加入U(Ⅵ)质量浓度100 mg/L溶液50 mL,调节pH为3.0~6.5,恒温振荡5 h,复合材料对U(Ⅵ)的吸附试验结果如图4所示。
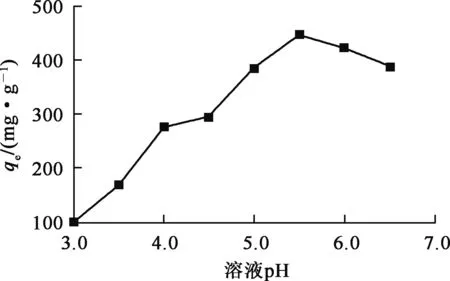
图4 溶液pH对复合材料吸附U(Ⅵ)的影响
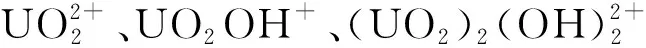
2.2.2 接触时间的影响
在25 ℃条件下,称取13份Fe3O4@HTC-NaOH复合材料,每份0.01 g,分别置于250 mL锥形瓶中,并分别加入pH=5.5、质量浓度100 mg/L的U(Ⅵ)溶液50 mL,考察吸附时间对U(Ⅵ)吸附量的影响,试验结果如图5所示。
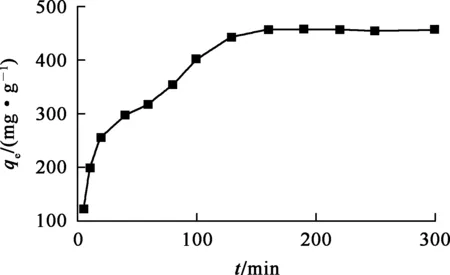
图5 吸附时间对复合材料吸附U(Ⅵ)的影响
由图5看出:随吸附时间延长,复合材料对U(Ⅵ)的吸附量逐渐提高;吸附200 min左右时,吸附量基本稳定,表明复合材料的吸附位点基本饱和,吸附达到平衡。由此确定,吸附时间以200 min为宜。
采用准一级和准二级动力学模型模拟吸附过程,其对应的表达式[20-21]为:
ln(qe-qt)=lnqe-k1t;
(2)
(3)
式中:qe、qt分别为吸附平衡和吸附t时间时复合材料对U(Ⅵ)的吸附量,mg/g;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g/(mg·min)。
准一级、准二级动力学方程拟合曲线如图6所示。可以看出:复合材料吸附U(Ⅵ)的过程更符合准二级动力学模型(相关系数r2=0.995),表明吸附过程以化学吸附为主,物理吸附为辅。
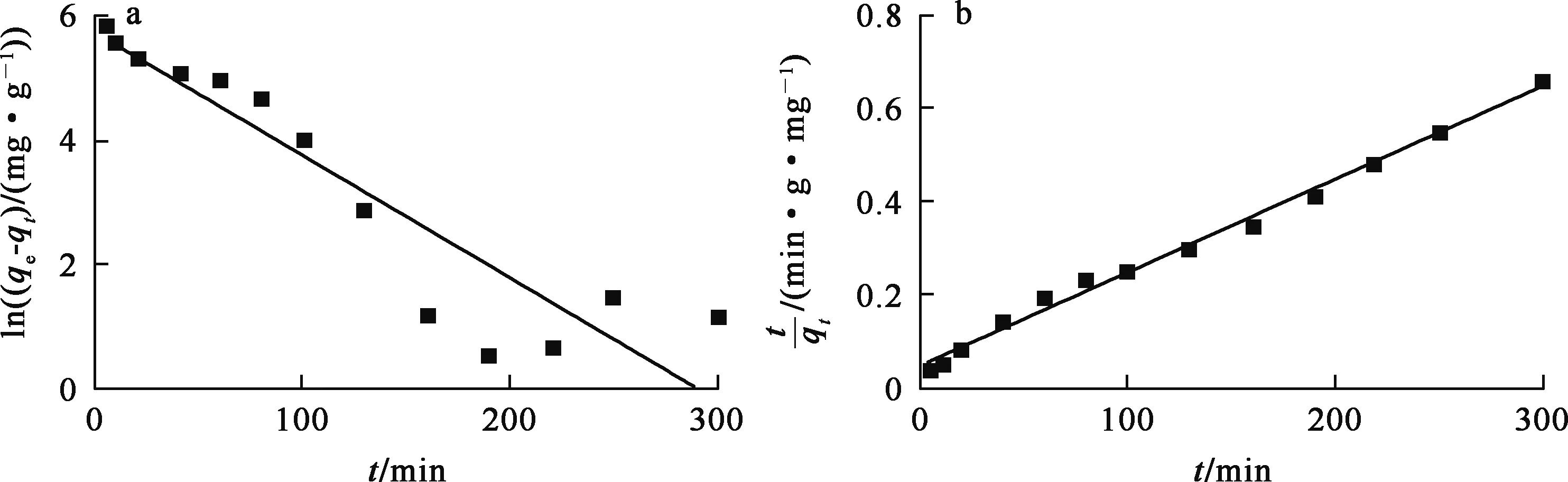
图6 准一级(a)和准二级(b)动力学模型拟合曲线
2.2.3 U(Ⅵ)初始质量浓度的影响
称取0.01 g复合材料14份于250 mL锥形瓶中,分别加入pH=5.5的不同U(Ⅵ)质量浓度的溶液100 mL,吸附200 min后测定上清液中U(Ⅵ)质量浓度,计算复合材料对U(Ⅵ)的吸附量,试验结果如图7所示。
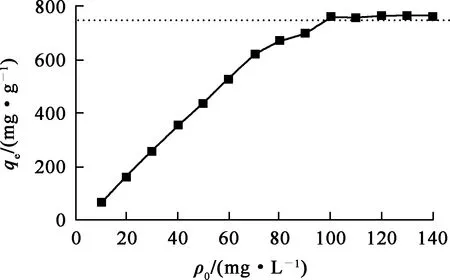
图7 U(Ⅵ)初始质量浓度对复合材料吸附U(Ⅵ)的影响
由图7看出,随U(Ⅵ)初始质量浓度升高,复合材料对U(Ⅵ)的吸附量提高,至U(Ⅵ)初始质量浓度为100 mg/L后趋于稳定,吸附达饱和。
采用Langmuir和Freundlich等温吸附模型对试验数据进行拟合[22-23]:
(4)
lnqe=lnkF+nlnρe。
(5)
式中:ρe为平衡时溶液中U(Ⅵ)质量浓度,mg/L;qe、qm为平衡时和最大U(Ⅵ)吸附量,mg/g;kL为Langmuir等温吸附常数,L/mg;kF为Freundlich等温吸附常数,L/g;n为吸附常数。
Lamgmuir和 Frendlich等温吸附模型拟合曲线如图8所示,可以看出:复合材料对U(Ⅵ)的吸附过程更符合Langmuir等温吸附模型(相关系数r2=0.997),由此计算得到理论U(Ⅵ)吸附量为813.01 mg/g,与试验结果762.43 mg/g相接近,表明吸附过程属于单分子层吸附。
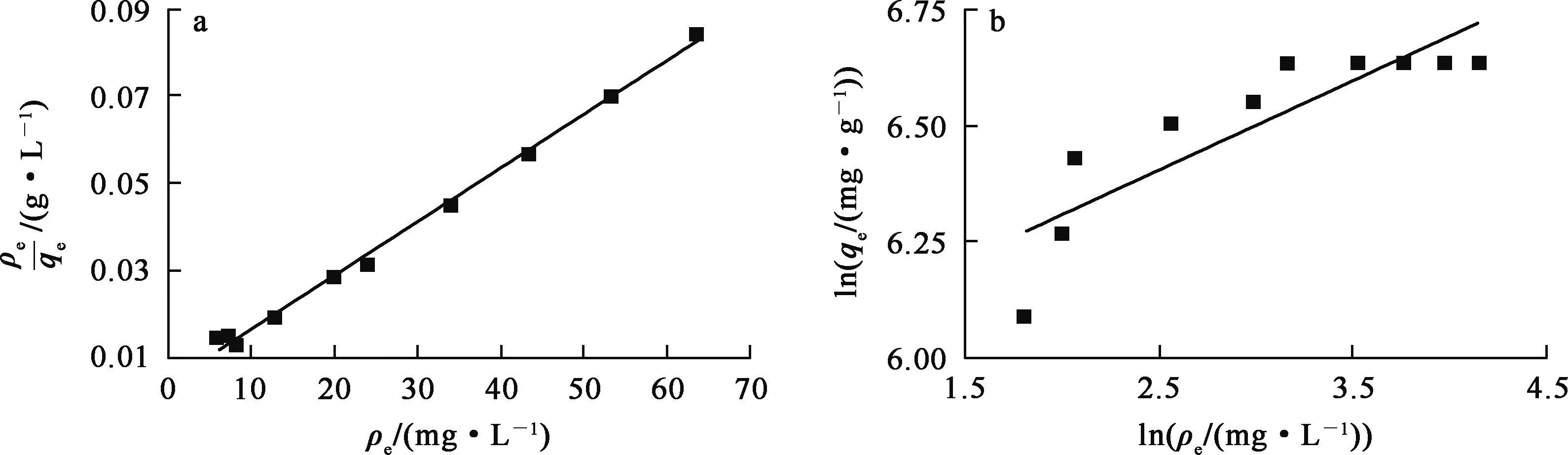
图8 Lamgmuir(a)和 Frendlich(b)等温吸附模型拟合曲线
2.2.4 温度的影响
取复合材料0.01 g,加入pH=5.5、U(Ⅵ)质量浓度100 mg/L的溶液100 mL于250 mL锥形瓶中,吸附时间控制在200 min,温度对复合材料吸附U(Ⅵ)的影响试验结果如图9所示。可以看出,随温度升高,复合材料对U(Ⅵ)的吸附量略有提高,表明吸附过程吸热,但温度影响并不大。综合考虑,吸附试验在室温下进行即可。热力学参数ΔG0、ΔH0和ΔS0计算结果见表1。可以看出,复合材料对U(Ⅵ)的吸附过程可自发进行。
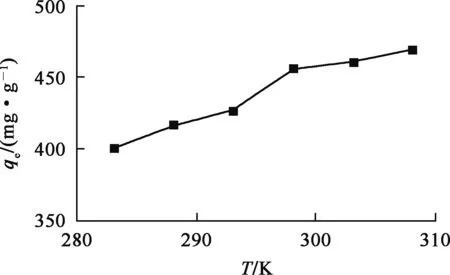
图9 温度对复合材料吸附U(Ⅵ)的影响
2.3 解吸与循环使用
将吸附饱和的复合材料分别用0.1、0.05、0.01 mol/L的Na2CO3溶液洗脱[24]。试验结果表明,最佳Na2CO3溶液浓度为0.1 mol/L,洗脱率达98.12%。用解吸后的复合材料进行吸附—解吸试验,重复5次,结果如图10所示。可以看出,5次吸附—解吸循环后,吸附量仍达饱和吸附量的77.43%,重复利用效果较好。
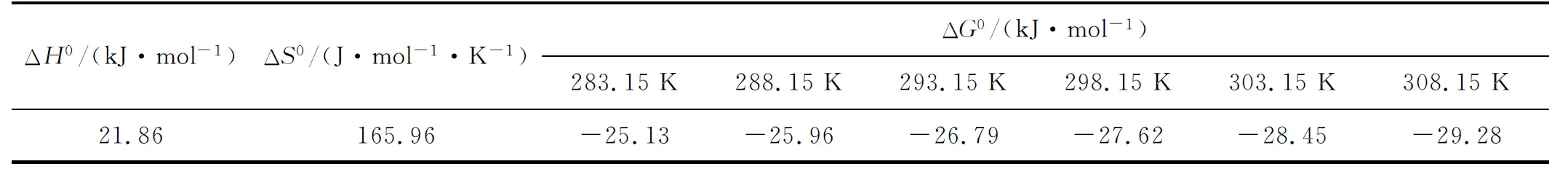
表1 热力学参数
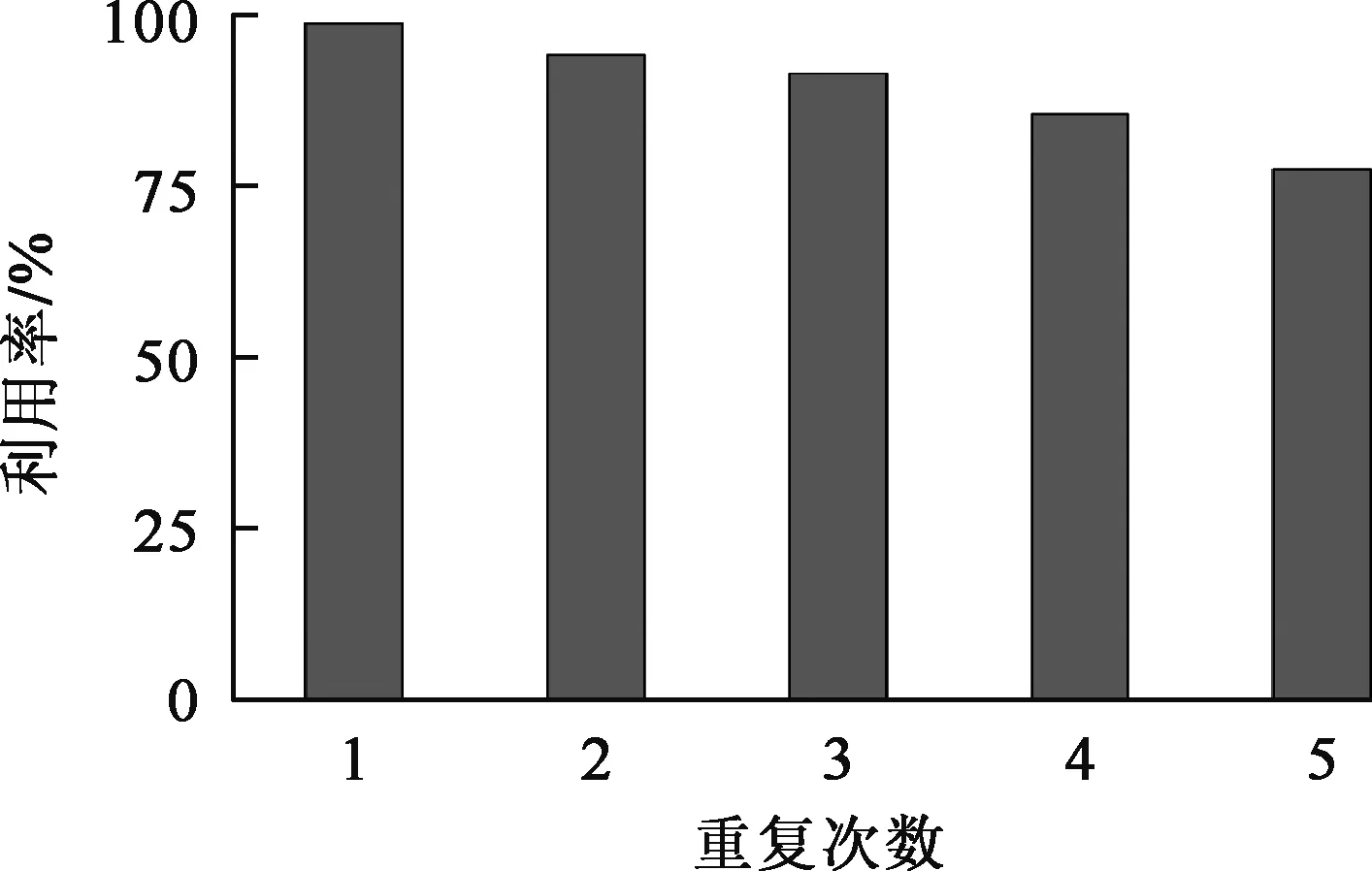
图10 复合材料重复利用效果
3 结论
采用水热法制备的纳米碳包覆磁性Fe3O4材料对环境废水中铀的吸附效果较好。室温下,对pH为5.5、质量浓度为100 mg/L的铀溶液吸附200 min,可以达到最佳吸附效果,最大吸附量为456.67 mg/g;吸附行为符合准二级动力学吸附模型及Langmuir等温吸附模型,理论吸附量为813.01 mg/g,吸附过程属于单分子层吸附。重复试验结果表明,该材料具有较强的循环再生性能。
Fe3O4@HTC-NaOH复合材料制备工艺简单,原料来源广泛,生产成本低廉,对溶液中铀的吸附效果较好,结合磁流体易收集特性,能够对浓度低、分布散、体积大、复杂基体的放射性含铀废水有较好的治理效果,具有较好的应用前景。
