甘蔗叶片光合CO2响应参数分析及其品种间差异*
2019-10-18刘杨杨刘少春同小娟余凌翔
刘杨杨,李 俊**,于 强,刘少春,同小娟,余凌翔
甘蔗叶片光合CO2响应参数分析及其品种间差异*
刘杨杨1,李 俊1**,于 强2,刘少春3,同小娟4,余凌翔5
(1.中国科学院大学地理科学与资源研究所陆地水循环及地表过程重点实验室,北京 100101;2.中国科学院水利部水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室,杨凌 712100;3.云南省农业科学院甘蔗研究所,开远 661600;4.北京林业大学林学院,北京 100083;5.云南省气候中心,昆明 650034)
甘蔗光合作用的CO2响应是甘蔗生理生态研究的重要内容。作为C4植物的甘蔗具有较高的光合效率,是最重要的糖料作物。为比较不同模型拟合甘蔗CO2响应曲线的效果,分析不同品种甘蔗光合CO2响应特性,探究甘蔗光合CO2响应参数之间的关系,本文使用LI-6400XT光合测定系统在云南开远进行了田间观测,用直角双曲线模型(RH)、非直角双曲线模型(NRH)、叶子飘(Ye)模型拟合6个品种甘蔗光合CO2响应曲线,并分析光合CO2响应参数。结果表明:RH和NRH模型拟合的最大光合速率(Amax)偏差较大,且无法得到CO2饱和点(CSP)。NRH模型拟合的初始羧化速率(η)与实测值最为接近,但得到的呼吸速率(Rp)和CO2补偿点(CCP)均为负。综合来看叶子飘模型模拟甘蔗叶片光合CO2响应的效果最佳。Ye模型得到的光合CO2响应参数中,η与Rp/CCP呈极显著正相关(P<0.01),Rp与η、CCP呈显著正相关(P<0.05),Rp、η与CSP呈显著负相关(P<0.05)。有的品种在低CO2浓度时表现高光合特性,伴随高呼吸消耗,同时在高浓度CO2时光合能力较弱,易达到CO2饱和点。Ye模型得到的6个品种甘蔗的Amax平均值为32.4±4.5mmol·m−2·s−1,η平均值为0.128±0.060,CSP平均值为1152±77mmol·m−2·s−1,CCP平均值为8.5±5.5mmol·m−2·s−1。品种ROC22具有很低的Rp、CCP和最高的Amax,光合特性最好;除YZ99-91外其它5个品种甘蔗的CSP都较大,能适应大气中CO2浓度的升高。
甘蔗;光合CO2响应;叶子飘模型;品种;光合CO2参数
光合作用是植物将光能转换为生命活动所使用的化学能并合成有机物的生物物理化学过程,环境CO2浓度是影响植物光合作用的主要因素之一。光合速率随CO2浓度变化的特征可由光合CO2响应曲线描述。常见的光合CO2响应模型主要有Michaelis- Menten模型[1]、直角双曲线模型[2−3]、非直角双曲线模型[4−5]、二次多项式模型[6]、叶子飘模型[3,7−8]以及机理模型[9−10]。采用Michaelis-Menten模型、直角双曲线模型、非直角双曲线模型模拟光合CO2响应曲线时,无法给出CO2饱和点(CSP),所得最大光合速率(Amax)偏高[11−13],无法拟合出CO2浓度达到饱和状态与过饱和状态下植物光合能力受到制约的情况[14]。使用二项式模型拟合光合CO2响应曲线虽能得出CO2抑制现象和CSP,但存在拟合出的CO2补偿点(CCP)等参数误差较大甚至错误的情况。Yin等[10,15]在Farquhar生化模型基础上修改了C4植物光合CO2响应的机理模型,并给出该机理模型不能给出的光合CO2响应参数,如初始羧化效率(η)、Amax、CSP和CCP等,但存在曲线拟合度较差等问题。叶子飘模型[7]很好地解决了上述问题,可直接求算Amax和CSP,拟合效果好。越来越多的研究开始使用叶子飘模型拟合光合CO2响应曲线[16−17]。
IPCC第五次评估报告[18]指出,自1750年以来,大气中CO2浓度逐渐上升,至2011年大气中的CO2浓度为391μmol·mol−1,比工业革命前上升了40%。有研究提出,至本世纪末,大气CO2浓度预测将达到600~800μmol·mol−1[19]。大气中CO2浓度升高必然会对植物的光合作用产生影响。C3与C4作物的光合机理存在不同之处,相比于C3作物,C4作物具有更好的对低浓度CO2的利用能力,对于CO2浓度的升高反应相对不敏感[20]。
模型拟合出的光合CO2响应参数之间存在一定的关系。对大豆叶片CCP与光呼吸速率的关系研究发现,光呼吸速率与初始羧化速率的比值与CO2补偿点的值在同一方向上变化[21]。在叶子飘模型中,当CO2饱和系数(γ)保持不变,CO2抑制系数(b)越高越容易出现光抑制现象,CSP随之降低;当b保持不变,γ越高越容易达到光饱和点,CSP随之降低[22]。不同物种和不同环境条件下,植物光合CO2参数间的关系并不固定。
不同种类的植物光合特性不同。C4植物的最大净光合速率明显高于C3作物。同属C4作物的玉米最大净光合速率又高于甘蔗[23]。同一物种不同品种(或变种)的叶片光合CO2响应参数也有较大差异[24−25]。研究表明,不同品种的甘蔗Amax变化范围在19~39μmol·m−2·s−1[26]。品种的光合CO2特性影响作物的产量和品质。在进行作物生长模拟、作物育种和栽培管理时,必须充分考虑不同品种在光合特性上的差异。
甘蔗是生长在热带、亚热带地区的高光效C4植物,具有光呼吸速率低、光合效率高、产能高等特点[27−28]。甘蔗是最重要的糖料作物,同时还是轻工、化工和能源工业的重要原料。作物的光合作用是作物生长发育以及产量形成的基础[29−30]。目前未见对于C4作物甘蔗的光合CO2响应的研究,其对于CO2浓度升高的反应尚不明确。叶子飘模型可以很好地拟合C3植物和部分C4植物的光合CO2曲线,但尚未见到该模型用于甘蔗光合CO2响应模拟的报道。本研究探讨3种模型对甘蔗光合CO2曲线拟合的适用性,挑选最适的拟合模型,从而为品种光合CO2参数研究提供计算工具;同时探究甘蔗光合CO2参数之间的相关性,以期了解甘蔗光合的生理参数之间的变化规律,并以不同参数间的相关性为依据将甘蔗CO2参数进行分类分析,从而为甘蔗高产栽培提供理论依据;计算不同品种甘蔗的光合CO2响应生理特性,探究大气CO2浓度增加对不同品种甘蔗的生理生态影响,为筛选光合特性好的甘蔗品种提供依据。
1 资料与方法
1.1 研究地点概况
观测在云南省农业科学院甘蔗研究所(103°15′N,23°42′E,1055m)甘蔗试验田进行。位于云南省开远市,地处云南高原南部,红河州中部,属亚热带高原季风气候,具有夏长无冬、春秋相连、日温差大,干湿季明显、常年多干旱的气候特点。年平均降水740mm,年平均气温19.8℃,年日照时数2200h,全年无霜期340d。雨季集中在5−10月,雨热同期而无酷暑,年平均气温较稳定。试验地土壤有机质含量为20.5g·kg−1,全氮1.64g·kg−1,全磷0.67g·kg−1,全钾13.70g·kg−1,碱解氮80.79mg·kg−1,速效磷9.81mg·kg−1,速效钾112.78mg·kg−1,pH6.0。
根据不同品种甘蔗的种植面积、品种特性综合考虑,选择6个甘蔗品种进行试验:(1)新台糖22(ROC22),其综合性状好,在南方四省甘蔗主要种植区的种植面积最大;(2)云蔗99-91(YZ99-91),蔗糖含量高;(3)云蔗03-194(YZ03-194),强宿根、抗旱;(4)云蔗03-1413(YZ03-1413),为中晚熟品种;(5)桂糖02-467(GT02-467),品种植株高大,出苗、分蘖率高,有效茎多;(6)闽糖69-421(MT69-421),为试验地所在省份(云南)主栽品种之一。试验设18个小区(6品种´3重复),小区规格为6m´8m。甘蔗行距1m,种植密度为12000株·hm−2。小区外种有1~2行甘蔗作为保护带。
1.2 光合CO2响应曲线的测定
观测于2016年7月在甘蔗品种对比小区试验田进行。每天进行一个品种甘蔗的光合CO2响应测定,每个品种在3个小区各取一片叶片测定,每个品种共测得3组数据。各品种甘蔗均处于相同的生育期,观测时间跨度为8d。观测期间夜晚持续降雨、白天晴天光照充足。
在晴天的9:00-12:00时段用LI-6400XT型便携式光合测定系统(Li-Cor Inc.,USA)测定甘蔗叶片光合CO2响应曲线,每小区选择1棵代表性植株选其倒2叶或倒3叶测定。光合CO2响应作用进行时,生成的反应底物具有一定的滞后性,所以,观测时仪器控制的CO2浓度先从大气浓度(约400μmol·mol−1)降至50μmol·mol−1,再从大气浓度升至1500μmol·mol−1:共设置11个CO2梯度,依次为400、300、200、100、50、200、400、600、800、1000、1500μmol·mol−1。样品室固定光强设置为1200μmol·m−2·s−1。首先对叶片进行光强为1200μmol·mol−1、CO2浓度为400μmol·mol−1的光诱导,持续约15min,待仪器稳定后开始测定。测定时叶片位置保持在植株的原方位。每个CO2浓度的观测时长设为120~180s。
将测得的点用光滑曲线连接,取CO2浓度为0μmol·mol−1时的测量值作为呼吸速率(Rp)的实测值,取曲线与x轴交点的目测值作为CO2补偿点(CCP)的实测值,用直线拟合低CO2浓度下的响应曲线的斜率作为初始羧化速率(η)的实测值;使用二项式模型拟合光合CO2曲线,得到的最大净光合速率(Amax)以及CO2饱和点(CSP)作为实测值。
1.3 光合CO2响应模型
分别采用有生理意义的直角双曲线模型(RH)、非直角双曲线模型(NRH)和叶子飘模型(Ye)对甘蔗叶片的光合CO2响应曲线进行模拟。
(1)直角双曲线模型
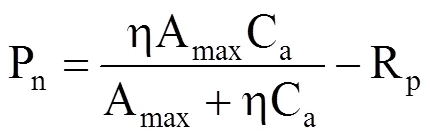
当Pn= 0时,得到CO2补偿点CCP为
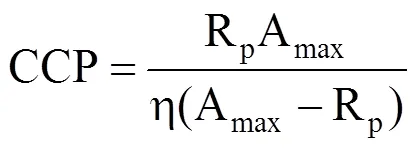
式中,Pn为净光合速率(μmol·m−2·s−1),Amax为CO2饱和时的最大净光合作用速率(μmol·m−2·s−1),η为初始羧化速率即CO2响应曲线的初始斜率,Ca为样品室内CO2浓度(μmol·mol−1),Rp为呼吸速率(μmol·m−2·s−1)。
(2)非直角双曲线模型
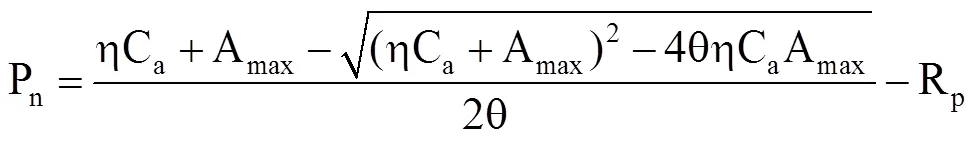
当Pn=0时,得到CO2补偿点CCP为
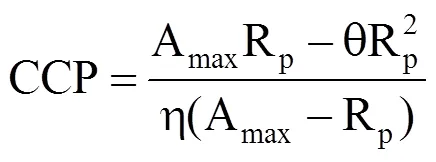
式中,θ是反应非直角双曲线弯曲程度的曲角参数,取值在0~1。当θ=0时即转化为直角双曲线;当θ=1时,即转化为Blackman曲线[31]。
(3)叶子飘模型
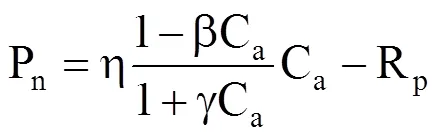
式中,b为CO2抑制系数,γ为CO2饱和系数。当β = 0时,CO2响应曲线没有极点,不存在CO2抑制,且令γ = η/Amax,则叶子飘模型退化为直角双曲线模型[22]。
当Pn=0时,得到CO2补偿点CCP为
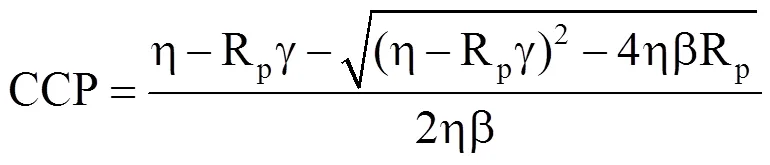
通过d(Pn)/d(Ca)=0,计算CO2饱和点CSP为
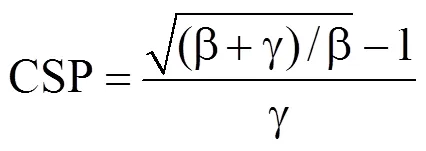
当Ca=CSP时
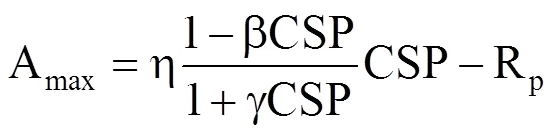
取同一品种3个重复的平均值作为比较不同模型拟合效果以及计算光合CO2参数相关性的数据;在不同品种间参数的方差分析中,使用同一品种的3个重复值分别作为拟合数据计算同一品种甘蔗的3组光合CO2参数从而进行方差分析。
选择模拟效果最好的光合CO2响应模型,采用一元一次线性回归法分析光合CO2响应参数之间的相互关系及显著性,对不同品种的各参数进行方差分析(ANOVA)。统计分析均采用SPSS13.0软件完成。
2 结果与分析
2.1 模拟甘蔗叶片CO2响应曲线的最适模型选择
3个模型对6个甘蔗品种CO2响应曲线的拟合结果见图1。由图可见,当CO2浓度在0~600μmol·mol−1范围内,6个品种甘蔗叶片的净光合速率Pn均随CO2浓度升高而快速增加;当CO2浓度超过600μmol·mol−1时,随着CO2浓度的升高,净光合速率升高缓慢并稳定在一定水平。6个品种甘蔗在试验设定的浓度梯度下均未出现CO2抑制现象。从模型的拟合度来看,非直角双曲线模型和叶子飘模型拟合不同品种CO2响应曲线时r2均大于0.99。
进一步对比各模型拟合曲线参数与实测值,结果见表1。由表可见,直角和非直角双曲线模型得到的Amax分别高于实测值33.8%~57.3%和2.7%~17.7%,叶子飘模型得到的Amax与实测值最相近,拟合效果最好。直角双曲线模型和叶子飘模型得到的η值与实测值的平均误差分别为194.5%与81.7%,非直角双曲线模型得到的η值与实测值的平均误差为6.6%,模拟效果最好。非直角双曲线模型拟合的6个品种甘蔗的Rp和CCP均为负值,不符合常理。叶子飘模型、直角双曲线模型拟合的Rp与实测值的平均误差分别为64.9%和137.5%,叶子飘模型拟合效果较好;叶子飘模型、直角双曲线模型拟合出的CCP与实测值的平均误差分别为65.7%和22.9%,直角双曲线模型拟合效果较好。直角和非直角双曲线模型无法给出CSP,叶子飘模型可以直接得到接近实测值的CSP。综上所述,叶子飘模型拟合的Amax值、Rp值最接近实测值,并可以直接得到与实测值相近的CSP,r2大于0.99,对甘蔗的光合CO2响应曲线拟合效果最好。
2.2 叶子飘模型拟合的甘蔗叶片光合CO2响应参数间的相互关系
通过研究甘蔗光合CO2响应参数之间的相关性,可以探究甘蔗光合参数间的联系及其原理,明确甘蔗光合过程中生理生态的变化机制,同时也可以依据参数间的关系将参数进行分类分析。采用叶子飘模型模拟甘蔗叶片光合CO2响应曲线,分析CO2响应参数之间的相互关系。光合CO2响应参数中,Rp反应了植物本身能量损耗速率;η反应了植物对较低浓度CO2的利用效率,η越高,说明植物叶片光合作用对低浓度CO2的同化能力越强;CCP是植物叶片的光合同化作用与呼吸消耗相同时CO2的浓度,反应了植物对低浓度CO2利用的能力,与反应植物对高浓度CO2利用范围的参数CSP同为植物利用CO2能力的重要指标。研究发现,甘蔗的Rp与η、CCP呈显著正相关(P<0.05),说明甘蔗对低浓度CO2的利用效率和利用能力与其消耗光合产物的速率呈正比,同时,Rp/CCP与η之间也存在极显著正相关关系(P<0.001)(图2)。Rp、η与CSP呈显著负相关(P<0.05),表明同时具有高CO2利用效率和高光合产物消耗速率的甘蔗品种,较易达到CO2饱和点,其对高浓度CO2利用能力较差。此外,研究还发现,η与g呈极显著正相关(P<0.01),Rp与g呈显著正相关(P<0.05),b与Amax、η、g,CSP与g均呈显著负相关(P<0.05),其它参数之间的相关性不明显(表2)。
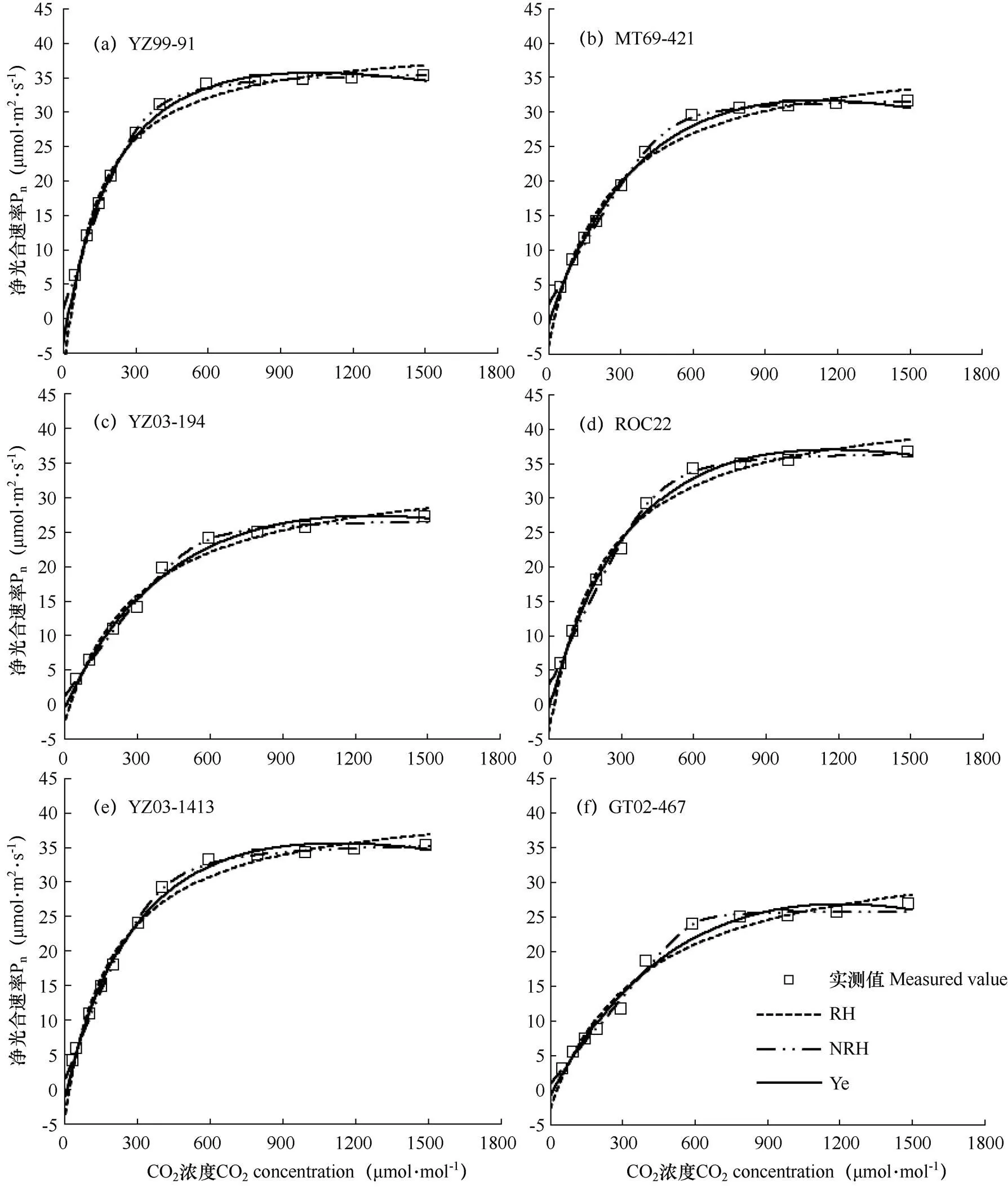
图1 三个模型对6个甘蔗品种叶片光合CO2响应曲线的拟合结果
注:RH为直角双曲线模型;NRH为非直角双曲线模型;Ye为叶子飘模型。下同。
Note:RH is rectangular hyperbola model, NRH is nonrectangular hyperbola model, Ye is Ye model. The same as below.
表1 不同模型拟合的6个甘蔗品种叶片光合CO2响应参数
Table 1 Photosynthetic CO2response parameters of six sugarcane varieties fitted by different models
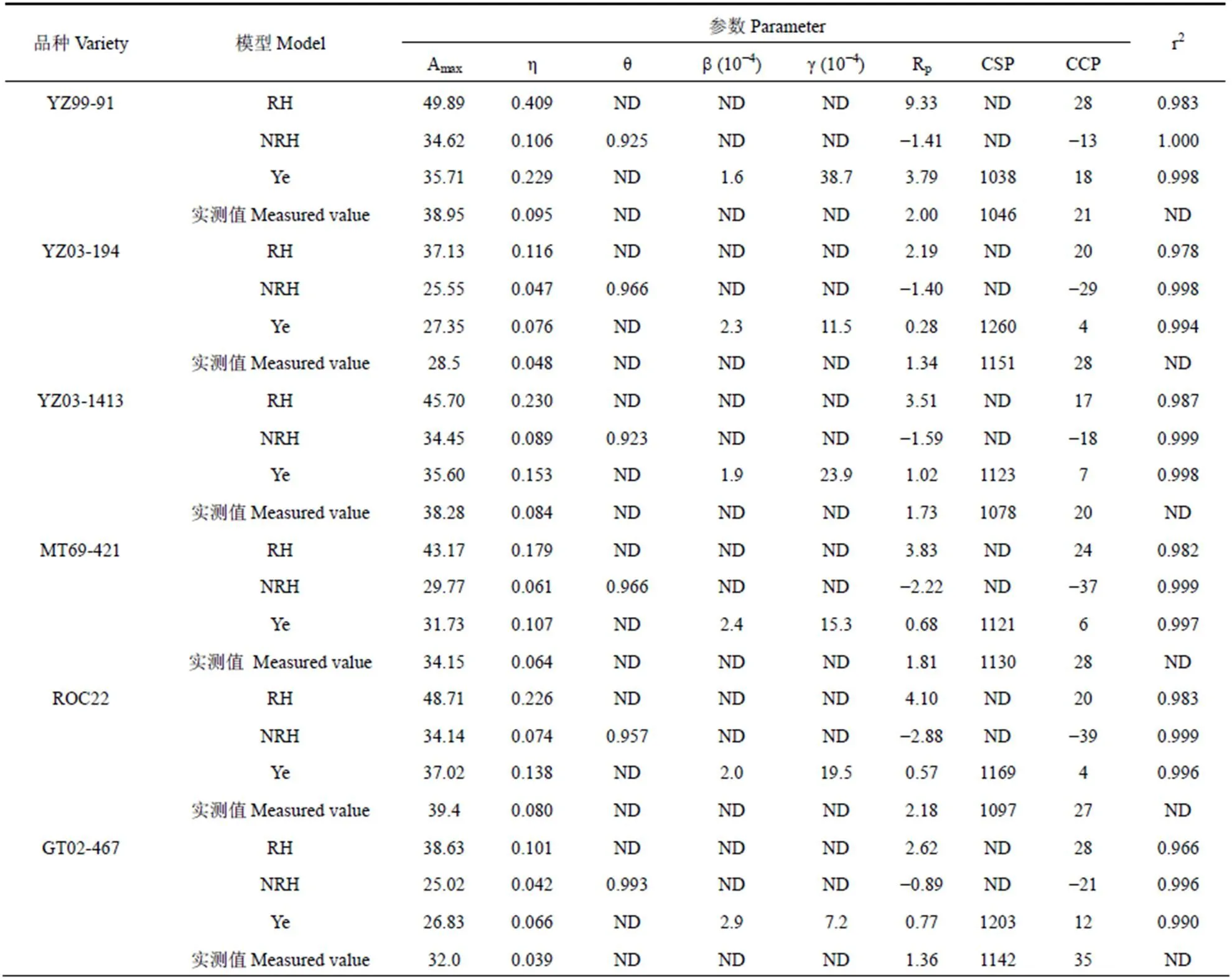
注:Amax为最大净光合速率(μmol·m−2·s−1),η为羧化速率,θ为非直角双曲线的凸度,b为CO2抑制系数,γ为CO2饱和系数,Rp为呼吸速率(μmol·m−2·s−1),CCP为CO2补偿点(μmol·mol−1),CSP为CO2饱和点(μmol·mol−1),r2为决定系数,ND表示无数据。下同。
Note: Amaxis the maximum net photosynthetic rate(μmol·m−2·s−1), η is the initial carboxylation rate, θ is the convexity of nonrectangular hyperbolic curve,bis the inhibition coefficient, γ is the saturation coefficient, Rpis the respiration rate(μmol·m−2·s−1), CCP is the CO2compensation point(μmol·mol−1), CSP is the CO2saturation point(μmol·mol−1), r2is the coefficient of determination, ND means no data. The same as below.
2.3 叶子飘模型拟合的甘蔗品种间CO2响应参数的比较
采用叶子飘模型模拟每个品种甘蔗叶片光合CO2响应曲线,比较不同品种的光合CO2响应参数,6个品种甘蔗的Amax平均值为33.2±3.7mmol·m−2·s−1,η平均值为0.134±0.069mmol·mmol−1,CSP平均值为1151±66mmol·mol−1,CCP平均值为7.8±5.4mmol·mol−1,Rp平均值为1.443±1.487mmol·m−2·s−1,由表3可见。各品种间CCP差别并不显著,但Amax、η、CSP、Rp、g、b差异均显著(表3)。
Amax是植物在CO2饱和点处达到的最大净光合速率,反映植物叶片光合电子传递能力和磷酸化的活性以及对高浓度CO2的利用能力。由表3可见,ROC22、YZ99-91、YZ03-1413品种Amax值与YZ03-194差别显著,以ROC22最大,YZ03-194最小,其它品种居中。说明品种ROC22、YZ99-91、YZ03-1413的潜在最大光合高,对高浓度CO2的利用能力强。
表2 叶子飘模型拟合的甘蔗叶片光合CO2响应参数间的相关系数
Table 2 Correlation between photosynthetic CO2response parameters fitted by Ye model
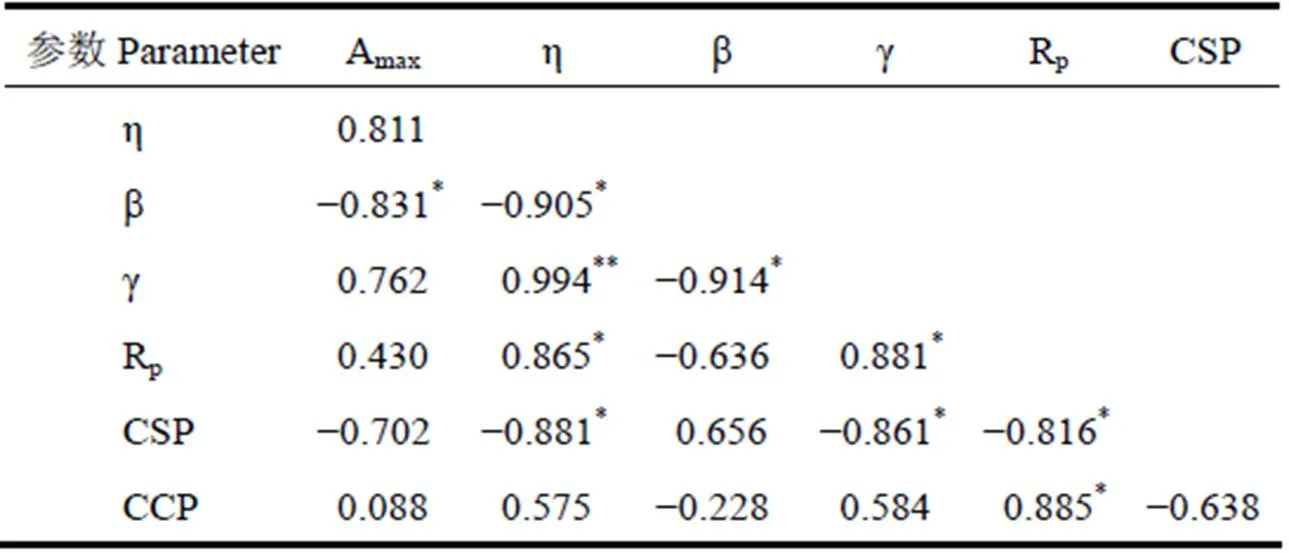
注:*表示P<0.05,**表示P<0.01。下同。
Note:*is P<0.05,**is P<0.01. The same as below.
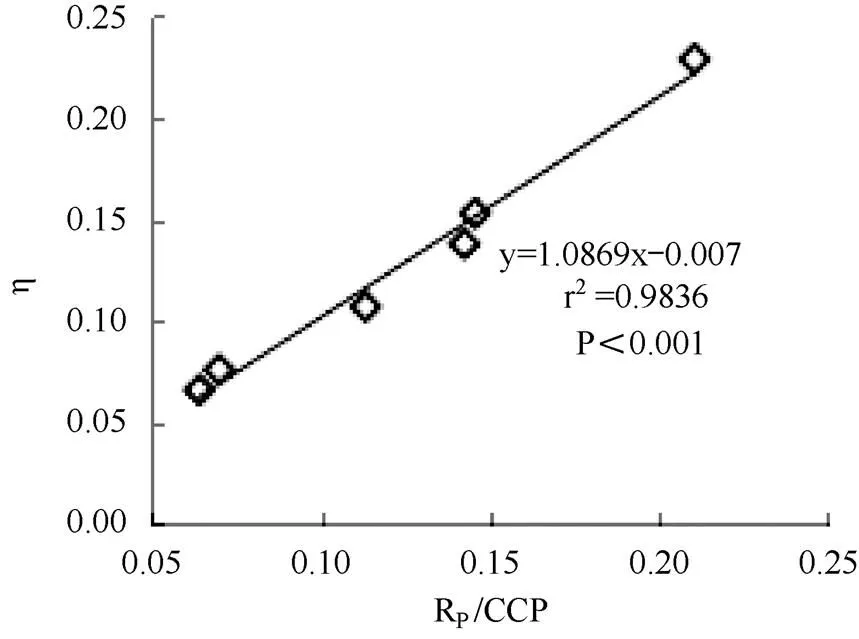
图2 叶子飘模型拟合的Rp/CCP与η间的关系
由表3还可见,不同品种甘蔗的η和g大小排序以及差异显著性基本一致,表现为YZ99-91与YZ03-194、MT69-421、ROC22、GT02-467差异显著,YZ99-91最大,YZ03-1413居中,其它品种均较小;同时因Rp与η之间也呈显著正相关关系,不同品种甘蔗的Rp大小排序以及差异显著性与η相似,即YZ99-91最大,YZ03-1413次之,其它品种的Rp较小且与YZ99-91差异显著。说明品种YZ99-91具有最高的能量损耗速率和低浓度CO2利用效率,其次是YZ03-1413,其它品种的低浓度CO2利用效率和能量损耗速率显著低于YZ99-91。
各品种的CSP与η、g、Rp呈显著负相关关系,CSP值以YZ03-194、GT02-467最大,YZ99-91最小,其它品种居中。CSP反应着植物对环境CO2浓度的适应能力,YZ99-91对高CO2浓度的适应能力较弱,其它品种甘蔗的CSP均显著大于YZ99-91。b值以MT69-421最大,YZ99-91、YZ03-1413较小,其它品种居中。
综上可以发现,YZ03-194、GT02-467、ROC22三个品种甘蔗具有很低的Rp和CCP,但YZ03-194的Amax值显著小于其它品种,GT02-467的Amax值也较小,品种ROC22的Amax最高,在低CCP、Rp的同时具有最高的光合作用潜力。品种YZ99-91的η、Rp、CCP值均为最高而CSP值最低,说明YZ99-91的羧化速率和呼吸速率都很高,在CO2浓度相对较低时达到了CO2饱和,这可能是因为其Rubisco酶活性较高。除YZ99-91以外5个品种的甘蔗CSP都大于1100μmol·mol-1,说明这5个品种在较高的CO2浓度下也不容易产生光合CO2抑制现象。
表3 叶子飘模型拟合的不同品种甘蔗叶片光合CO2响应参数比较
Table 3 Photosynthetic CO2response parameters and ANOVA of six sugarcane varieties fitted by Ye model
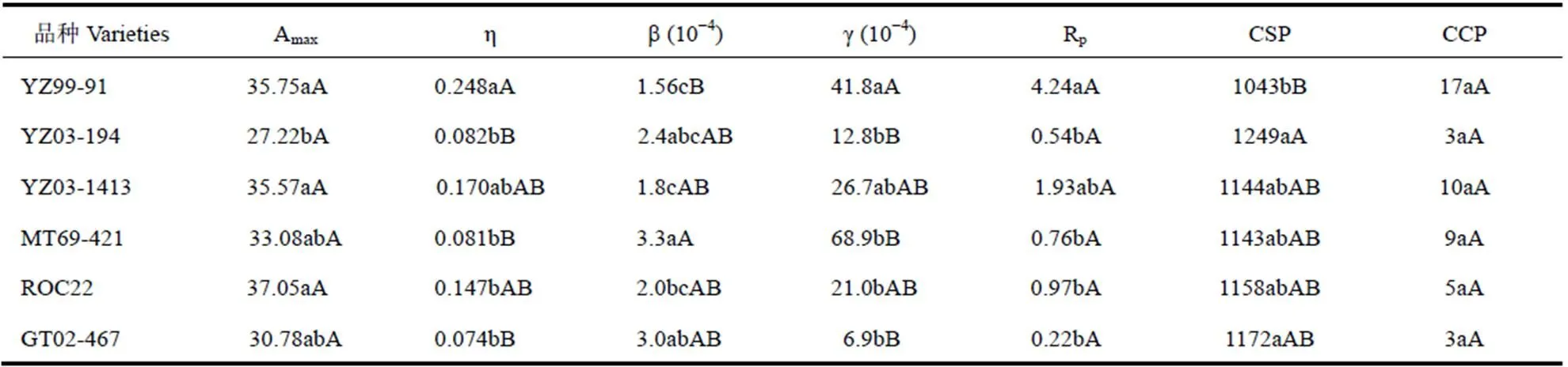
注:光合CO2响应参数是每个品种3组重复数据使用叶子飘模型拟合后得到的平均值。小写字母表示品种间在0.05水平上的差异显著性,大写字母表示品种间在0.01水平上的差异显著性。
Note: The values are the mean value of parameters individually fitted by the Ye model from three repeated measurement of Pn. Lowercase indicates the difference significance among varieties at 0.05 level, and capital letter indicates the difference significance among varieties at 0.01 level.
3 结论与讨论
3.1 结论
本研究中,叶子飘模型拟合的Amax值、CSP值、Rp值最接近实测值,并可以直接得到与实测值相近的CSP,r2大于0.99,对甘蔗的光合CO2响应曲线拟合效果最好;非直角双曲线模型拟合出的η与实测值最接近,但拟合出的Rp和CCP均为负值;直角双曲线模型拟合效果较差。
研究甘蔗光合CO2参数间相互关系发现:(1)Rp与η、CCP呈显著正相关(P<0.05),不同品种甘蔗对低CO2浓度的利用效率和利用能力与其能量消耗速率呈正比。(2)Rp/CCP与η之间也存在极显著正相关关系(P<0.001)。(3)Rp、η与CSP呈显著负相关(P<0.05),低浓度CO2利用效率高同时能量消耗速率高的甘蔗品种,较易达到CO2饱和点,其对高浓度CO2利用能力较差。
ROC22具有很低的Rp、CCP和最高的Amax,光合特性最好。品种YZ99-91的η、Rp、CCP值均为最高而CSP值最低。除YZ99-91外五个品种甘蔗的CSP都较大,能适应大气中CO2浓度的升高。
3.2 讨论
直角双曲线模型未考虑曲线的弯曲程度,模拟光合CO2响应曲线时必须增高初始斜率才能使曲线符合点的分布[32],这样常常导致η变得很大。为此,Thornley等[4]引入了非直角双曲线模型。非直角双曲线的拐点比直角双曲线更明显,在高CO2浓度下变化更平缓,所得Amax和η更小、更接近实际[33−34]。本研究中,非直角双曲线模型拟合出的η值与实测值最为接近,任博等[35]在对栓皮栎()和刺槐()的研究中也得到类似的结果。但非直角双曲线模型拟合出的6个品种甘蔗的Rp和CCP均为负值,不合常理,与任博等[35−36]对C3植物的光合CO2响应结果均不同。这可能是因为C4植物对CO2的响应与C3植物的机理不同。非直角双曲线模型是否能应用于C4作物甘蔗的CO2响应曲线的拟合,需要进一步的研究。由于直角双曲线和非直角双曲线都是渐近线,无法给出CO2饱和点,所得Amax偏高[35−36],且无法模拟植物光合作用的CO2抑制现象[16]。为解决这些难题,Ye(2007)在直角双曲线模型基础上减去一个因子,引入了抑制项和饱和项,构建直角双曲线修正模型,后被称为叶子飘模型(Ye model)[8]。叶子飘模型可直接得到CO2饱和点,所得Amax与实测值最为接近[16,35−36]。
η与Rp/CCP呈显著正相关,这可能是因为呼吸速率与初始光能利用率是决定植物CO2补偿点变化的两个最重要因素,与C3作物的研究结果相似[21,37];同时,η与Rp呈显著正相关,与C3作物的研究结果有区别。C3植物光呼吸和碳同化的第一步反应发生在同一活性中心,并都由Rubisco酶催化,CO2和O2互为竞争性抑制剂,η升高时,光呼吸被抑制。而C4植物具有在Rubisco位点上提高CO2分压的机制,O2的升高并不会抑制羧化反应[20],η与Rp呈显著正相关可能是因为Rubisco酶活性升高使羧化反应和呼吸速率同时增高。Rp、η与CSP呈显著负相关,这可能是因为植物羧化速率高,对CO2利用率高,使植物能在相对较低的CO2浓度下光合速率达到最大值。b反映CO2抑制程度,g反映CO2饱和程度。叶子飘等[22]提出,b和γ越大,则植物越容易受抑制,而本研究发现b与g呈极显著负相关。
相比于C3植物,6个品种甘蔗的光呼吸速率都较低,这是因为C4植物有在Rubisco点位上提高CO2分压的机制,Rubisco的加氧反应几乎全部被抑制,从而使C4植物的光呼吸速率降到最低值,这也使得C4植物的CCP值较低[20]。CCP是区分C3和C4作物的重要参数,C3作物CCP较高,一般大于30μmol·mol−1,C4植物的CCP较低[21],6个品种甘蔗的CCP取值范围在3~17μmol·mol−1,品种间差别不显著。低CCP、Rp的作物品种常具有产量高的特点,因此,这两个特性常被当作选育高产品种的指标[38]。ROC22是从台湾省引进的甘蔗品种,具有产量高、含糖量高、抗旱及抗倒伏能力强等优点[39],种植面积最大,是中国甘蔗主产区的主栽品种,拥有最高的光合作用潜力以及低CCP和Rp,具有较好的光合特性和高产潜力,并能适应大气中CO2浓度的升高。
[1] Valle R,Mishoe J W,Campbell W J,et al.Photosynthetic responses of ‘Bragg’ soybean leaves adapted to different CO2environments[J].Crop Science,1985,25(2):333.
[2] Baly E C.The kinetics of photosynthesis[J].Proceedings of the Royal Society of London Series B(Biological Sciences),1935, 117(804):218-239.
[3] 康华靖,陶月良,权伟,等.植物光合CO2响应模型对光下(暗)呼吸速率拟合的探讨[J].植物生态学报,2014,38(12): 1356-1363.
Kang H J,Tao Y L,Quan W,et al.Fitting mitochondrial respiration rates under light by photosynthetic CO2response models[J].Chinese Journal of Plant Ecology,2014,38(12): 1356-1363.(in Chinese)
[4] Thornley J H M.Mathematical models in plant physiology[J]. London:Academic Press,1976.
[5] 刘晓萌,于凌飞,黄耀,等.CO2浓度升高下粳稻叶片光合作用对光强变化的响应[J].生态学杂志,2018,37(4):1051-1057.
Liu X M,Yu L F,Huang Y,et al.Responses of photosynthesis in leaves ofrice to light intensity at elevated CO2concentration[J].Chinese Journal of Ecology,2018,37(4): 1051-1057.(in Chinese)
[6] Jassby A D,Platt T.Mathematical formulation of the relationship between photosynthesis and light for phytoplankton[J].Limnology and Oceanography,1976,21(4): 540-547.
[7] Ye Z P.A new model for relationship between irradiance and the rate of photosynthesis in[J].Photosynthetica, 2007,45(4):637-640.
[8] Lobo F D A,Barros M P D,Dalmagro H J,et al.Fitting net photosynthetic light-response curves with Microsoft Excel:a critical look at the models[J].Photosynthetica,2014,52(3): 479-480.
[9] Farquhar G D,Caemmerer S V,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3 species[J] Planta,1980,149(1):78-90.
[10] Yin X,Struik P C.The energy budget in C4 photosynthesis: insights from a cell-type-specific electron transport model [J].New Phytologist,2018,218(3):986-998.
[11] Kyei-Boahen S,Lada R,Astatkie T,et al.Photosynthetic response of carrots to varying irradiances[J].Photosynthetica, 2003,41(2):301-305.
[12] YU Q,Zhang Y Q,Liu Y F,et al.Simulation of the stomatal conductance of winter wheat in response to light, temperature and CO2changes[J].Annals of Botany,2004, 93(4):435-441.
[13] Leakey A D B,Uribelarrea M,Ainsworth E A,et al.Photosynthesis, productivity,and yield of maize are not affected by open-air elevation of CO2concentration in the absence of drought[J].Plant Physiology,2006,140(2): 779-790.
[14] 陈兰英,黎云祥,钱一凡,等.改进指数模型对紫茉莉光合-光响应及CO2响应适用性研究[J].广西植物,2013,33(6): 839-845.
Chen L Y,Li Y X,Qian Y F,et al.Applications studies of the modified exponential model on photosynthesis:light response and CO2response curves of[J]. Guihaia,2013,33(6):839-845.(in Chinese)
[15] von Caemmerer S.Steady-state models of photosynthesis [J].Plant,Cell and Environment,2013,36(9):1617-1630.
[16] 叶子飘,于强.光合作用对胞间和大气CO2响应曲线的比较[J].生态学杂志,2009,28(11):2233-2238.
Ye Z P,Yu Q.A comparison of response curves of winter wheat photosynthesis to flag leaf intercellular and air CO2concentrations[J].Chinese Journal of Ecology,2009,28(11): 2233-2238.(in Chinese)
[17] 马久蓉,高松,闫明,等.野生东北草莓与栽培草莓光合特性的比较[J].江苏农业科学,2018,46(5):132-134.
Ma J R,Gao S,Yan M,et al.Comparative study on photosynthetic characteristics between wildand cultivated strawberry[J].Jiangsu Agricultural Sciences,2018,46(5):132-134.(in Chinese)
[18] IPCC.Climate change 2013:the physical science basis[R].Cambridge:Cambridge University Press, 2013.
[19] Knohl A,Veldkamp E.Global change:indirect feedbacks to rising CO2[J].Nature,2011,475(7355):177-8.
[20] Lambers H,ChapinIII F S,Pons T L.Plant physiological ecology[M].Springer,2008:11-144.
[21] 蔡时青,许大全.大豆叶片CO2补偿点和光呼吸的关系[J].植物生理学报,2000,26(6):545-550.
Cai S Q,Xu D Q.Relationship between the CO2compensation point and photorespiration in soybean leaves [J].Journal of Plant Physiology and Molecular Biology,2000, 26(6):545-550.(in Chinese)
[22] 叶子飘,康华靖.植物光响应修正模型中系数的生物学意义研究[J].扬州大学学报(农业与生命科学版),2012, 33(2):51-57.
Ye Z P,Kang H J.Study on biological significance of coefficients in modified model of photosynthesis- irradiance[J].Journal of Yangzhou University,2012,33(2): 51-57.(in Chinese)
[23] Crafts-Brandner S J,Salvucci M E.Sensitivity of photosynthesis in a C4 plant,maize,to heat stress[J].Plant Physiology,2002,129(4):1773-1780.
[24] 郝祺,陆佩玲,房世波,等.黄淮海地区冬小麦光合作用参数的取值范围[J].中国农业气象,2009,30(1):74-78.
Hao Q,Lu P L,Fang S B.Range of parameter values in photosynthesis model of winter wheat in Huang-Huai-Hai areas[J].Chinese Journal of Agrometeorology,2009,30(1): 74-78.(in Chinese)
[25] 钟楚,王毅,简少芬,等.云南玉溪烟区两烟草品种叶片光合作用对光和CO2的响应[J].中国农业气象,2010,31(3): 436-441.
Zhong C,Wang Y,Jian S F,et al.Photosynthetic response to light and CO2of two tobacco cultivars in Yuxi of Yunnan province[J].Chinese Journal of Agrometeorology,2010, 31(3):436-441.(in Chinese)
[26] Moore P H,Botha F C.Physiology,biochemistry and functional biology of sugarcane[M].Wiley-Blackwell,New Jersey,2014:121-325.
[27] Irvine J E.Sugar-cane[A].Potential productivity of field crops under different environments[C].IRRI,Los Banos, Philippines,1983:361-381.
[28] 刘建波,彭懿,陈秋波.海南甘蔗种植的气候适宜性分析及区划[J].中国农业气象,2009,30(S2):254-256.
Liu J B,Peng Y,Chen Q B.Climate suitability and regionalization of sugar cane cultivation in Hainan [J].Chinese Journal of Agrometeorology,2009,30(S2): 254-256.(in Chinese)
[29] 李永秀,杨再强,张富存.光合作用模型在长江下游冬麦区的适用性研究[J].中国农业气象,2011,32(4):588-592.
Li Y X,Yang Z Q,Zhang F C.Applicability of different photosynthesis models for winter wheat in the lower Yangtze River[J].Chinese Journal of Agrometeorology,2011,32(4): 588-592.(in Chinese)
[30] 钟楚,朱勇.几种光合作用光响应模型对烟草的适用性分析[J].中国农业气象,2013,34(1):74-80.
Zhong C,Zhu Y.Applicability analysis about different photosynthetic light response models for tobacco[J].Chinese Journal of Agrometeorology,2013,34(1):74-80.(in Chinese)
[31] Ogren E.Convexity of the photosynthetic light-response curve in relation to intensity and direction of light during growth[J].Plant Physiology,1993,101(3):1013-1019.
[32] Johnson I R,Parsons A J,Ludlow M M.Modelling photosynthesis in monocultures and mixtures[J].Australian Journal of Plant Physiology,1989,16(6):501-516.
[33] Koyama K,Kikuzawa K.Geometrical similarity analysis of photosynthetic light response curves,light saturation and light use efficiency[J].Oecologia,2010,164(1):53-63.
[34] Calama R,Puertolas J,Madrigal G,et al.Modeling the environmental response of leaf net photosynthesis inL. natural regeneration[J].Ecological Modelling,2013, 251:9-21.
[35] 任博,李俊,同小娟,等.太行山南麓栓皮栎和刺槐光合作用-CO2响应模拟[J].应用生态学报,2018,29(1):1-10.
Ren B,Li J,Tong X J,et al.Simulation on photosynthetic-CO2response ofandin the southern foot of the Taihang Mountain,China[J].Chinese Journal of Applied Ecology,2018,29(1):1-10.(in Chinese)
[36] 李丽霞,刘济明,黄小龙,等.不同氮素条件米槁幼苗光合作用对CO2响应特征[J].东北农业大学学报,2017, 48(2):29-36.
Li L X,Liu J M,Huang X L,et al.Response characteristic ofseedling's photosynthesis to CO2in different conditions of nitrogen[J].Journal of Northeast Agricultural University,2017,48(2):29-36.(in Chinese)
[37] Häusler R E,Kleines M,Uhrig H,et al.Overexpression of phosphoenolpyruvate carboxylase fromlowers the CO2compensation point (Γ*) and enhances dark and light respiration in transgenic potato[J].Journal of Experimental Botany,1999,50(336): 1231-1242.
[38] Medrano H,Keys A J,Lawlor D W,et al.Improving plant production by selection for survival at low CO2concentrations[J].Journal of Experimental Botany,1995,46 (special):1389-1396.
[39] Zhao P F,Xia H M,Yang K,et al.Sugarcane yield components and sugar content in ROC22 progeny populations [J].International Sugar Journal,2016,118(1406):26-33.
Sugarcane Leaf Photosynthetic CO2Responses Parameters and Their Difference among Varieties
LIU Yang-yang1, LI Jun1, YU Qiang2, LIU Shao-chun3, TONG Xiao-juan4, YU Ling-xiang5
(1. Key Laboratory of Water Cycle and Related Land Surface Processes, Institute of Geographic Sciences and Natural Resources Research, University of Chinese Academy of Sciences, Beijing 100101, China; 2. Chinese Academy of Science and Ministry of Water Resource, Yangling 712100; 3. Yunnan Agricultural Academy Sugarcane Research Institute, Kaiyuan 661600; 4. The Key Laboratory for Silviculture and Conservation of Ministry of Education, Beijing Forestry University, Beijing 100083; 5. Climate Center of Yunnan, Kunming 650034)
Sugarcane (L.)photosynthetic CO2response represents an important physiological characteristic for sugarcane growth. Sugarcane is the major sugar crop, exhibiting the characteristic of higher photosynthetic efficiency as a C4 plant. This study was conducted to compare performance of different models of photosynthetic CO2response, and to investigate the photosynthetic CO2response characteristics of different sugarcane varieties. Field measurements were carried out in Kaiyuan, Yunnan Province, using a portable LI-6400XT photosynthesis system to explore the correlation between the photosynthetic CO2response parameters. The non-rectangular hyperbola model (NRH), rectangular hyperbola model (RH) and Ye model were used to fit the sugarcane photosynthetic CO2response curve of six varieties, and the photosynthetic CO2response parameters were analyzed. The results showed that the photosynthetic CO2response curve fitted by NRH and RH model do not determine CO2saturation point (CSP), and overestimate the maximum net photosynthetic rate (Amax). The initial carboxylation rate (η) fitted by NRH model were almost the same as the measured values, but the respiration rate (Rp) and CO2compensation point (CCP) fitted by NRH model were both negative. In general, the Ye model was the best in simulating the photosynthetic CO2response curves. In the photosynthetic CO2response parameters fitted by Ye model, η was significantly correlated (positively) with Rp/CCP (P<0.001), Rpwas significantly correlated (positively) with η and CCP (P<0.05), η and Rpwere significantly correlated (negatively) with CSP (P<0.05). The varieties with higher photosynthetic rate under low CO2concentration tended to have higher respiration rate, meanwhile, they have lower photosynthesis capacity under high CO2concentration, which are easier to reach CO2saturation point. The average Amaxvalue of six sugarcane varieties fitted by Ye model was 32.4±4.5mmol·m−2·s−1, η was 0.128±0.060, CSP was 1152±77mmol·m−2·s−1and CCP was 8.5±5.5045mmol·m−2·s−1. ROC22 had lower Rp, and CCP and the highest Amax, indicating the most realistic to represent photosynthetic characteristics. All the five sugarcane varieties except YZ99-91 have large CSP, and could adapt to the increasing CO2concentration in the atmosphere.
Sugarcane; Photosynthetic CO2response; Ye model; Varieties; Photosynthetic CO2response parameters
10.3969/j.issn.1000-6362.2019.10.004
刘杨杨,李俊,于强,等.甘蔗叶片光合CO2响应参数分析及其品种间差异[J].中国农业气象,2019,40(10):637-646
2019−02−22
。E-mail:lijun@igsnrr.ac.cn
公益性行业(气象)科研专项(GYHY201406030)
刘杨杨(1992−),女,硕士,从事作物生长模型研究。E-mail:liuyy.16s@igsnrr.ac.cn
