表皮生长因子受体敏感基因突变的非小细胞肺癌患者中厄洛替尼稳态谷浓度重复测定研究Δ
2019-10-18田桂芹郭玉金廖德华
田桂芹,郭玉金,江 沛,廖德华
(1.济宁市第四人民医院药剂科,山东 济宁 272000; 2.济宁市第一人民医院临床药学科,山东 济宁 272000; 3.湖南省肿瘤医院药学部,湖南 长沙 410013)
肺癌是全球恶性肿瘤中导致相关死亡的主要病种之一[1],每年有130万人死于肺癌[2]。现有的早期疾病筛查方法对于提高肺癌患者5年生存率的效果并不理想[3]。非小细胞肺癌(non-small cell lung carcinoma,NSCLC)是肺癌组织学类型中最常见的一种,其患者数约占所有肺癌患者数的80%[4-5]。前期研究结果表明,表皮生长因子受体(epidermal growth factor receptor,EGFR)的过表达是NSCLC发生发展的关键因素[6]。针对这一机制,越来越多的小分子靶向药物被广泛地用于NSCLC的治疗。
厄洛替尼为可逆的口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),用于EGFR敏感突变的晚期NSCLC患者的一线治疗和EGFR野生型患者的二三线治疗[7]。EGFR的主要敏感突变类型为19外显子缺失突变和21外显子L858R点突变,在北美和欧洲人群中,EGFR敏感突变的概率为10%~20%,在亚洲人群中高达60%[8]。与标准的含铂类药物二联化疗方案相比,厄洛替尼能显著延长患者的无进展生存期(progression-free survival,PFS),且不良反应较少,可有效改善晚期NSCLC患者的生活质量[9]。前期研究报道,厄洛替尼在体内外药理作用呈现浓度依赖性[10]。根据前期临床试验结果,在临床治疗中,厄洛替尼的推荐日剂量为150 mg,而不是按照体质量或体表面积给药[11]。然而,在临床应用中发现,EGFR敏感突变的NSCLC患者对厄洛替尼的反应不尽相同。越来越多的证据显示,按照固定剂量给药,厄洛替尼的暴露量存在显著的个体差异,导致患者间的治疗效果及不良反应差异显著[12]。晚期实体瘤患者口服厄洛替尼的绝对生物利用度为76%[13]。药动学研究结果表明,厄洛替尼在人体血浆中蛋白结合率为96.2%~97.1%[14-15]。前期研究报道,厄洛替尼的血药浓度受年龄[14]、体质量[16]、肝功能[16]、胆红素[16]、酸性糖蛋白[16]、吸烟状态[14]、代谢酶和转运体的基因多态性[16]等因素影响。Hidalgo等[17]报道厄洛替尼谷浓度在固定剂量(150 mg/d)下为1 200 ng/ml,而Hamada等[18]也报道过厄洛替尼谷浓度在稳态阶段是1 530 ng/ml。前期动物实验结果显示,厄洛替尼最低血浆谷浓度约为500 ng/ml时,才能有效抑制酪氨酸激酶[17]。NSCLC的总生存率与厄洛替尼血浆浓度显著相关[19]。前期研究结果还表明,厄洛替尼血清浓度可以预测NSCLC患者的预后和不良反应[10]。然而,目前厄洛替尼在治疗NSCLC时还没有明确的疗效和不良反应的阈值。相关文献报道,其他TKI类药物在治疗持续期间出现稳态浓度显著降低的现象[20]。因此,使用厄洛替尼治疗时应同步开展血药浓度监测。本研究拟开展EGFR敏感突变的NSCLC患者中厄洛替尼稳态谷浓度的重复测定,探讨厄洛替尼稳态谷浓度在NSCLC患者内及患者间的变异性。
1 资料与方法
1.1 患者入组和研究设计
选取2016年5月至2018年8月湖南省肿瘤医院接受标准剂量厄洛替尼(150 mg/d)治疗的晚期NSCLC患者。纳入标准:组织学检查证实为NSCLC,且基因突变为EGFR敏感突变;在治疗全程中始终接受标准剂量治疗;每例患者至少采集3个血样。
1.2 样本收集和厄洛替尼浓度测定
每次复查收集3 ml血浆于乙二胺四乙酸抗凝管。研究期间至少收集3个有效的药物稳态谷浓度血样。血样于3 000 r/min条件下离心5 min,取上清液储存于-80 ℃待测。采用全自动二位液相色谱进行血药浓度测定,色谱条件参考相关文献[21]。厄洛替尼定量下限为50 ng/ml。
1.3 数据收集
记录患者每次的服药时间及血样采集时间。服用厄洛替尼的患者均为门诊患者,患者每次来医院复查时会被告知当日先抽血后服药,以确保每次所采集的血样为稳态谷浓度。从病历中获取患者的人口统计学信息,包括年龄、性别、体质量、体能状态(performance status,PS)、疾病分期(TNM分级标准)、吸烟状态、突变状态及治疗反应等。不良反应的发生及严重程度分级按照美国国家癌症研究所的常规毒性判定标准(NCI-CTC 3.0版)进行划分,使用四阶段量表[22]。药品不良反应的严重程度按照研究期间观察到的最高等级为判断标准。
1.4 统计学方法

2 结果
2.1 患者的人口统计学特征
本研究共分析了24例患者的101份样本,其中,10例患者有3份样本,7例患者有4份样本,3例患者有5份样本,1例患者有6份样本,2例患者有7份样本,1例患者有8份样本;所有患者均接受标准剂量厄洛替尼治疗,无剂量调整。24例患者最初接受厄洛替尼治疗时,中位年龄为53岁(34~68岁),中位体表面积为1.52 m2(1.24~1.87 m2);男性患者16例(占66.7%),女性患者8例(占33.3%);15例患者从不吸烟,4例患者曾经吸烟,1例患者仍在吸烟;所有患者均被确诊为肺腺癌,PS评分良好;20例患者有明确的EGFR敏感突变,包括15例19号外显子缺失突变和5例21号外显子L858R点突变的患者,其余4例患者虽然存在EGFR敏感突变,但未记录确切的突变状态,见表1。
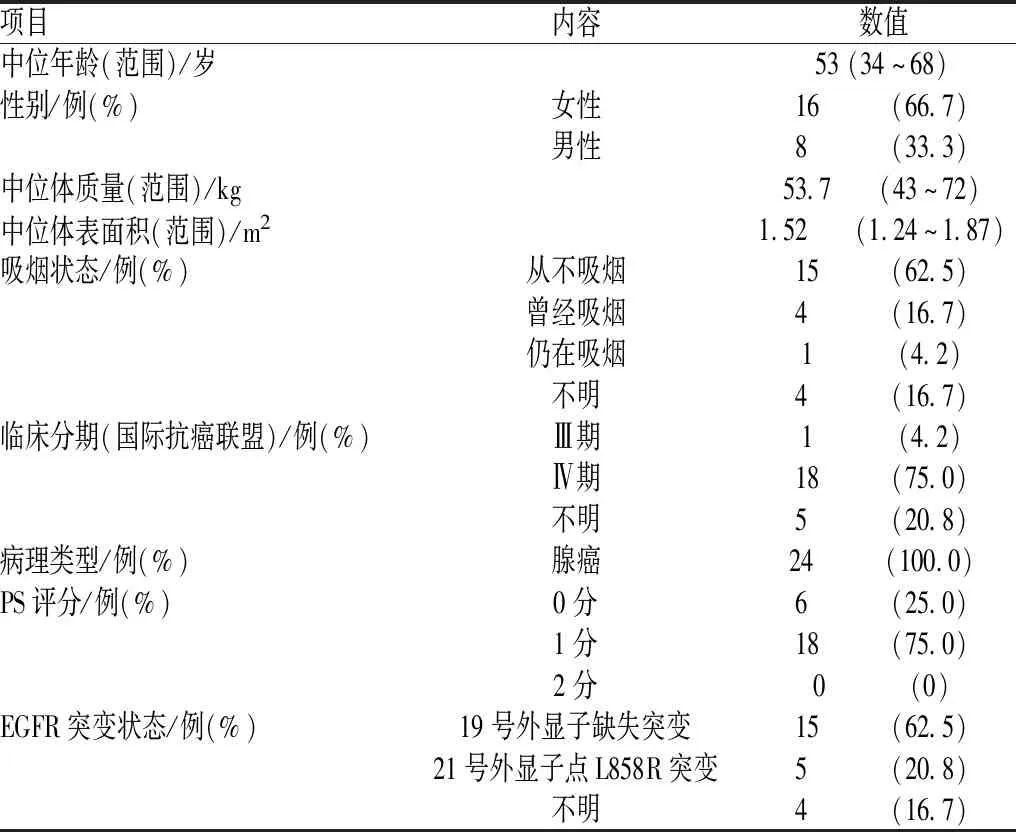
表1 参与研究的24例患者的基线资料和病理特征Tab 1 Baseline information and pathological feature of the 24 patients
2.2 厄洛替尼血浆谷浓度的测定与分布
本研究中,厄洛替尼低、中、高浓度时的日内、日间精密度和准确度均<4.5%,低、中、高浓度厄洛替尼的平均回收率为101.7%~103.9%。厄洛替尼在血浆中的色谱图见图1。所有血浆样品的平均厄洛替尼稳态谷浓度为(1 218.23±506.69)ng/ml,重复测定厄洛替尼的稳态谷浓度的结果见表2、图2。正态性统计结果显示,厄洛替尼稳态谷浓度在患者体内近似于正态分布;19号外显子缺失、21号外显子L858R点突变患者的平均厄洛替尼稳态谷浓度分别为(1 183.43±366.16)、(1 267.14±613.07)ng/ml,两者的差异无统计学意义(P=0.704),见图3(A);男性、女性患者的平均厄洛替尼稳态谷浓度分别为(1 256.88±413.50)、(1 094.92±355.96)ng/ml,两者的差异无统计学意义(P=0.355),图3(B);从不吸烟、具有吸烟史患者的平均厄洛替尼稳态血药浓度分别为(1 296.76±381.32)、(1 046.45±387.86)ng/ml,两者的差异无统计学意义(P=0.136),图3(C)。所有患者的平均患者内变异性为32.8%,最高患者内变异性为75.9%;厄洛替尼最高血浆浓度为2 042.9 ng/ml,最低血浆浓度为506.0 ng/ml。所有患者的平均患者间变异性为41.6%,厄洛替尼最高检测浓度为2 895.2 ng/ml,最低检测浓度为315.6 ng/ml。
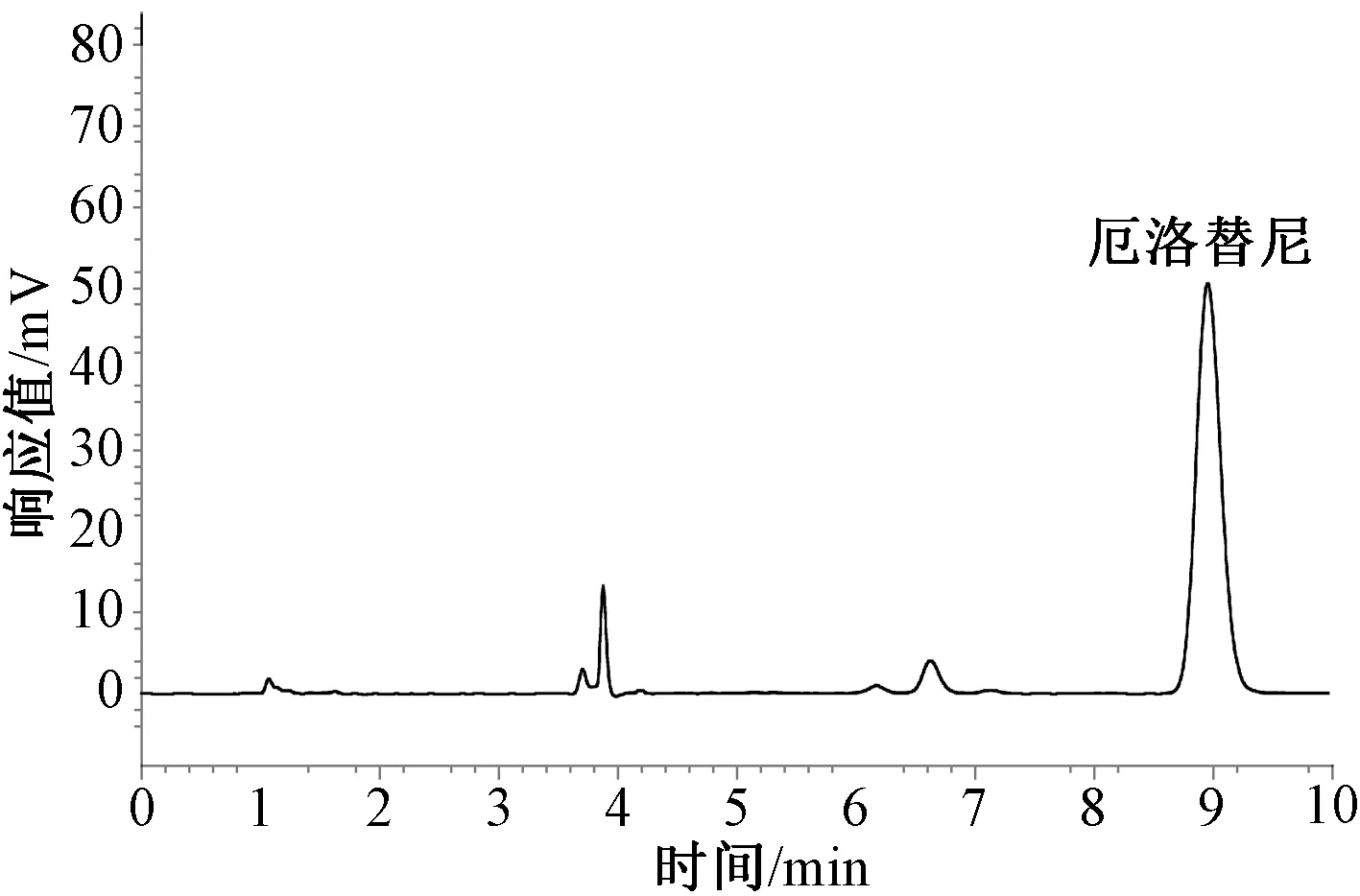
图1 厄洛替尼在血浆中的色谱图Fig 1 Chromatogram of erlotinib in plasma
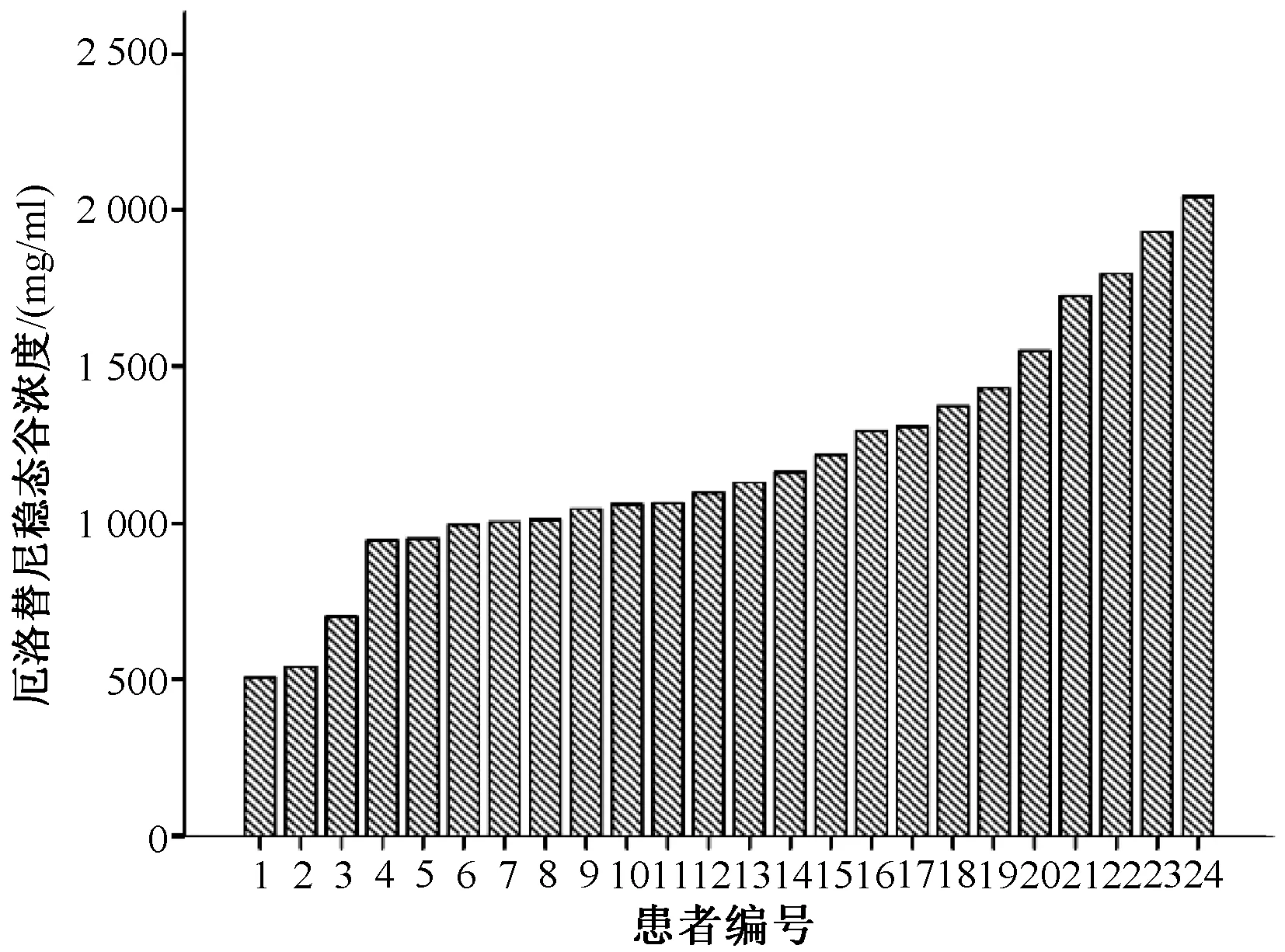
图2 24例患者厄洛替尼平均稳态谷浓度分布Fig 2 Distribution of average steady-state trough concentration of erlotinib among the 24 patients
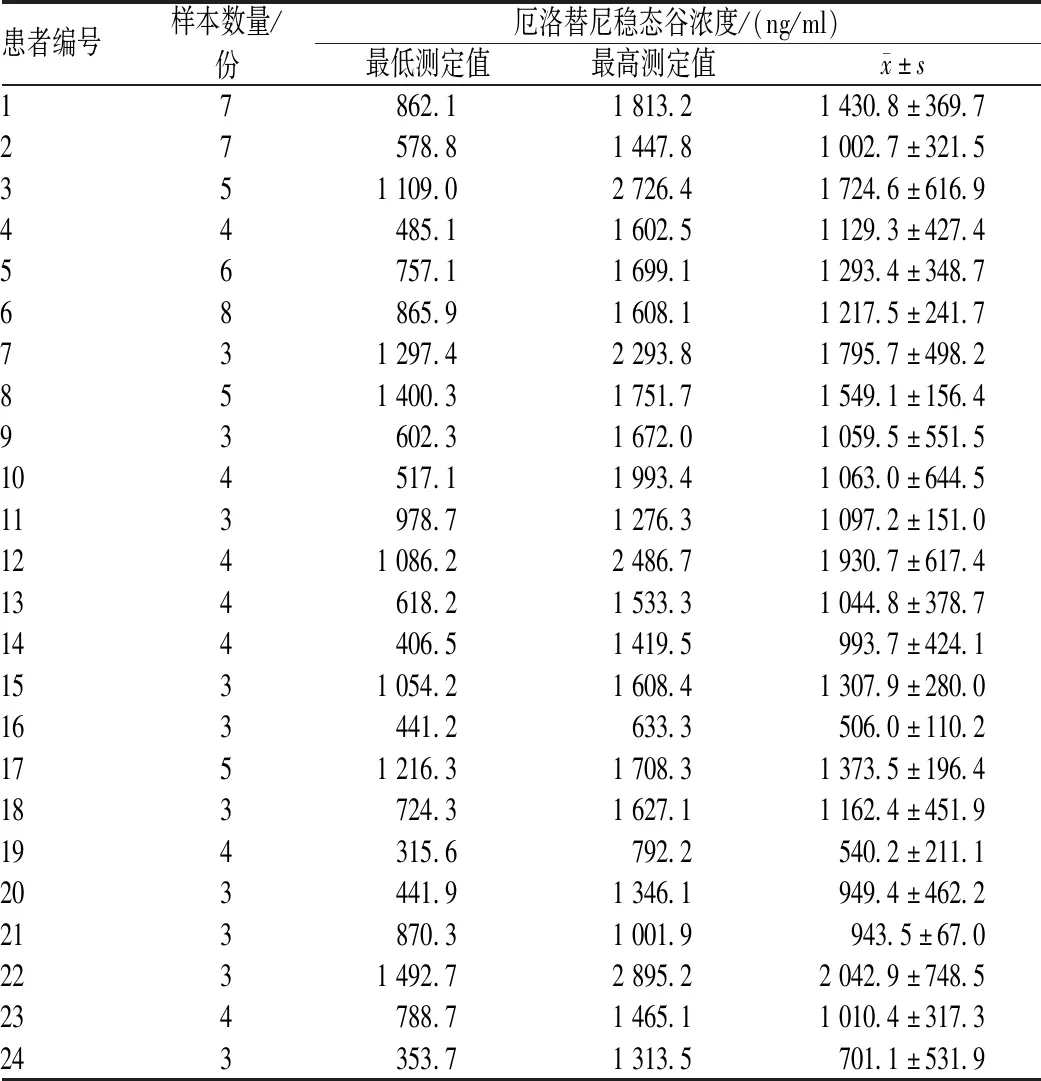
表2 反复测定厄洛替尼稳态谷浓度的结果Tab 2 Results of repeated measurement on steady-state trough concentration of erlotinib
3 讨论
本研究多次测定了EGFR敏感突变的NSCLC患者的厄洛替尼稳态谷浓度,结果显示,厄洛替尼稳态谷浓度在患者内、患者间的变异性较大,且厄洛替尼稳态谷浓度与患者人口统计学特征之间并无显著相关性。据调查,本研究是首次开展的厄洛替尼在晚期NSCLC患者中的稳态谷浓度测定。
本研究共收集了24例患者的101份血样,采用全自动二维液相色谱测定厄洛替尼血浆浓度。虽然厄洛替尼的确切治疗范围不确定,但血浆中厄洛替尼谷浓度稳定在>500 ng/ml才能满足在NSCLC的治疗中发挥TKI的作用[17]。本研究结果显示,治疗过程中,24例患者的平均厄洛替尼血药浓度均>500 ng/ml。但500 ng/ml作为厄洛替尼在NSCLC患者中的治疗阈值仍然存在争议。有研究结果表明,NSCLC患者中,厄洛替尼血浆浓度范围为684~1 720 ng/ml时能维持较好的治疗效果[23]。Fiala等[10]也将厄洛替尼在晚期NSCLC患者中的治疗范围规定为0.8~1.25 μg/ml。此外,有相关文献报道,治疗目标浓度范围与肿瘤特征密切相关。例如,对于EGFR敏感突变的患者,其半抑制浓度为3~837 ng/ml,其他患者则为3~3 930 ng/ml[23]。也许其他肿瘤特征,如肿瘤突变峰度、疾病分期等内部因素也会影响目标浓度。

A.厄洛替尼稳态谷浓度与EGFR突变状态无显著相关性;B.厄洛替尼稳态谷浓度与患者性别无显著相关性;C.厄洛替尼稳态谷浓度与患者吸烟状态无显著相关性A.no significant correlation between steady-state trough concentration of erlotinib and EGFR mutation status; B.no significant correlation between steady-state trough concentration of erlotinib and patients’ genders; C.no significant correlation between steady-state trough concentration of erlotinib and smoking图3 厄洛替尼稳态谷浓度与患者人口统计学特征的相关性Fig 3 Correlation between steady-state trough concentrations of erlotinib and patient demographics
本研究中观察到厄洛替尼稳态谷浓度在患者间和患者内存在较大的变异性,与之前的研究报道一致[24-25]。患者人口统计学特征可能对血药浓度有重要的影响[26]。但在本研究中,EGFR突变状态、性别和吸烟状态对于厄洛替尼的稳态谷浓度并没有显著影响。基于其他真实世界队列研究,患者内部的巨大差异可以通过患者依从性来解释。厄洛替尼作为口服药物,为患者提供了在家自行给药的方便,但越来越多的证据表明患者对于这一给药方式的依从性较差[8]。有文献报道,患者间的变异与代谢酶和转运体的基因多态性有关。厄洛替尼主要经肝药酶CYP3A4、CYP3A5代谢,小部分经CYP1A2、CYP1A1代谢;ABCB1和ABCG2是厄洛替尼的重要转运体。代谢酶及转运体的基因多态性往往会引起蛋白表达的显著差异,从而导致药动学特征产生差异。
本研究的局限性:本研究为对大部分临床资料的回顾记录;样本量小,需要对更大的患者群体进行进一步的研究来证实本研究结果。
综上所述,厄洛替尼在晚期NSCLC患者中存在显著的个体间差异及个体内差异,且稳态浓度与治疗效果密切相关。为实现厄洛替尼在NSCLC患者中的个体化治疗,应定期开展厄洛替尼稳态谷浓度的监测,避免因药物浓度过低导致的快速耐药或浓度过高引起的不良反应。因此,常规开展厄洛替尼血药浓度监测具有重要的临床意义。
