透明帽辅助无痛胃镜下氩离子凝固术治疗上段食管胃黏膜异位症的应用
2019-10-17许捷鸿
许捷鸿
食管上段胃黏膜异位症(heterotopic gastric mucosa in the upper esophagus,HGMUE)目前病因尚未完全明确,大多数学者认为系先天发育过程中胃黏膜在食管上段残留所致。von Rahden等[1]根据HGMUE的临床表现、内镜以及组织学特征将其分为5型:Ⅰ型无症状,有HGMUE内镜表现,无并发症及病理组织形态改变;Ⅱ型有症状,但无病理形态改变;Ⅲ型既有症状,又有病理组织形态改变和良性并发症如食管狭窄、食管蹼和瘘;Ⅳ型:发生食管上皮内瘤变;Ⅴ型:发生食管腺癌。随着消化内镜检查技术的日益发展,舒适胃镜检查的普及和对本病认识的提高,近年本病的检出率也逐渐增多,其中不乏出现并发症者,严重者可并发食管狭窄、溃疡、出血、穿孔、气管食管瘘等,甚至可发生癌变[2-4]。对其进行内镜治疗干预也逐步得到重视,但由于病变位置特殊,要获得清晰的视野并在内镜下完整处理病灶有一定难度。本研究就透明帽辅助无痛胃镜下氩离子凝固术(argon plasma coagulation,APC)治疗HGMUE的疗效、应用价值及安全性进行探讨。
1 资料与方法
1.1 一般资料
选择2013年1月至2017年1月在我院经胃镜检查和病理确诊为HGMUE并行APC治疗的患者80例。排除恶性肿瘤患者,排除凝血功能障碍、脏器功能衰竭及无痛内镜检查禁忌者。本研究经我院医学伦理委员会批准,患者均知情同意,签署知情同意书。80例患者内镜下所见病灶呈圆形、椭圆形或不规则岛状,距门齿16~21 cm,每例病灶1~4处,直径0.2~3.5 cm。其中Ⅰ型12例,Ⅱ型145例,Ⅲ型3例,无Ⅳ型和Ⅴ型病例,其中上腹部不适96例,吞咽不适28例,反酸和烧心59例,咽部不适42例,胸骨后痛15例,合并食管蹼3例。按随机数字法分为研究组和对照组,各40例。研究组患者采用透明帽辅助胃镜下APC治疗,对照组患者采用常规胃镜下APC治疗(不附加透明帽)。研究组男30例,女10例,年龄23~72岁,平均(39±12.45)岁;共发现95处病灶,62处直径<2 cm,33处直径≥2 cm。对照组男28例,女12例,年龄25~65岁,平均(35±10.22)岁;共发现87处病灶,51处直径<2 cm,36处直径≥2 cm。两组一般资料比较无统计学差异(P>0.05),具有可比性。
1.2 器材准备
单腔电子胃镜(EG-450WR5,日本富士公司;GIF-XQ260/GIF-Q260J,日本奥林巴斯公司;EG-2990i,日本宾得公司),ERBE VIO300S电外科系统和直喷型氩气刀(德国爱尔博公司),山东玉华公司氩气高频电刀YHA300,透明帽。
1.3 操作方法
常规无痛胃镜检查准备,心电指脉氧监护下,静脉注射丙泊酚(阿斯利康制药有限公司生产,批号:JR157/KA259/KH803/KL761/1608102/161243)麻醉。设定电凝功率为40~50 W,氩气流量为1.8~2.0 L/min,确定设备完好,连接正确,体外测试电极工作状态正常。研究组进镜前先在胃镜前端安装合适的透明帽(图1),以透明帽为支撑配合左右旋转或上下移动镜身保持良好视野,对照组胃镜前端不佩戴透明帽。胃镜直视下观察病灶,经内镜钳道插入氩离子凝固电极,并将其伸出胃镜头端1~2 cm,于病灶上方约0.3~0.5 cm处,每次1~3 s,自肛侧渐向口侧施行APC治疗(图2),至病灶泛黄或黝黑(图3),操作过程中尽量避免电极直接接触病灶。

图1胃镜前端置透明帽,清晰显示上段食管异位的胃黏膜,呈类圆形或椭圆形橘红色改变(箭头示)图2透明帽辅助氩离子凝固术治疗食管胃黏膜异位
图3显示食管上段异位的胃黏膜经氩离子凝固术后呈焦黄改变,无残留病灶
1.4 观察指标与术后处理
记录每个病灶的位置、大小、每例的治疗时间、完整治疗率(完整治疗病例率=该组所有病灶完全消失的病例数/该组所有病例数×100%;病灶完整损毁率=该组完全损毁的病灶数/该组所有病灶数×100%)及残留率(残留病例率=该组有病灶残留的病例数/该组所有病例数×100%;病灶残留率=该组有残留的病灶数/该组所有病灶数×100%)。术后禁食8~12 h,观察有无胸痛、恶心、呕吐、反酸、烧心、吞咽不适、出血、穿孔等表现。质子泵抑制剂经静脉用药2 d后改口服,观察无症状可进流质饮食,3 d后少渣半流质饮食,1周后无不良反应可正常饮食。
1.5 随访
所有患者在术后随访6~12个月,电话问询或门诊就诊了解临床症状的变化,第6个月时和第12个月时复查胃镜,参照前次病灶部位着重观察,若有残留病灶者取活检并再次行APC。
1.6 统计学分析

2 结果
2.1 疗效
研究组所有病例均一次性完成治疗,平均耗时6.05 min,对照组中一次性完成治疗33例,行二次治疗7例,平均耗时8.11 min。术后第6个月复查胃镜,研究组未发现残留,病灶完整毁损率100%,而对照组中发现7例有残留,残留率17.50%,两组间治疗完整率和残留率有显著差异(P<0.05),见表1。术后第12个月复查胃镜两组均无残留病灶。研究组能更彻底毁损病灶,且所需治疗次数更少。在残留的病灶中,比对首次治疗前病灶分析,研究组95处病灶无论大小均无残留,而对照组87处病灶中,51处直径<2 cm的病灶中有4处残留,残留率7.84%,与研究组比较有显著差异(P<0.05); 36处直径≥2 cm的病灶中有8处残留,残留率22.22%,与研究组比较有非常显著差异(P<0.05),见表2。

表1 两组治疗情况及疗效比较
注:*采用连续校正2检验
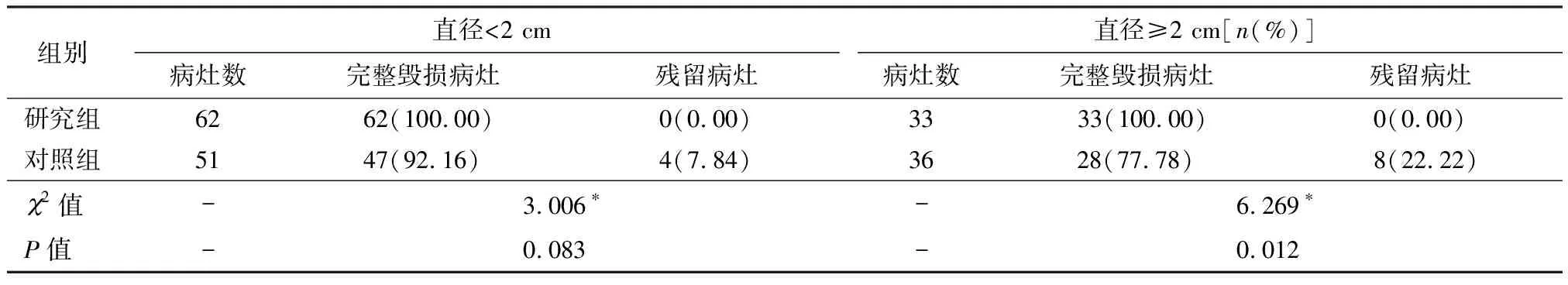
表2 两组不同大小病灶疗效分析[n(%)]
注:*采用连续校正2检验
2.2 不良反应
两组患者均无明显不良反应,无出血、穿孔及发热病例。研究组咽部不适2例,反酸1例,对照组咽部不适3例,反酸1例,胸痛1例。经抑酸、对症处理3~7 d消失。两组并发症发生率无显著差异(P>0.05),见表3。
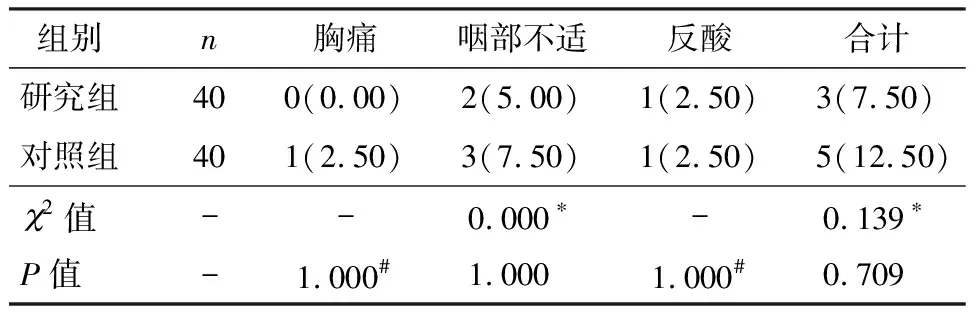
表3 两组并发症比较 [n(%)]

3 讨论
HGMUE检出率国内外报道不一,国内报道为0.34%~9.7%[5-6],国外报道为0.10%~13.80%[1,7]。检出率的差异较大,与操作医师的对该病认识程度、技术水平、病人的依从性,以及病变位置高难以获得清晰视野易漏诊有关,近年随着无痛胃镜的普及和窄带成像技术(narrow band imaging,NBI)等电子染色内镜技术的开展,临床上有更多的HGMUE被检出,对该病的诊疗也逐步得到重视[8-10]。但HGMUE的治疗目前尚无统一标准,Ⅰ型患者一般建议随访即可。Ⅱ、Ⅲ、Ⅳ型根据患者的临床表现以及病变严重程度选择不同的治疗方案,包括药物治疗、内镜治疗和外科手术。症状轻微者给予抑酸剂及促动力药物改善症状,对伴有异型增生、黏膜内癌变者应尽快行内镜下根治性治疗,包括内镜下黏膜切除术(EMR)、内镜下黏膜剥离术(ESD)、APC等,对侵犯黏膜层以下的V型HGMUE患者可考虑外科手术切除[1-2,7,11]。
本研究中有12例为I型患者,因常处于焦虑状态,强烈要求内镜治疗,术后焦虑表现明显改善。我们认为对于I型患者,虽无症状,但有明显精神心理负担的,征得患者同意,也可行内镜治疗。本研究中80例患者均采用APC治疗,一次性完整治疗率为82.5%(对照组)和100%(研究组),第6个月再次内镜治疗后治愈率达100%,多篇报道也显示APC治疗HGMUE安全有效[12-13]。Wahab PJ等[14]认为APC主要有以下优点:1.非接触性,无需接触病变组织即能达到电凝的效果,无组织黏连;2.凝固深度的自限性,0.5~3.0 mm;3.自动导向性,可以进行轴向、侧向和自行逆向凝固,几乎可以达到病变的每个部位。1980年代APC首先应用于外科开放性手术止血,1990年代由德国Grund等[15]开始应用于消化内镜治疗,2000年代初国内吴云林等[16]将该技术引入我国。因其易用、安全、较为高效而很快获得普及,已广泛应用于在消化道出血、胃肠道息肉、巴雷特食管、Dieulafoy病、疣状胃炎等内镜治疗[17-19]。本研究中两组均无明显并发症发生,显示APC治疗HGMUE有显著疗效且有较高的安全性。但本研究中也有7例发生了病灶残留,均出现在无附加透明帽的对照组中,有病灶残留的病例占17.50%,且以直径≥2.0 cm的病灶残留发生率高,病灶残留率达22.22%。无足够清晰的手术视野是影响疗效的重要因素,不能充分发挥APC的优势。考虑主要受以下因素影响:①HGMUE位于食管上段,食管多处于收缩状态;②受呼吸运动及心脏及主动脉搏动的影响,常无法获得清晰的视野,治疗的精确度小;③氩气送出的同时局部气压变小,黏膜会向电极聚拢,导致食管空间更狭小;④病灶大小也是影响病灶未能完整毁损的因素之一,虽然同组中不同直径病灶完整毁损率无明显差异(P=0.055),但病灶范围大者更难以窥见全貌,之所以差异不明显,可能与本研究病例数较少有关。对于直径超过2 cm的病灶,术者的技术要求更高,同时受到术野不清的影响可能更大,导致对病灶损毁的范围判断不准。由于视野不清,治疗精度下降,治疗过程中也会损伤正常组织,另外,虽然APC是一种非接触性的电凝固技术,但食管空间狭小,且食管上段多处于收缩状态,操作可控性降低,极易发生先端电极和组织黏连,电极端可深达黏膜下造成黏膜下气肿,甚至并发食管穿孔等风险。
为获得清晰稳定的术野,李之印,李兆申[20]采用自制外套管辅助固定的方法,EMR治疗HGMUE53例,一次性切除者45例,2次切除者5例,3次切除者3例。平均每例所需时间为6.5 min(4.5~7.5 min),内镜下完全切除率达100%,术后3个月随访时43例症状消失,占81.1%;6个月随访时45例症状消失,占85%。由于有外套管支撑住病灶,减少了食管运动的影响,视野清晰,操作方便,同时避免了因食管活动和视野不清造成的误操作所引起的并发症。但自制外套管并不易获得,也难以标准化,而对于直径超过2 cm的病灶需行分次分片切除,技术要求高,增加出血、穿孔等并发症发生的风险,也存在无法完整切除的情况,治疗成本增加,不利于推广。本研究中研究组95处病灶中有33处病灶直径超过2 cm,对照组87处病灶中也有36处病灶直径超过2 cm,最大直径3.5 cm,对于这些直径超过2 cm的病灶,EMR无法一次性完整切除,且较APC风险更大,费用更高,APC应是更好的选择。另外,内镜透明帽现已是内镜治疗中的常用附件,随着内镜技术的发展,透明帽作为治疗附件已广泛应用于内镜诊断及治疗中[21],通过透明帽的支撑和固定作用,常能获得清晰而稳定的手术视野,其在隐匿性病灶的发现和诊断治疗有重要价值,尤其是在内镜头端不易停留的胃肠道病变处理中发挥了不可替代的作用[22-25]。研究组中我们采用透明帽辅助,并在丙泊酚静脉麻醉下对40例HGMUE患者行APC治疗,取得满意疗效。与不用透明帽组比较,显著提高了病灶一次性完整毁损率,尤其是对于直径超过2 cm的病灶,透明帽辅助法更具优势,残留率明显降低,操作时间更短。通过在内镜前端安置透明帽,电极与病灶间可保持一定的距离,食管腔撑开,能获得足够的空间和更清晰的视野,同时,透明帽有局部的支撑和固定作用,能克服食管收缩及心脏主动脉搏动的影响,治疗精确度更高,可完整损毁病灶,明显降低操作的难度,缩短治疗时间,并发症减少。
综上,无痛胃镜下患者耐受性好,医师能更从容细致操作,APC治疗表浅病灶安全可控,简单有效,若同时在胃镜前端置透明帽可使视野更清晰,操作稳定性更好,对较大病灶完整治疗率更高。该方法设备要求不高,技术难度不大,安全可行,值得临床推广。但操作过程中要注意选择合适的透明帽并固定牢靠,进镜过程中动作要轻柔,避免损伤咽部及食管黏膜。另外,因为APC是一种毁损性治疗方法,术前应做好病理评估,术后注意随访。
