miR-494在胃癌组织中的表达及其对人胃癌SGC-7901细胞增殖和迁移的影响
2019-10-17李炜王娟毅姚忠强贺启华吴光辉
李炜,王娟毅,姚忠强,贺启华,吴光辉
胃癌是目前已知的主要消化道恶性肿瘤之一[1]。胃癌早期无明显临床症状,早期诊断率较低,同时由于该疾病发生局部浸润和远转移的时间早,当患者被确诊时已错过最佳治疗时机,因此胃癌预后差、病死率较高[2]。近年来研究表明,长链非编码RNA (long non-coding RNA,LncRNA)在调控癌症的发展过程中发挥了重要作用[3-4]。miR-494是miRNAs家族中重要的一员,段鸿芳等[5]研究表明:miR-494在肝癌、肺癌、胃肠道肿瘤、脑部肿瘤等疾病中呈现不同的差异表达,并且可以影响肿瘤细胞的增殖、分化、凋亡等生物学过程,从而影响肿瘤的发生发展。李新华等[6]研究表明:miR-494在弥漫型胃癌组织中的表达下降了4.39倍,在肠型胃癌组织中则下降了2.50倍。目前有较多的miR-494表达量与胃肠道肿瘤的研究,但miR-494对人胃癌细胞增殖和迁移的影响的机制研究较少。本文旨在研究miR-494在胃癌组织中的表达及其对人胃癌SGC-7901细胞增殖和迁移的影响,以期了解miR-494在胃癌组织中的表达及其对人胃癌SGC-7901细胞增殖和迁移作用机理,从而为胃癌的治疗提供一定的理论依据。
1 材料与方法
1.1 临床标本收集及主要细胞
34例胃癌病人肿瘤组织和癌旁组织标本均来自2015年6月至2017年8月于我院接受胃癌手术的患者。人胃癌SGC-7901细胞购自中国科学院细胞库。
1.2 主要试剂与仪器
TRAIL购自英国Pepro Tech公司;Ki67抗体购自武汉华联科有限公司;VEGF、Vimentin抗体购自美国SIGMA公司;N-cadherin、E-cadherin抗体购自美国Santa Cruz Biotechnology公司;RPMI1640培养基购自广州威佳科技有限公司;青霉素钠购自哈药集团制药总厂;细胞转染试剂盒购自赛默飞世尔科技公司;CCK-8 试剂盒购自默沙克有限公司;磷酸缓冲液PBS购自天津科密欧有限公司。
低温离心机购自湖南恒诺离心机有限公司;光学显微镜购自东莞市同创仪器有限公司;细胞培养箱购自美国Forma公司;蛋白电泳及转膜仪购自美国Bio-Rad公司。
1.3 方法
1.3.1 分组干预 将人胃癌SGC-7901细胞分为三组,分别为空白对照组(Control)、空白质粒导入组(miR-NC)和目的基因组(miR-494);其中空白对照组不做任何处理,空白质粒导入组导入切除目的基因的质粒,目的基因组导入目的基因miR-494。
1.3.2 细胞培养 将人胃癌SGC-7901细胞培养于含10% FBS、100 U/mL青霉素和100 U/mL链霉素RPMI1640培养基中,放入温度为37 ℃、CO2浓度为5%的培养箱内培养,取对数生长期细胞进行实验。
1.3.3 细胞转染 将细胞传三代培养于6孔板中,培养24 h后进行细胞转染。严格按照转染试剂盒说明书方法操作,转染48 h后,收集细胞,进行后续实验。
1.3.4 RT-PCR 用TRIzol试剂提取各组细胞总RNA,测定RNA浓度和纯度后,用反转录试剂盒合成cDNA,用PCR仪进行扩增,按照试剂盒操作方法检测各RNA表达水平,本实验以β-actin为内参。
1.3.4 CCK-8 检测细胞的增殖情况 取上述对数生长期的细胞,接种于96个孔板中细胞接种,每孔接种1.5×106个细胞。放入温度为37 ℃、CO2浓度为5%的培养箱中培养 24 h,待细胞贴壁后,分别培养0、1、2、3 d后加入10 μL CCK-8溶液培养2 h后使用酶标仪测定450 nm处各孔的吸光度值,计算胃癌SGC-7901细胞的抑制率。
1.3.5 Transwell检测胃癌SGC-7901细胞侵袭性及迁移性 使用移液器在Transwell小室的PVPF聚碳酸滤膜外表面均匀涂抹5 μg 纤粘连蛋白,膜内侧表面涂5 μg matrigel。调整对数生长期的人胃癌SGC-7901细胞至2×105个/孔,接种于transwell小室,在37 ℃、5% CO2温箱培养4 h。建立细胞侵袭模型,使用PBS清洗三次并去除小室中膜内侧表面多余的细胞,多聚甲醛进行固定;400倍显微视野下随机选取10个视野,倒置显微镜下采用双盲计数法统计膜下表面的细胞数均值,实验重复检测三次。
1.3.6 Western blot 检测蛋白表达水平 取对数期细胞,吸除培养皿中的培养基保存于灭菌离心管中。使用1 200 r/min离心10 min后加入裂解液重悬细胞,置于冰中裂解30 min,再次以1 200 r/min离心10 min,加入200 μL的Loading Buffer 缓冲液,100 ℃煮沸10 min;使用BCA法测定蛋白浓度后,使用SDS-PAGE电泳提取总蛋白,半干法将蛋白转移到PVDF膜后放入TBST溶液中缓慢摇动洗膜5 min,再将 PVDF膜放入配制好的一抗液中孵育,室温下摇动30 min后放入4 ℃恒温箱中过夜。取出后使用TBST洗涤三遍后放入二抗反应液中室温孵育2 h;封闭液:二抗为2 000∶1;曝光后以Actin为内参蛋白,目的蛋白条带灰度值/内参条带灰度值为相对蛋白表达水平。
1.4 统计学方法
研究数据分析和作图采用的软件为SPSS 22.0和GraphPda Prism5,方差分析使用单因素方差分析,当组间差异存在统计学意义时,采用SNK-q方法进行进一步的比较;使用单因素方差分析时,若P<0.05则表明数据差异有统计学意义,本研究所有检验均为双侧检验。
2 结果
2.1 不同组织中miR-494的表达水平
由图1(A)可以看出,相比癌旁正常组织,胃癌组织miR-494的表达水平显著降低(P<0.05);由图1(B)可以看出,相比空白对照组,空白质粒导入组miR-494的表达水平无显著变化(P>0.05);相比空白质粒导入组,目的基因组miR-494的表达水平显著降低(P<0.05)。
2.2 胃癌SGC-7901细胞增殖检测结果
由图2(A、B)可以看出,相比空白对照组,空白质粒导入组Ki67的表达水平无显著变化(P>0.05);相比空白质粒导入组,目的基因组Ki67的表达水平显著降低(P<0.05);由图2(C)可以看出,相比空白对照组,空白质粒导入组细胞抑制率无显著变化(P>0.05);相比空白质粒导入组,目的基因组细胞抑制率显著升高(P<0.05)。
2.3 胃癌SGC-7901细胞侵袭性检测结果
由图3可以看出,相比空白对照组,空白质粒导入组单位面积细胞侵袭数目无显著变化(P>0.05);相比空白质粒导入组,目的基因组单位面积细胞侵袭数目显著降低(P<0.05)。
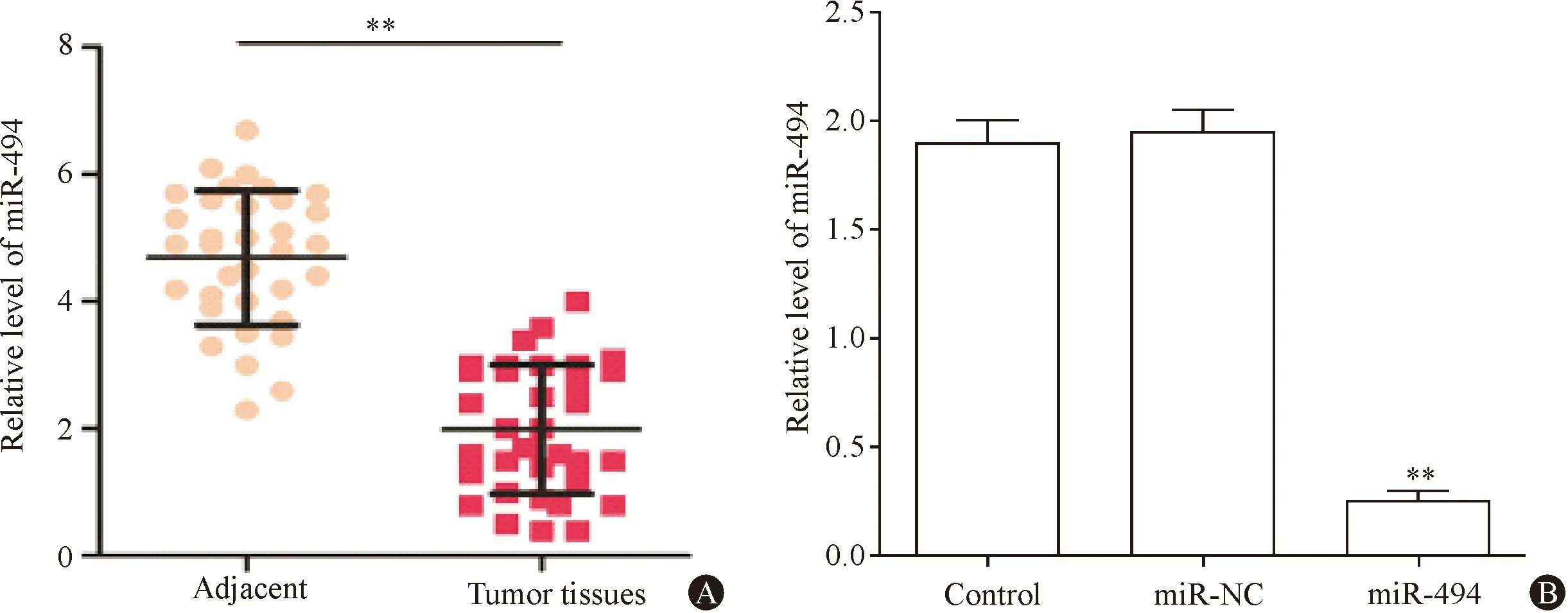
图1不同组织中miR-494的表达水平 A:癌旁组织和胃癌组织中miR-494的表达水平;B:miR-494的相对表达水平。与正常组织相比,**P<0.05

图2胃癌SGC-7901细胞增殖检测结果 A:Ki67蛋白表达蛋白质印记图;B:Ki67蛋白质相对表达量;C:细胞抑制率。与miR-NC组相比,**P<0.05

图3胃癌SGC-7901细胞侵袭性检测结果 A:transwell小室检结晶紫染色测结果图;B:单位面积细胞侵袭数目。与miR-NC组相比,**P<0.05
2.4 蛋白质印记检测相关蛋白结果
由图4可以看出,相比空白对照组,空白质粒导入组Vimentin、VEGF、E-cadherin、N-cadherin蛋白表达水平无显著差异(P>0.05);相比空白质粒导入组,目的基因组VEGF、E-cadherin蛋白表达水平显著降低(P<0.05),Vimentin、N-cadherin蛋白表达水平显著升高(P<0.05)。

图4蛋白质印记检测相关蛋白结果 A:蛋白质印记图;B:蛋白质相对表达量。与miR-NC组相比,**P<0.05
3 讨论
miR-494位于染色体14q32.31上的mi-RNA[7]。目前段鸿芳等[8]研究证明:其表达水平与肝癌、肺癌、胃肠道肿瘤、脑部肿瘤细胞的增殖、分化、凋亡等密切相关,且在不同的肿瘤组织中表达不同。本研究发现相比癌旁正常组织,胃癌组织细胞中的miR-494表达水平显著降低,李新华等[9]研究表明:miR-494在胃癌组织中的表达显著低于正常组织中的表达,与本研究得出的结论相一致。
增殖细胞周期相关核抗原(Ki67)所编码的基因位于10号染色体上,其分子量为345 kd,是一种细胞核内与细胞分裂增殖相关的蛋白抗原,其表达水平反映细胞增殖的敏感指标同时这种基因在维持结构方面起着重要作[10]。马志君等[11]研究表明:Ki67的表达与细胞增殖密切相关,是调节细胞周期重要组成部分。在胃癌SGC-7901细胞中Ki67的表达量高说明胃癌SGC-7901细胞增殖速度快,反之当胃癌SGC-7901细胞中Ki67表达量低说明胃癌SGC-7901细胞增殖受到抑制。本研究发现:相比空白质粒导入组,目的基因组Ki67的表达水平显著降低,说明miR-494的高表达可以降低Ki67的表达水平,从而实现降低胃癌SGC-7901细胞的增殖。杨庆龙[12]等研究表明,降低Ki67的表达水平,可以抑制胃癌SGC-7901细胞的增殖,与本研究得出的结论相一致。
细胞的侵袭和迁移受到上皮间质转化(epithelial mesenchyml transition,EMT)的调节[13]。EMT是指上皮细胞能暂时丧失细胞极性获得间质细胞移动能力。肿瘤细胞能够通过细胞极性丧失,改变自身细胞形态与其他细胞分离[14-15];N-钙粘蛋白(N-cadherin,CDH2)也被称为钙黏着蛋白-2或神经钙粘着蛋白,是人体由CDH2基因编码的蛋白质。N-钙粘蛋白是在多种组织中表达并起到介导细胞-细胞粘附的功能的跨膜蛋白。付丽梅等[16]研究表明:N-cadherin阳性表达率与癌的浸润深度、分化程度、转移呈正相关,且随着癌症转移的发生N-cadherin蛋白表达量会显著增加。当胃癌SGC-7901细胞的增殖受到抑制时,VEGF表达则会降低,E-cadherin表达水平降低、Vimentin、N-cadherin蛋白表达水平说明胃癌SGC-7901细胞的EMT过程受到抑制,同时其黏附能力增强,运动能力减弱。唐莹等[17]研究表明:Vimentin是一种间质细胞来源的骨架蛋白,在维持间质细胞的特性中这种蛋白起关键的作用。其研究也表明Vimentin表达出现异常时,细胞骨架蛋白的构成也会发生显著的改变,这种改变会导致正常的上皮细胞变成纤维状且易于游动迁移,使得细胞的侵袭、迁移能力增强。EMT晚期时Vimentin表达量通常会显著强加,这也是EMT晚期的显著标志之一[18-19]。胃癌SGC-7901细胞中Vimentin高表达量意味着细胞细胞质间的黏附能力降低,癌细胞的运动能力受到抑制。本实验中可以看出,相比空白质粒导入组,目的基因组VEGF、E-cadherin蛋白表达水平显著降低,Vimentin、N-cadherin蛋白表达水平显著升高,说明miR-494可以通过调节EMT过程使得胃癌SGC-7901细胞的运动能力减弱,同时N-钙粘蛋白也表明细胞质间的黏附能力增加,其运动能力减弱。韩亮等[20]研究表明:通过抑制细胞EMT过程及降低相关蛋白E-cadherin蛋白表达水平,升高Vimentin、N-cadherin蛋白表达水平可以有效降低胃癌SGC-7901细胞的增殖及侵袭能力,与本研究得出的结论相一致。
综上所述,miR-494的表达可以有效降低胃癌SGC-7901细胞的增殖、侵袭及迁移能力。其作用机制可能与抑制相关增殖蛋白Ki67并调节EMT过程有关。但调控胃癌SGC-7901细胞增殖、侵袭及迁移的相关蛋白及信号通路较多,在后续的实验中将进一步探讨miR-494的表达通过信号通路的对胃癌SGC-7901的增殖、侵袭及迁移能力影响机制。
