DGGE法分析酱菜中酵母菌多样性
2019-10-17燕平梅魏爱丽陈燕飞赵文婧
燕平梅,魏爱丽,陈燕飞,赵文婧
(1.太原师范学院 生物系,太原 030619;2.太原师范学院土壤消毒活化 绿色产业技术创新战略联盟,太原 030619)
蔬菜酱制这一加工蔬菜的方法在我国由来已久。由于制作方法简单易学,原料可以直接从当地获得,因此在我国许多地方形成了独具风味的产品。酱菜是常见的发酵食品之一,酱菜的生产主要依赖于微生物发酵的工艺。从发酵酱菜的体系中分离出的微生物有细菌、酵母菌和霉菌类等。其中细菌类的代表菌株是胚芽乳酸杆菌、短杆菌,酵母菌类的代表菌株是假丝酵母、酱油酵母,霉菌类的代表菌株是青霉、白地霉等[1,2]。酱菜不仅可以调节口味,还具有促进肠道消化吸收的作用[3,4]。
研究酱菜中酵母菌多样性的方法有培养法和非培养法。由于培养法在实际操作过程中工作量大且繁琐,故更多的人选择非培养法来研究体系中微生物的多样性。 其中培养法包括磷脂脂肪酸法、生理方法的鉴定系统和分子生物学方法[5]。近年来,分子生态学技术快速发展,受到了广大科研工作者的喜爱。该技术主要通过分析微生物的基因序列信息研究发酵体系中微生物的多样性与功能性[6]。其中DGGE(denaturing gradient gel electrophoresis)技术更是得到了广泛的应用。DGGE技术是由Fischer和Lerman率先提出的[7]。1993年,Muyzer等[8]首次将其应用于微生物生态学研究。目前,DGGE技术被广泛用于环境微生态方面的研究。2015年,赵柏霞等用PCR-DGGE技术研究接种了枯萎病菌后黄瓜根际土壤细菌群落的变化,发现接种枯萎病菌后黄瓜根际土壤细菌的数量及种类发生了较大变化[9]。吕文洲等[10]的研究结果表明,PCR-DGGE技术用于解析油脂废水系统中酵母菌群落结构的可行性。张先琴等[11]用PCR-DGGE技术分析了四川地区家庭制作泡菜中微生物的多样性,结果表明细菌的种类较丰富,而真菌的种类较少。本实验以两种市售的酱菜样品为实验材料,采用PCR-DGGE技术探究酱菜中酵母菌的多样性。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
3袋袋装小青瓜(原料∶青瓜)和3袋袋装酱黄瓜(原料∶青瓜)的混合酱菜,以JA表示;散装酱菜(原料:黄瓜和青瓜),以JB表示。
1.1.2 试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:索莱宝生物有限公司;N,N,N′,N′-四甲基乙二胺、去离子甲酰、过硫酸铵、尿素(均为分析纯):美国AMRESCO公司;2×Taq Master Mix、DH5a感受态细胞:天根生物技术有限公司;引物:由上海生物工程公司合成。
1.2 仪器与设备
TC-96(G)H(b)B Life Touch基因扩增仪 杭州博日科技有限公司;DcodeTM凝胶成像系统、DcodeTM浓度梯度电泳仪 美国Bio-Rad公司;DYY-6C电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 酱菜中微生物基因组DNA的提取
将袋装酱菜编号为JA,散装黑色酱菜编号为JB。首先用灭菌滤纸对酱菜汁进行过滤。两种酱菜汁各取18 mL于9支2 mL的离心管中,8000 r离心5 min。倒尽上清液,收集沉淀,再次离心,倒尽上清液。使用DNA提取试剂盒提取DNA,1%的琼脂糖凝胶检测,于-20 ℃保存。
1.3.2 26S rDNA的PCR扩增
在引物合成公司合成扩增所需的上游引物与下游引物。
上游引物为NL1-GC(cgc ccg ccg cgc ggc ggg cgg ggc ggg ggc gcg ata tca ata agc gga gga aaa g);
下游引物为LS2(att ccc aaa caa ctc gac tc)。
反应体系:PCR Master 12.5 μL,每种引物1 μL,微生物总DNA 1.5 μL,加ddH2O至25 μL。

1.3.3 PCR产物变性梯度凝胶电泳(DGGE)
变性梯度凝胶的配方见表1。
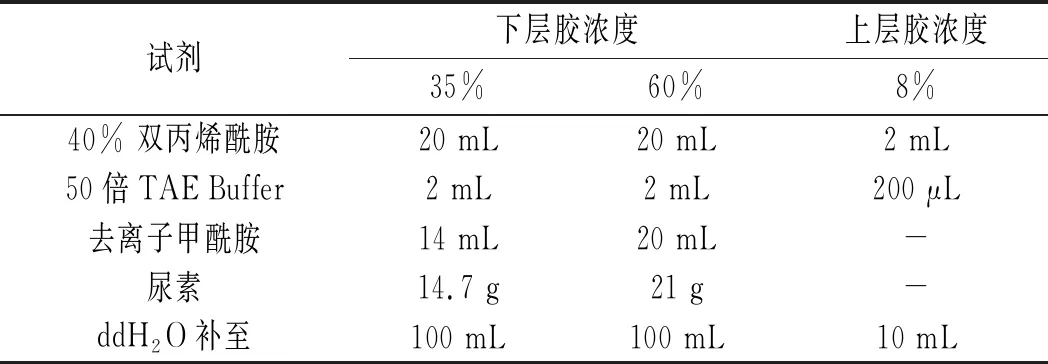
表1 变性梯度凝胶的配方Table 1 Formula of denaturing gradient gel
DGGE电泳后凝胶于Bio-Rad公司的凝胶成像系统分析、拍照。将每条可看到的电泳带切割回收,溶胶后作为模板通过PCR反应扩增26S rDNA 片段,纯化后与pGM-T Vector进行连接, 转化感受态细胞。将检测阳性克隆的样品送到华大基因公司进行基因序列测定。
1.3.4 DGGE图谱分析
使用Quantity One软件分析DGGE凝胶图谱。
计算多样性指数(H)、均匀度指数(D)、丰富度指数(R)。
计算公式:
多样性指数(H)[12]的计算公式:
H=-∑(ni/N)In(ni/N),E=H/InS,R=S-1/InN。
式中:ni为单一条带的峰面积,N为某一泳道所有峰面积,S为某一泳道的总条带数。
1.3.5 系统发育分析方法
将测序结果提交到NCBI中进行比对,通过MEGA 6.0利用Neighbor-Joining法建立26S rDNA片段的系统发育树。
2 结果及分析
2.1 提取DNA的电泳分析
DNA提取后的电泳检测结果和PCR扩增产物的电泳图见图1。

图1 基因组DNA(左)及PCR(右)电泳图Fig.1 Genomic DNA (left) and PCR (right) electrophoretogram
注:JA表示袋装酱菜,JB表示散装酱菜,M表示Marker。
由基因组DNA电泳图1(左)中可知,JA样品与JB样品的DNA条带无非特异带,能够进行PCR扩增反应。 由图1(右)可知,样品DNA片段大小约为270 bp。扩增产物条带清晰,因此可以做DGGE实验。
2.2 变性梯度凝胶电泳结果
PCR扩增产物 DGGE 凝胶电泳分析结果见图2。

图2 DGGE 电泳图谱Fig.2 DGGE electrophoretogram
由DGGE图谱可知,凝胶图谱中条带的位置、粗细以及亮暗程度有一定的差异。JA样品有3个条带,分别是JA-2、JA-1、JA-3,表明JA样品有3种酵母菌。JB样品有2个条带,分别是JB-1、JB-2,表明JB样品有两种酵母菌。其中JA-1和JB-1、JA-3和JB-2位置一致,表明两个样品中有同种酵母菌。JA-2较粗较亮,说明该种酵母菌含量较高。
2.3 酱菜微生物26S rDNA片段的DGGE图谱分析
2.3.1 酱菜微生物群落结构特征
使用Quantity One软件分析DGGE凝胶图谱可知(见表2),JA样品与JB样品的均匀度指数无显著差异(P>0.05)。JA样品的多样性指数和丰富度指数显著大于JB样品(P<0.05),表明JA样品的酵母菌种类较丰富。

表2 酵母菌微生物群落结构特征Table 2 Structural characteristics of yeast microbial community
2.3.2 酱菜不同发酵时间酵母菌类型的聚类分析
运用Quantity One软件的“phylogenetic analysis”方式,根据UWPGA算法对两种酱菜酵母菌群落结构进行相似性聚类分析。由图3可知,两种酱菜样品的酵母菌群落结构聚于一个大分支。
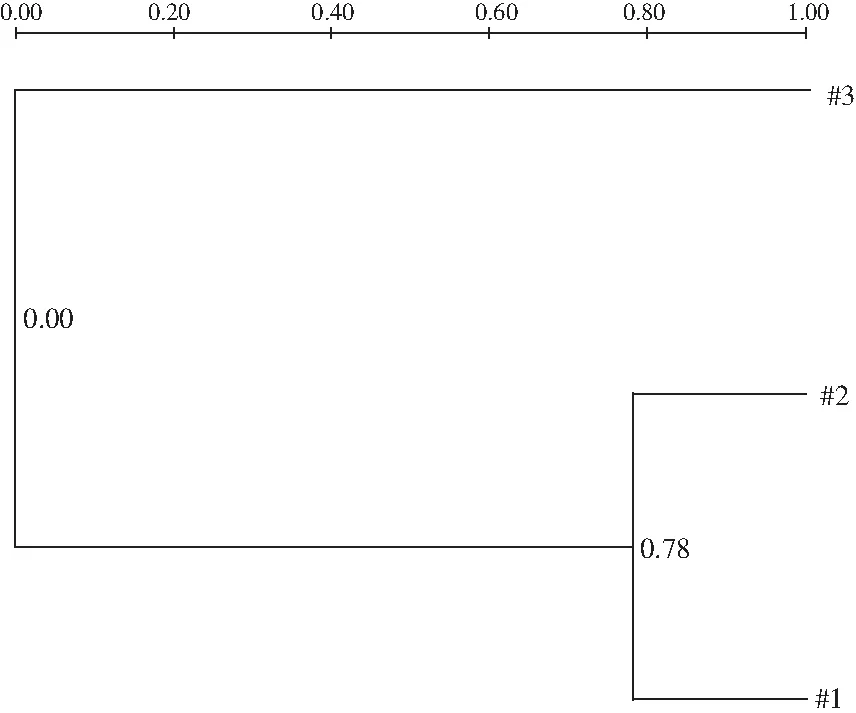
图3 两种酱菜26S rDNA 片段的DGGE条带 相似性聚类图Fig.3 DGGE band similarity clustering map of 26S rDNA fragments of two kinds of pickles
2.3.3 DGGE回收电泳带的鉴定
为了研究发酵酱菜体系中优势的微生物种类,实验中回收荧光强度强、不同时间差异的电泳带,通过基因扩增反应后测定碱基序列,与GenBank 库序列对比鉴定。发酵酱菜样品DGGE条带序列结果见表3。

表3 酱菜酵母菌的DGGE条带序列结果Table 3 DGGE band sequencing results of yeasts in pickles
电泳条带JA-2、JB-1、JB-2分别与Pichiafermentans(乳源酵母)、Candidatropicalis(热带假丝酵母)、Candidatropicalis(热带假丝酵母)的菌株相似,相似度约为88%、98%、98%。
2.4 系统发育树分析
使用MEGA 6.0软件利用Neighbor-Joining法建立26S rDNA片段的系统发育树,对其进行系统发育分析,见图4。

图4 酱菜样品中酵母菌系统发育树Fig.4 Phylogenetic tree of yeasts in pickle samples
3 结论
本实验以两种市售酱菜为研究对象,通过PCR-DGGE方法分析了这两种酱菜中酵母菌的多样性。发现样品JA比样品JB的酵母菌种数大,发酵酱菜中的酵母菌总共有3个属,热带假丝酵母(Candidatropicalis)为优势菌种。两个样品的微生物群落结构没有明显的差异。2011年,高秀芝等[13]用PCR-DGGE法分析了天源酱园豆酱发酵过程中微生物多样性。研究表明,发酵过程中主要的细菌优势种是地衣芽孢杆菌(Bacilluslicheniformis)和未培养明串珠克隆(UnculturedLeuconostocsp. clone),主要的真菌优势种是米曲霉(Aspergillusoryzae)。2014年乌日娜等[14]用PCR-DGGE法分析了东北自然发酵酸菜中的生物多样性。结果表明,酸菜中的真菌种类比较少,细菌种类较多。主要的真菌菌种有汉逊德巴利(Debaryomyceshansenii)、热带假丝酵母(Candidatropicalis)等。
培养法和非培养法二者都可以用来研究发酵体系微生物的多样性。培养法是通过配制满足目的微生物基本生长需求的培养基,使目的微生物在培养基上生长与繁殖的方法,这种方法可能会出现在发酵体系中大量存在的微生物在培养基上无法正常培养或生长的情况,导致研究结果出现偏差。因此更多的人选择工作量小且能够较真实地反映发酵体系中微生物多样性的非培养法[15],即基于PCR的DGGE技术。2008年, Chang Ho-Won等[16]用PCR-DGGE技术研究细菌、古细菌和酵母在不同类型泡菜中的发酵动力学。根据DGGE的原理,该方法可以分离长度相同但碱基序列不同的DNA片段。 DGGE图谱中条带的位置、数量和亮暗程度可以反映出样品中微生物多样性的信息[17]。
