Sedlin突变体的表达及其与RB1在细胞中的共定位
2019-10-16潘林鑫范礼斌刘晓颖
何 叶,潘林鑫,张 永,范礼斌,刘晓颖
迟发性脊椎骨骺发育不良基因(spondyloepiphyseal dysplasia tarda,SEDL)编码的Sedlin蛋白在内质网-高尔基体中间体(ER-golgi intermediate compartment, ERGIC)囊泡运输中发挥关键作用[1-2]。分析X-连锁迟发性脊椎骨骺发育不良(spondyloepiphyseal dysplasia tarda,SEDT)病例,结果显示患者SEDL发生多种突变,导致Sedlin蛋白定位异常,且Sedlin蛋白羧基端的完整有利于其在ERGIC的定位,突变最终导致软骨发育功能异常[3-4]。
最普遍的调节蛋白质活力及功能的方式是蛋白质磷酸化,酪氨酸位点的磷酸化除了在变构及激活该蛋白的活力外,更重要的是促进其和结合蛋白相互作用而形成多蛋白复合体[5]。本实验室前期已证实Sedlin与视网膜母细胞瘤蛋白(RB1)在哺乳动物细胞内存在相互作用[6],该研究旨在探讨Sedlin的C端缺失及磷酸化位点突变是否影响Sedlin的亚细胞定位及其与RB1的共定位。
1 材料与方法
1.1 材料
1.1.1细胞、质粒和菌株 本实验所用的COS7细胞、HEK 293T细胞,载体pCDGFP、pGEX-3X,Sedlin相关质粒,TG1、BL21、DH5α菌株等均为本实验室保存。
1.1.2主要试剂 PrimeSTAR酶(日本TaKaRa公司);BamH I、EcoR I限制性内切酶、T4 DNA连接酶、Dpn I酶;DMEM高糖培养基(北京赛默飞世尔科技有限公司);质粒提取试剂盒(美国OMEGA公司);胎牛血清(美国Hyclone公司);Lipofectamine 2000、Opti-MEM(美国Invitrogen公司);GFP抗体(美国Santa Cruz公司);FLAG抗体(美国Sigma公司);细胞裂解液(上海碧云天生物技术有限公司);SuperSignal West Pico显色试剂盒(美国Pierce公司);IPTG、PMSF、辣根过氧化物酶标记的山羊抗小鼠IgG和TRITC标记山羊抗小鼠IgG(北京中杉金桥生物技术有限公司);谷胱甘肽琼脂糖球珠(美国GE Healthcare公司);荧光封片胶(丹麦DAKO公司);荧光显微镜(德国Carl Zeiss Jena公司)。
1.2 方法
1.2.1Sedlin缺失突变体和点突变体的序列扩增[6]以Sedlin全长cDNA序列为模板,25 μl PCR体系进行扩增:模板DNA 10 ng(0.5 μl),上下游引物浓度均为20 pmol/μl(0.5 μl),Prime STAR酶12.5 μl,ddH2O 11 μl。
1.2.2Sedlin缺失突变体的构建[6]对上述扩增产物进行电泳,凝胶试剂盒进行回收,将得到的PCR产物用限制性内切酶BamH I和EcoR I进行双酶切,并同样双酶切pCDGFP载体、pGEX-3X载体,将酶切后的产物用T4 DNA连接酶连接(16 ℃ 连接约12 h),然后转化TG1感受态细胞并平板培养; 10 h后选取单克隆挑菌,37 ℃恒温振荡培养12 h进行质粒抽提,最后用BamH I和EcoR I进行酶切鉴定;选酶切鉴定正确的质粒送公司测序。
1.2.3Sedlin点突变体的构建[6]20 μl扩增产物加入Dpn I酶1.5 μl,37 ℃ 水浴2 h,转化DH5α感受态细胞,平板培养约12~16 h后,挑取单克隆37 ℃振荡过夜培养;最后抽提质粒并进行双酶切鉴定,选取酶切鉴定正确的质粒送公司测序。
1.2.4细胞培养及转染 用含有100 U/ml青、链霉素及5%胎牛血清的DMEM高糖培养基于37 ℃、5%CO2的恒温培养箱中培养COS7细胞、HEK 293T细胞。细胞长满单层时传代,次日将重组质粒(μg) ∶Lipofectamine 2000按1 ∶2的比例转染至HEK 293T细胞,用于检测蛋白表达;将重组质粒(μg):Lipofectamine 2000按1 ∶1.5转染至COS7细胞,用于免疫荧光实验。
1.2.5GST-SedlinN、GST-Sedlin-Y115A、GST-Sedlin-Y115F融合蛋白的表达及纯化 把pGEX-3X-SedlinN/Y115A/Y115F重组质粒转化至BL21感受态细胞,挑取单克隆至含有氨苄抗性的2 ml LB培养基中,37 ℃ 振荡培养12 h;取50 μl菌液到含有氨苄抗性5 ml LB中扩大培养,当OD600值达0.4~0.6范围时再按照GST-Sedlin融合蛋白的最佳诱导条件摸索制备GST-SedlinN、GST-Sedlin-Y115A、GST-Sedlin-Y115F的诱导条件,按照最佳条件诱导(pGEX-3X-SedlinN为0.05 mmol/L的IPTG,16 ℃诱导12 h,pGEX-3X-Sedlin-Y115A、pGEX-3X-Sedlin-Y115F为0.01 mmol/L的IPTG,30 ℃ 诱导4 h),诱导结束后收集细菌并用含终浓度0.1 mmol/L的PMSF和DTT的细菌裂解液裂解约30 min,再适当超声以促进细胞裂解;4 ℃ 、14 000 r/min离心20 min,取上清液,每管1 ml分装至1.5 ml EP管,保存于-80 ℃。取1份制备好的融合蛋白用谷胱甘肽琼脂糖球珠对其进行纯化并制成样品,SDS-PAGE电泳,考马斯亮蓝染色后凝胶成像仪拍照,检测融合蛋白是否成功诱导表达。
1.2.6Western blot法检测蛋白表达 转染48 h后收集细胞,加适量细胞裂解液,4 ℃ 孵育25~30 min,4 ℃ 、14 000 r/min离心20 min,取适量蛋白样品进行SDS-PAGE电泳;100 V电转1 h;PVDF膜于5%脱脂奶粉中封闭1.5 h,TBST洗膜(10 min、3次),GFP兔抗(1 ∶1 000)4 ℃ 孵育过夜,TBST洗膜(10 min、3次),二抗(1 ∶5 000)室温孵育2 h,TBST洗膜(10 min、3次),ECL显影。
1.2.7免疫荧光实验 转染后约24 h取出COS7细胞爬片,用PBS清洗细胞(5 min、3次),-20 ℃的甲醇固定5 min,再用70%乙醇溶液固定细胞5 min,PBS清洗(5 min、3次);1%脱脂奶粉封闭30 min,FLAG一抗室温孵育2 h,TRITC标记的山羊抗小鼠IgG孵育1 h;DAPI染核2 min,PBS清洗细胞(5 min、3次),DAKO封片胶封片;荧光显微镜下观察、拍摄。
2 结果
2.1 Sedlin突变体重组质粒的酶切鉴定和测序结果分别对重组质粒pGEX-3X-SedlinN/Y115A/Y115F和pCDGFP-SedlinN/Y115A/Y115F进行双酶切(BamH I、EcoR I),结果见图1A、1B。各重组质粒均被切成两条带,一条带与载体大小一致(A载体为pGEX-3X,约4 900 bp;B载体为pCDGFP,约6 100 bp),另一条带与目的片段大小一致(SedlinN为330 bp,Sedlin-Y115A/Y115F为420 bp)。上述质粒的测序结果经比对,证实各质粒成功构建,见图1C、1D。
2.2 Sedlin突变体在原核细胞中的表达分别转化pGEX-3X-SedlinN/Y115A/Y115F质粒至BL21菌株,经IPTG诱导培养后,收集菌体进行裂解,经谷胱甘肽琼脂糖珠子纯化后进行SDS-PAGE电泳,考马斯亮蓝染色结果显示,纯化后的样品分别在约37 ku(图2A)和40 ku(图2B)的位置出现很强的蛋白条带,大小符合GST-SedlinN、GST-Sedlin-Y115A、GST-Sedlin-Y115F融合蛋白,表明融合蛋白表达成功。
2.3 Sedlin突变体在HEK 293T细胞中的表达转染后约48 h,收集细胞并进行裂解,将细胞总蛋白进行Western blot检测,结果显示转染了pCDGFP-SedlinN/Y115A/Y115F的细胞裂解液均能检测到条带,与预染的蛋白Marker对比,过表达的pCDGFP-SedlinN分子量为39 ku,点突变体pCDGFP-Sedlin-Y115A、pCDGFP-Sedlin-Y115F的分子量约为42 ku,与野生型pCDGFP-Sedlin的分子量一致,表明Sedlin突变体在HEK 293T细胞中正常表达。见图3。
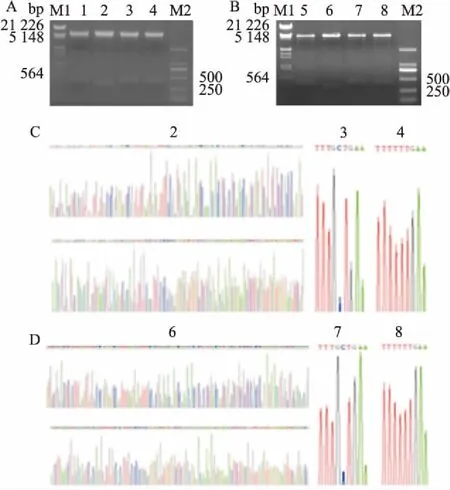
图1 重组质粒的酶切鉴定及测序结果图
A、B:重组质粒的酶切鉴定图;C、D:重组质粒的测序结果图;M1:Lambda DNA/EcoR I+HindⅢ Marker;M2:TaKaKa DL2000 Marker;1:pGEX-Sedlin的酶切鉴定结果;2:pGEX-SedlinN的酶切鉴定结果及测序图;3:pGEX-Sedlin-Y115A的酶切鉴定结果及测序图;4:pGEX-Sedlin-Y115F的酶切鉴定结果及测序图;5:pCDGFP-Sedlin的酶切鉴定结果;6:pCDGFP-SedlinN的酶切鉴定结果及测序图;7:pCDGFP-Sedlin-Y115A的酶切鉴定结果及测序图;8:pCDGFP-Sedlin-Y115F的酶切鉴定结果及测序图
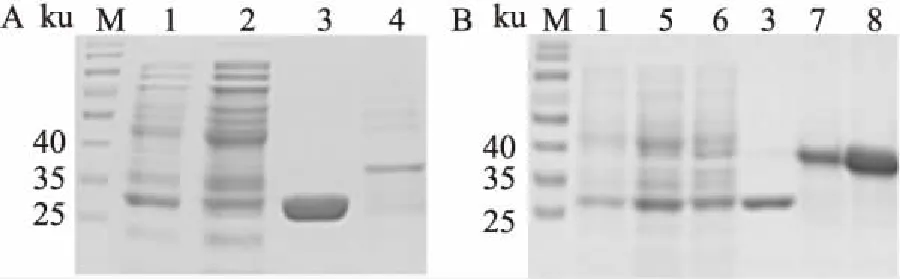
图2 考马斯亮蓝染色检测谷胱甘肽琼脂糖球珠纯化后的融合蛋白
M:标准蛋白Marker梯度;1:GST的细菌裂解液;2:GST-SedlinN的细菌裂解液;3:GST的纯化蛋白;4:GST-SedlinN的纯化蛋白;5:GST-Sedlin-Y115A的细菌裂解液;6:GST-Sedlin-Y115F的细菌裂解液;7:GST-Sedlin-Y115A的纯化蛋白;8:GST-Sedlin-Y115F的纯化蛋白
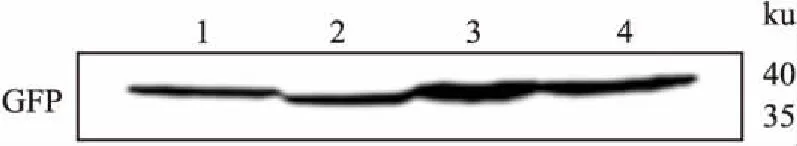
图3 Sedlin突变体蛋白在哺乳动物细胞中的表达
1:转染pCDGFP-Sedlin的HEK 293T细胞裂解液;2:转染pCDGFP-SedlinN的HEK 293T细胞裂解液;3:转染pCDGFP-Sedlin-Y115A的HEK 293T细胞裂解液;4:转染pCDGFP-Sedlin-Y115F的HEK 293T细胞裂解液
2.4 Sedlin突变体蛋白在COS7细胞中的定位分别单转Sedlin突变体pCDGFP-SedlinN/Y115A/Y115F至COS7细胞中,然后进行免疫荧光制片、显微拍摄,结果显示它们在细胞核与细胞质中均有表达,且细胞核表达量较高,见图4A,这一结果与野生型Sedlin的定位基本一致,见图4B。表明Sedlin的C端缺失后,以及C端磷酸化位点突变后并未影响其亚细胞定位。
2.5 Sedlin突变体蛋白与RB1蛋白的共定位分别共转Sedlin突变体质粒pCDGFP-SedlinN/Y115A/Y115F与pcDNA3.1-FLAG-RB1至COS7细胞中,进行免疫荧光制片、显微拍摄,结果显示它们与RB1蛋白在核内均存在明显的共定位,表明Sedlin的C端缺失后,以及C端磷酸化位点突变后并未影响其与RB1的共定位(图5A、5B),提示Sedlin的N端可能是与RB1相互结合的重要结构域。
3 讨论
SEDT是一种软骨发育功能障碍疾病,病变主要累及身体承重大关节,以退行性大关节炎和短躯干性侏儒为主要临床表现[1]。SEDT为X-连锁隐性遗传,具有高度遗传性[7]。高度保守的Sedlin蛋白,在心脏、肾脏、骨骼肌等组织中均有分布。相关定位研究[8]表明Sedlin蛋白在哺乳动物细胞COS7中与ERGIC在细胞核周围有部分共定位现象。现阶段研究普遍认为SEDT的发病原因可能是SEDL基因突变导致Sedlin功能异常,软骨细胞不能正常分泌细胞外基质,进而引起骨骼发育异常。SEDT相关的Sedlin突变不会导致亚细胞定位的异常,但涉及疏水核心内残基的突变会导致其与转录因子MBP1、PITX1和SF1相互作用的丧失[9]。Sedlin的二聚化及其核定位表明哺乳动物Sedlin的其他作用;据报道其与酵母中的Sedlin同源物Trs20p已经作为TRAPP复合物中的单体存在[10],其中Sedlin在内质网-高尔基体的膜泡转运中发挥重要作用。人Rb1基因全长178 143 bp,定位于染色体13q14,编码约104~110 ku的核内磷酸化蛋白pRb[11]。RB1蛋白几乎在所有正常细胞中表达,但表达量存在组织和发育阶段的差异,在视网膜、心脏和肌肉中较高,肝脏、胸腺和脑中较低,且随年龄的增长,表达量在各组织中均有显著下降。RB1蛋白具有包括参与细胞周期、细胞分化、细胞凋亡的调控等功能,RB1的抑癌作用与这些功能的正常发挥密不可分[12]。
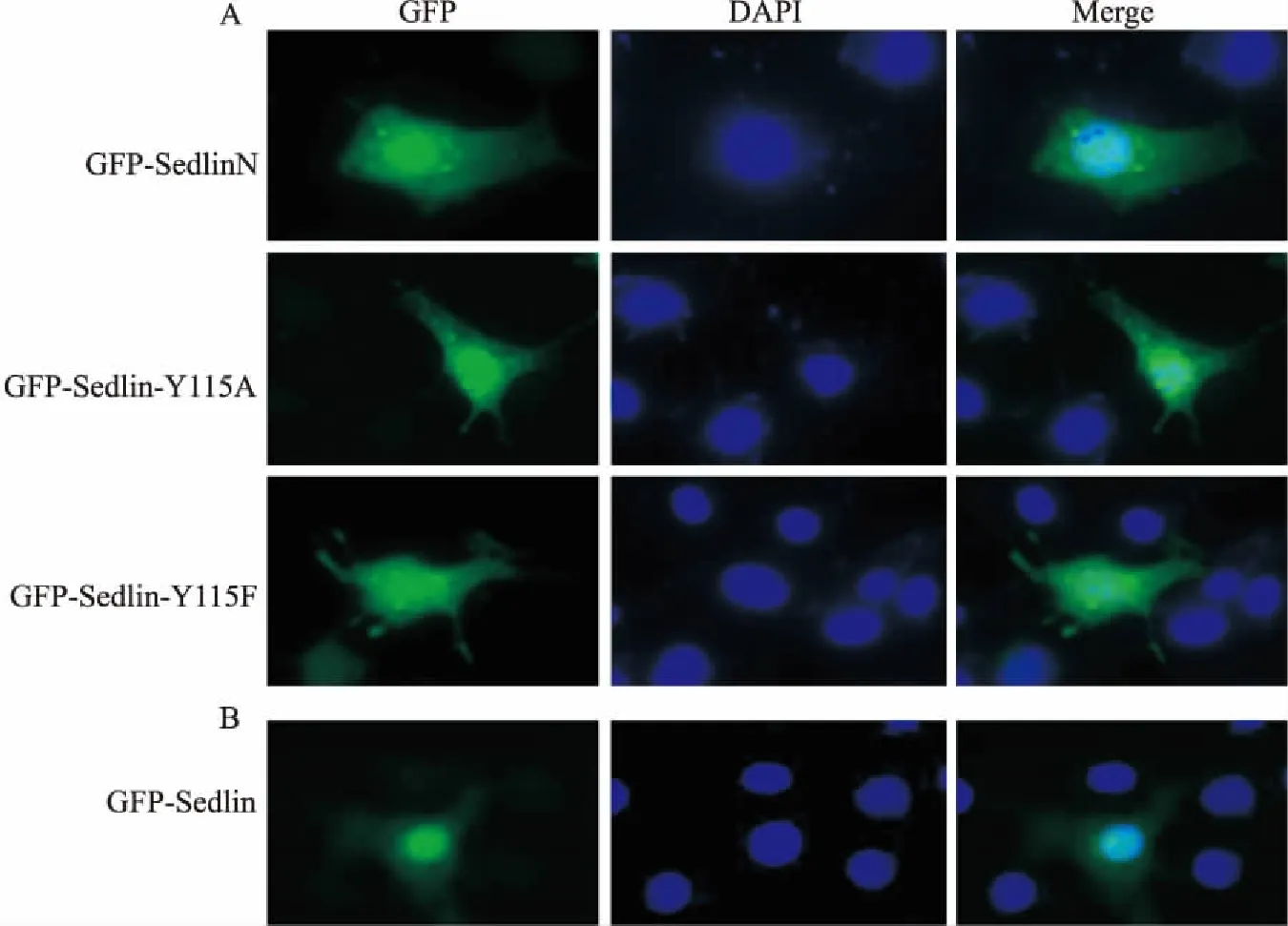
图4 Sedlin及其突变体蛋白在COS7细胞中的定位
A:Sedlin突变体蛋白(SedlinN/Y115A/Y115F)在COS7细胞中的定位;B:Sedlin蛋白在COS7细胞中的定位;GFP:显示含GFP标签的蛋白;DAPI:显示染色的细胞核;Merge:叠加效果
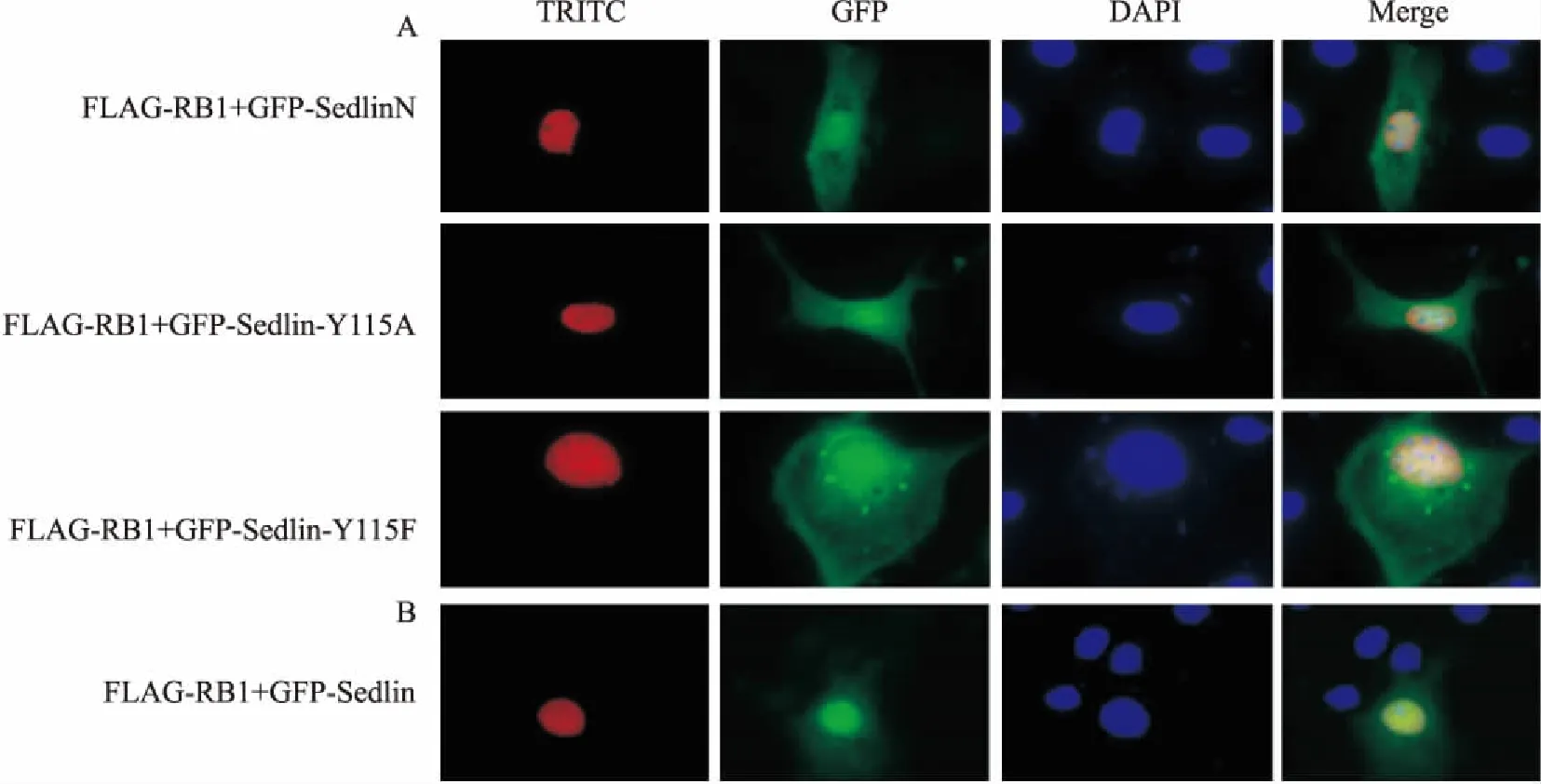
图5 Sedlin突变体蛋白与RB1蛋白在COS7细胞中的共定位
A:Sedlin突变体蛋白(SedlinN/Y115A/Y115F)与RB1蛋白在COS7细胞中的共定位;B:Sedlin蛋白与RB1蛋白在COS7细胞中的共定位;TRITC:含FLAG标签的RB1蛋白;GFP:显示含GFP标签的蛋白;DAPI:显示染色的细胞核;Merge:叠加效果
本研究通过构建pCDGFP-SedlinN、pCDGFP-Sedlin-Y115A、pCDGFP-Sedlin-Y115F真核表达质粒,并将其分别转染至COS7、HEK 293T细胞,比较 Sedlin突变体相对于野生型在真核细胞内的表达和定位改变。鉴于本课题组前期已证实野生型Sedlin蛋白与RB1蛋白存在共定位,所以又分别将上述几个质粒与FLAG-RB1质粒共转至COS7细胞中,了解Sedlin突变体蛋白与RB1蛋白的共定位情况。将Sedlin的三个突变体构建到原核表达载体pGEX-3X中,诱导表达GST融合蛋白,通过SDS-PAGE电泳检测融合蛋白表达情况。
构建的两个点突变体在DNA水平条带大小相对于野生型而言无明显变化,只是DNA序列中对应位置碱基种类发生变化,而总的碱基数不变,除了Tyr115Phe、Tyr115Ala突变体以外,常见的Sedlin突变体还有Asp47Tyr、Ser73Leu、Phe83Ser和Val130Asp,根据相关文献[9]中对Sedlin三维结构分析得知,Sedlin突变体(Ser73Leu、Phe83Ser、Val130Asp)位于Sedlin的疏水核心结构域内,因此可能会影响 Sedlin的结构完整性以及与其他蛋白的相互作用。例如,极性Ser73到Leu73的突变将导致疏水性沟槽的破坏从而导致氢键的损失。类似地,Phe83和Val130残基处于疏水区域内蛋白质的内部,这些非极性残基突变为极性残基(分别为丝氨酸和天冬氨酸)可能会破坏疏水核心内的相互作用,导致Sedlin的错误折叠,这将破坏蛋白质-蛋白质相互作用[9]。
pCDGFP-SedlinN、pCDGFP-Sedlin-Y115A、pCDGFP-Sedlin-Y115F几个突变体在HEK 293T细胞里均有表达,且缺失突变体的蛋白分子量低于野生型及其点突变体,但是分子量变化不大,这是因为SEDL基因的编码区423 bp,而编码Sedlin的缺失突变体(N端)的基因有339 bp,结果证明缺失了Sedlin的C端以后Sedlin的缺失突变体(N端)依然能正常表达。免疫荧光结果显示突变体pCDGFP-SedlinN/Y115A/Y115F在细胞质与细胞核中均有表达,与野生型Sedlin的定位情况基本一致,表明上述突变均不会改变Sedlin蛋白的亚细胞定位,结合本文中上述免疫荧光实验结果证明的RB1蛋白与SedlinN/Y115A/Y115F突变体蛋白在COS7中均存在共定位,说明Sedlin的第115位氨基酸(磷酸化位点)突变后(Tyr115Phe、Tyr115Ala)并不会导致其与RB1蛋白共定位的改变;同时由于RB1蛋白与SedlinN蛋白存在共定位情况,可以得出初步结论:Sedlin蛋白与RB1蛋白相互作用的部位可能是Sedlin蛋白的N端。
本研究重点关注Sedlin的3个突变体蛋白的表达及其与RB1蛋白在细胞内的共定位情况,将为本课题组后续研究Sedlin与RB1相互作用的详细机制提供依据,为进一步揭示人类Sedlin蛋白在细胞中的作用机制、与相关疾病的关系等奠定一定的基础。
