外周血前列腺癌抗原3基因检测对前列腺癌诊断的meta分析 *
2019-10-16李小珍
闫 瑾,李小珍,杨 飞
(1.西安交通大学第二附属医院健康体检部,西安 710004; 2.西安交通大学第一附属医院泌尿外科研究所,西安 710061)
前列腺癌严重危害男性生命健康,是全球男性癌症发病率排第二位,仅次于肺癌,死亡率排第五位的恶性肿瘤,在中国前列腺癌发病率及病死率均居男性泌尿生殖系统肿瘤之首[1]。其预后与诊断早晚密切相关,直肠指诊和血清前列腺特异性抗原(prostate specific antigen,PSA)检测相结合虽然是目前公认的前列腺癌早期诊断的最佳方法,但是二者均具有一定的局限性和弊端,此种早期诊断方法易导致前列腺穿刺活检阴性的比例很大,常需重复检测和二次活检,会使男性感到异常焦虑。前列腺癌抗原3(prostate cancer antigen 3,PCA3)是一种长链非编码RNA,近年来研究发现PCA3与前列腺癌发生发展关系非常密切,被认为是目前早期诊断前列腺癌最佳的特异性基因,将来有望与血清PSA检测相结合成为新的前列腺癌特异性诊断标志物[2]。本次meta分析系统评价外周血PCA3检测对前列腺癌的诊断效能,为应用于临床提供循证医学依据。
1 材料与方法
1.1 材料来源
1.1.1 文献来源:计算机检索Medline,Embase,Cochrane Library,CNKI,WANFANG等国内、外数据库,检索截止时间均设定2018年12月,检索语言限制为中文和英文,研究对象限制在人类,并将综述、信件、病例报告及评论类型的文章排除。检索策略参考《The Bayes Library of Diagnostic Studies and Reviews》制定。为尽量避免漏查文献,对纳入研究的参考文献进行再次检索。
1.1.2 纳入和排除标准:纳入标准:①研究类型:队列研究或病例对照研究,不考虑是否采用随机化或盲法;②研究对象:病理诊断确诊前列腺癌且之前未接受过内分泌治疗、化疗或手术治疗的患者,以良性前列腺增生症患者或其他泌尿系良性疾病患者或正常健康成年男性作为对照;③待评价诊断试验:外周血PCA3检测;④诊断金标准:组织病理学诊断;⑤数据提取标准:能从原始研究中直接提取或间接通过诊断试验评价指标的相关公式计算得出完整诊断试验四格表数据。排除标准:①研究对象纳入诊断试验研究前已接受过内分泌治疗、化疗或手术治疗;②诊断金标准非组织病理学诊断;③诊断试验为检测尿液、前列腺液等非外周血PCA3的研究;④研究无法直接提取或通过计算获得诊断试验完整四格表数据;⑤重复发表的研究或同一研究所用数据有重复;⑥依据原始文献表中数据计算得出的结果与原始文献中统计学分析结果不一致或原始文献表中数据本身计算错误。
1.2 方法
1.2.1 检索策略:中文检索词为“前列腺癌”、“前列腺肿瘤”、“前列腺癌抗原3”、“差异显示编码3”和“诊断试验”,英文检索词以“Prostate cancer”,“Prostate carcinoma”,“Diagnostic Test”等为MeSH主题词,以PCA3,DD3,Prostate cancer antigen 3等为自由词。由两名评价者独立按照预先制定的纳入和排除标准提取文献数据并交叉核对, 如结果不一致, 通过协商或与第三者讨论解决。录入数据包括:作者、确诊标准、纳入样本例数、真阳性、假阳性、假阴性、真阴性、敏感度及特异度。
1.2.2 文献评价:采用RevMan 5.0软件对纳入研究方法学质量进行评价,根据Cochrane协作网诊断准确度试验方法学质量评估(quality of reporting of meta-analysis,QUORUM)指南[3]所提供的11项评价条目及其相关内容解释,由两名评价员独立提取资料和评价文献方法学质量。参考JADAD等[4]质量评分标准,对每个条目进行评分。若评价不一致者,经讨论决定。
1.3 统计学分析 应用Meta-Disc 1.4软件进行异质性检验(Spearman相关系数判断阈值效应,Q检验及I2统计量定量评估非阈值效应),根据异质性检验结果选用相应效应模型(如存在异质性,则采用随机效应模型对准确度指标进行汇总处理,反之则采用固定效应模型。检验水准为α=0.05)评估合并效应指标,敏感度和特异度采用卡方检验,阳性似然比和阴性似然比采用Q检验,应用Stata 12.0软件通过线性回归法评估发表偏倚。
2 结果
2.1 文献基本信息 按照预先制定的文献检索策略,共获得相关文献865篇,初筛排除不符合纳入标准文献832篇,余下33篇可能符合要求文献,获取全文逐一仔细阅读和分析文献资料,按照排除标准排除不符合要求文献22篇,最终纳入本次meta分析的原始文献为11篇。纳入研究基本资料见表1,诊断试验相关数据见表2。

表1 纳入研究基本资料
2.2 质量评价 根据Cochrane提出的评价标准对纳入的11项研究进行方法学质量评价,结果显示10项研究评分在16~22分,为高质量研究,1项研究评分为15分,为低质量研究。
2.3 meta分析结果
2.3.1 异质性检验:Spearman相关系数为0.027,P=0.937>0.05,提示不存在阈值效应,见图2。合并各项研究的诊断比数比绘制森林图Cochran-Q=24.41,P=0.0066<0.05,I2=59.0%,提示存在非阈值效应所致的中度异质性,见图3。

表2 纳入研究诊断四格表数据、敏感度及特异度(n)

注:“+”表示“是”,“-”表示“否”,空白项表示“不确定”。

图2 阈值效应计算结果 图3 诊断比数比森林图
2.3.2 敏感度和特异度森林图:根据异质性检验结果采用随机效应模型对数据进行合并分析。PCA3检测诊断前列腺癌的合并敏感度为0.58,95% CI[0.53,0.63],见图4;合并特异度为0.94,95% CI[0.92,0.96],见图5。
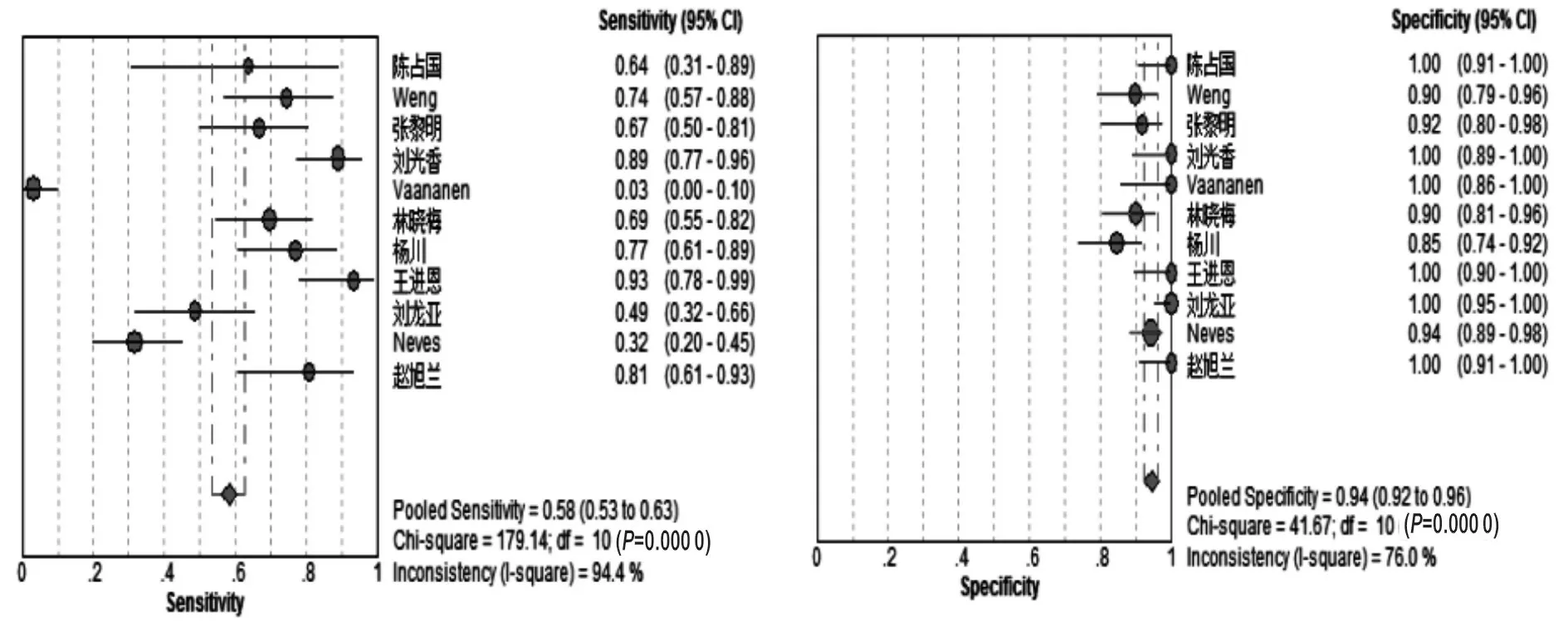
图4 敏感度森林图 图5 特异度森林图
2.3.3 阳性似然比和阴性似然比的森林图:根据异质性检验结果采用随机效应模型对数据进行合并分析。合并阳性似然比为8.96,95% CI[5.22,15.40],见图6;合并阴性似然比为0.32,95% CI[0.16,0.67],见图7。

图6 阳性似然比森林图 图7 阴性似然比森林图
2.3.4 SROC曲线:根据异质性检验结果采用随机效应模型对数据进行合并分析。SROC曲线呈对称分布,其曲线下面积AUC为0.937 9±0.034 6,Q指数为0.874 9±0.043 3,见图8。
2.3.5 发表偏倚:应用线性回归法检验漏斗图不对称性,各研究沿回归线两侧基本呈对称性分布,斜率系数的P=0.149>0.10,提示Deeks漏斗图对称,不存在发表偏倚,见图9。

图8 SROC曲线 图9 Deeks漏斗图
3 讨论
目前临床上前列腺癌筛检和监测最主要的两种手段,即直肠指检及血清PSA检测受影响因素很多。直肠指检缺乏客观标准且易受肿瘤在前列腺中的位置、大小及医生的个人经验等的影响,因此有相当一部分早期前列腺癌无法被诊断[16],而PSA检测结果受很多其他因素如年龄、种族、地区、前列腺增生症、前列腺炎等的影响[17-19]。已有研究证实尿液PCA3检测是准确度较高的前列腺癌诊断方法,RUIZ-ARAGON等[20]进行的一项关于尿液PCA3试验的Meta分析共纳入14项研究,均为高质量研究,敏感度范围为46.9%~82.3%,特异度范围为56.3%~89%,合并敏感度为85%,95% CI [84%,87%],合并特异度为96%,95% CI[96%,97%],合并阳性似然比为22.21,95% CI [15.12,32.63],合并阴性似然比为0.15,95% CI [0.13,0.18],研究证明尿液PCA3试验用于前列腺癌的诊断具有很高的准确度。对于外周血PCA3检测的应用尚有争议,因此我们通过meta分析定量描述外周血PCA3检测的应用价值。
本次meta分析结果与已经应用于临床的尿液PCA3检验meta分析结果比较显示,外周血PCA3检验虽然在敏感度方面不及尿液PCA3检验,但特异度更高,未来联合血清PSA等敏感度高的前列腺肿瘤标志物检验可应用于临床对早期前列腺癌作出正确诊断。为提高前列腺癌诊断的检出率和准确度联合检测成为研究热点,此前已有研究[21]报道同时测定55例患者PSA和SIL-2R值作为肿瘤病人的辅助诊断及判断愈后的指标明显优于单一PSA检测。
综上所述,本次meta分析结果虽然提示外周血PCA3检验对前列腺癌的诊断效能总体较高,临床应用价值较高,但仍需更进一步的研究,包括纳入多中心、大样本的前瞻性队列研究系统评价、确定标准的检测方法和试剂、摸索制定统一的试验方案、选择合理的诊断临界值、进一步评价其临床实用性和进行成本-效益分析等,尚需对外周血PCA3检验应用于临床早期前列腺癌诊断予以进一步评价。
