MiR-126影响口腔鳞癌细胞增殖和迁移的研究
2019-10-16李玉梅杨波刘秦川
李玉梅 杨波 刘秦川
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是世界范围内常见的人类恶性肿瘤之一,并且近年来其发病率呈现上升趋势。据统计,每年因口腔鳞癌而死亡的人数超过400 000人,其中80%的死亡人口来自发展中国家[1]。随着对口腔鳞癌研究的深入,目前的观点认为口腔鳞癌是由致癌物引发的一个多因素、多步骤的复杂生物学过程,其中癌症相关基因的改变在这一过程中具有重要作用。研究者普遍认为癌症相关的基因变化来自于遗传信息的丢失、突变或过表达[2]。microRNAs(miRNA)是一类长度约为22nt的非编码RNA,通常在转录后水平调控靶基因表达[3]。许多miRNA参与了重要的生物学过程,例如细胞分化以及上皮细胞向间充质细胞转化(epithelial to mesenchymal transition,EMT)等。目前的研究发现在许多肿瘤组织中,均发生了miRNA的含量改变[4]。但目前对于口腔鳞状细胞癌与miRNA表达改变的报道较少,目前已经发现了一些与口腔鳞癌的发生和发展存在一定联系的miRNA,其中包括miR-34b,miR-100,miR-125b miR-137,miR-193a和miR-203等。与正常口腔黏膜组织相比,这些miRNA的表达含量在口腔鳞癌中发生特异性的改变[5]。此外,多项研究证明miR-126的含量在结肠癌、胃癌以及恶性血液肿瘤中发生了显著改变[6-8]。但是miR-126是否参与了口腔鳞癌细胞的生物学功能过程,目前尚未有文献报道。本研究检测miR-126在口腔鳞癌以及正常口腔黏膜组织中的表达水平差异,并改变口腔鳞癌细胞中miR-126的表达水平来观察其在增值、迁移方面的变化,进而探究miR-126在口腔鳞癌中可能的作用并为临床诊疗提供新的思路。
1 材料与方法
1.1 材料
自2010-08~2017-06共收集于汉川市人民医院口腔科确诊的18例口腔鳞癌患者的鳞癌标本及周边非癌变口腔黏膜组织,所有收集标本均经病理检查明确诊断及肿瘤细胞恶性程度判定。8例正常口腔黏膜标本来自正常成年志愿者。详细记录纳入标本提供者的年龄、性别、吸烟史等资料。本研究经过伦理委员会批准,所有标本提供者均签署知情同意书。口腔鳞状细胞癌细胞系(SCC-4,SCC-9和SCC-15)购于上海中科院细胞库。
1.2 实验试剂
DMEM/F12完全培养基、Trizol提取试剂盒、逆转录试剂盒、Lipofectatmine 3000、PIK3R1抗体(Thermo Fisher Scientific公司,美国);MTT细胞活力检测试剂(Sigma公司,美国);Matrigel基质胶(BD公司,美国);miR-126 agomir、miR-126 antagomir及阴性对照(negative control)(上海吉玛制药技术公司,美国);Western bolt相关试剂、RIPA蛋白裂解液(上海碧云天生物技术公司);双荧光素酶报告基因检测试剂盒(Promega公司,美国)。
1.3 qRT-PCR
使用Trizol法提取标本总RNA,并用Nano-Drop2000紫外分光光度计检测RNA 浓度和纯度(A260:A280)。将miRNA 逆转录成cDNA,合成的cDNA产物直接用于PCR或保存于-20℃待用。采用SYBR GreenⅠ法进行miR-126的实时荧光定量检测。反应体系如下:miR-127逆转录产物2μl,SYBR Green Mix 9μl,上下游引物各1μl,加入DEPC水将反应总体系配至20μl。PCR反应程序如下:预变性:94℃5 min,变性:94℃30 s,退火:58℃30 s,延伸:72℃30 s,设置30个反应循环。采用2-ΔΔCt法分析实验结果。U6为miR-126内参。miR-126引物根据基因组数据库设计,由上海吉玛公司合成。
1.4 细胞转染
口腔鳞癌细胞系SCC-4细胞置于恒温CO2培养箱培养,待汇合度达80%左右加入Lipofectamine试剂进行转染。将口腔鳞癌细胞分为3组,分别加入miR-126 agomir、miR-126 antagomir以及negative control。后将细胞置于5%CO2恒温培养箱培育1~3 d以供检测。
1.5 Western blot检测PIK3R1蛋白表达水平
洗涤并收集SCC-4细胞,使用RIPA裂解液获得蛋白,BCA法测定蛋白含量,后加入SDS-PAGE蛋白上样缓冲液煮沸。配制10%SDS-聚丙烯酰胺凝胶,将蛋白样品以20μl/孔上样,设定70 V恒压电泳,蛋白质转印60 min,封闭1 h。后按照抗体说明书稀释一抗,加入PVDF膜4℃孵育过夜。次日TBST洗涤后加入二抗,室温孵育1 h后显色,获得图像使用Image J软件分析。
1.6 MTT法检测细胞增殖能力
分别将转染miR-126 agomir、miR-126 antagomir以及negative control的SCC-4细胞消化为悬液后接种至96孔板,每种细胞每孔接种量为2×103个,置于37℃5%CO2的恒温培养箱中培养6 h,在每孔细胞中加入20μl MTT继续培养4 h,将细胞培养液弃去,每孔加入DMSO 200μl,摇床混匀约10 min,用酶标仪测定A570nm光吸收值绘制细胞生长曲线。
1.7 Transwell迁移实验
收集不同转染组的SCC-4细胞,加入DMEM基础培养基,使用计数板将细胞悬液吸出滴入计数板,统计计数板中四大格细胞数,调整细胞浓度,将1×103个细胞悬液加入transwell小室,并于24孔板下室加入500μl DMEM完全培养基;将24孔板置于恒温培养箱中48 h,后取出小室移除培养基,将小室底膜进行甲苯胺蓝染色。
1.8 双荧光素酶报告基因检测
根据Promega双荧光素酶报告基因检测试剂盒说明书,将包含有与相应miRNA-126互补结合的靶基因PIK3R1 3'-UTR序列片段和突变的3'-UTR序列片段克隆到pGL3-Luciferase基因下游的多克隆位点中。正常培养的Hela 493T细胞,以4×105个/ml接种于6孔培养板,每孔体积1 ml。转染包含PIK3R1 3'-UTR或突变的PIK3R1 3'-UTR的荧光素酶质粒,以及miRNA-126 agomir、miRNA-126 antagomir或negative control。转染48 h后收集293T细胞,进行双荧光素酶活性检测。
1.9 统计学分析
采用SPSS17.0进行统计学分析,计量资料用±s表示,2组间比较采用t检验,多组间分析用单因素方差分析,当P<0.05时表示差异有统计学意义。
2 结 果
2.1 miR-126在口腔鳞癌组织和正常组织中的表达
采用qRT-PCR检测口腔鳞癌组织及正常口腔黏膜组织中miR-126的表达水平,结果显示,miR-126在口腔鳞癌组织中表达降低,含量为正常口腔黏膜组织的0.64倍,具有显著统计学差异(P<0.05)(图1)。
2.2 不同鳞癌细胞系中miR-126表达水平
采用qRT-PCR检测正常口腔黏膜上皮细胞、SCC-4,SCC-9和SCC-15中miR-126表达水平,结果显示,3种口腔鳞癌细胞中miR-126表达水平均低于正常口腔黏膜上皮细胞,其中SCC-9中表达水平最低,具有显著统计学差异(P<0.05;P<0.01)。因此使用SCC-9进行后续实验(图2)。
2.3 细胞转染效率检测
在口腔鳞癌细胞中分别转染miR-126 agomir、miR-126 antagomir以及negative control,采用qRT-PCR检测转染后miR-126表达水平,结果显示miR-126 agomir可以显著上调细胞中miR-126的表达水平,反之,加入miR-126 antagomir后其表达水平受到抑制,表达差异具有统计学意义(P<0.05)(图3)。
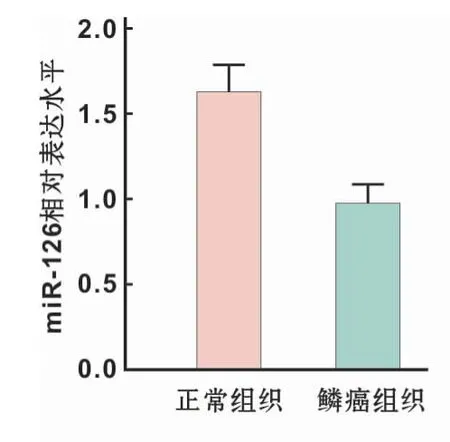
图1 口腔黏膜正常组织和鳞癌组织中miR-126表达水平Fig 1 miR-126 expression in normal and oral mucosa and OSCC
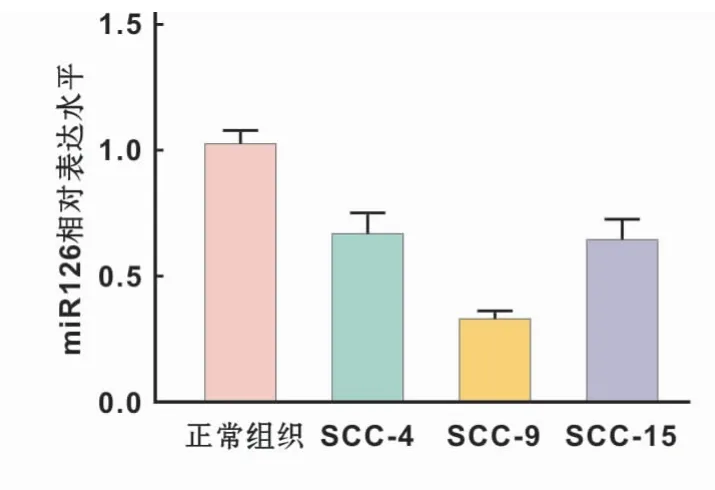
图2 不同口腔鳞癌细胞系中miR-126表达水平Fig 2 miR-126 expression levels in different OSCCcell lines
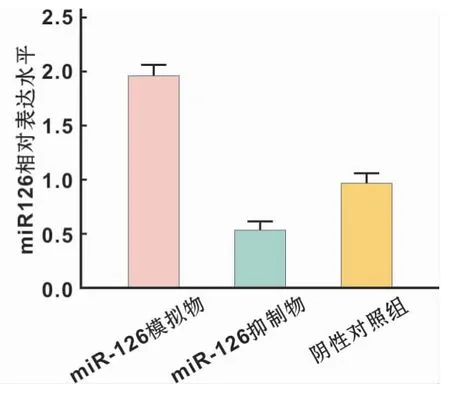
图3 不同转染条件下miR-126的表达水平Fig 3 miR-126 expression levels under different transfection conditions
2.4 miR-126对口腔鳞癌细胞增殖能力的影响
MTT法检测不同处理组鳞癌细胞的增殖能力,显示上调miR-126表达含量后,细胞增殖能力受到明显抑制,反之,下调miR-126的表达后,细胞增殖能力明显提高,结果具有显著统计学差异(P<0.05)(图4)。
2.5 miR-126对口腔鳞癌细胞迁移能力的影响
使用transwell小室检测不同处理组口腔鳞癌细胞的迁移能力,结果发现相较于对照组,上调miR-126后,细胞迁移能力受到抑制,反之,下调miR-126的表达后,细胞的增殖能力得到提高,结果具有统计学差异(P<0.05)(图5)。
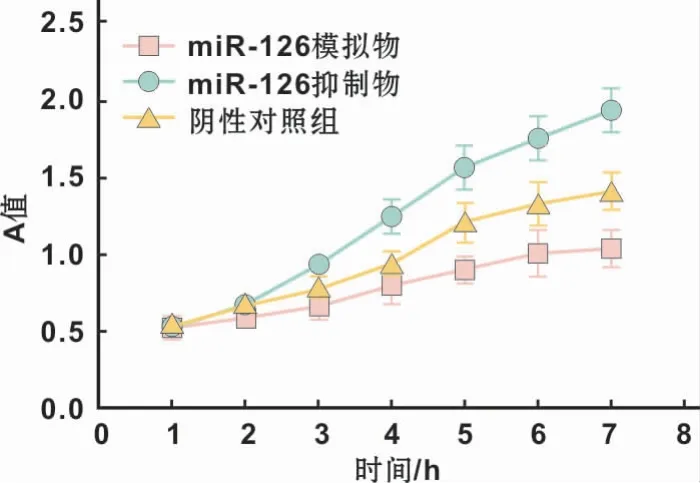
图4 不同转染条件下对鳞癌细胞增殖能力的影响Fig 4 The effect of different transfection conditions on the proliferation of OSCCcells
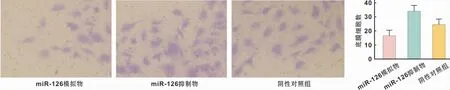
图5 不同转染条件下对鳞癌细胞迁移能力的影响 (甲苯胺蓝染色,×200)Fig 5 The effect of different transfection conditions on the migration ability of OSCC cells (Toluidine staining,×200)
2.6 双荧光素酶报告基因检测miR-126靶基因
为检测miR-126可能的靶基因,搜索生物信息学网站miRanda和Targetscan,发现PIK3R1的3'UTR区存在miR-126的结合位点,因此推测miR-126可能调节PIK3R1的表达。同时,采用Western blot检测不同转染组中PIK3R1的表达水平,结果发现下调miR-126后PIK3R1的表达水平上升,反之,下调miR-126后PIK3R1的表达水平上升,差异具有统计学意义(P<0.05)(图6)。为进一步明确miR-126与PIK3R1存在直接结合,构建含有PIK3R1 3'UTR结合位点的荧光素酶报告基因表达载体。结果显示,在含有PIK3R1 3'UTR序列的细胞中,加入miR-126后,较之对照组其荧光素酶活性明显降低(P<0.01),而在PIK3R1 3'UTR突变组中则无明显改变(图7)。
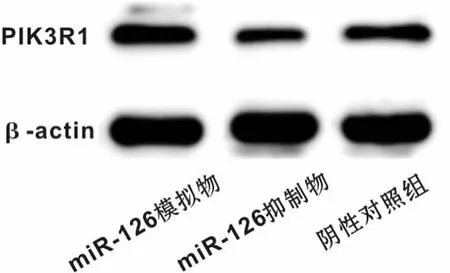
图6 不同转染条件下PIK3R1蛋白表达水平Fig 6 PIK3R1 protein expression under different transfection conditions
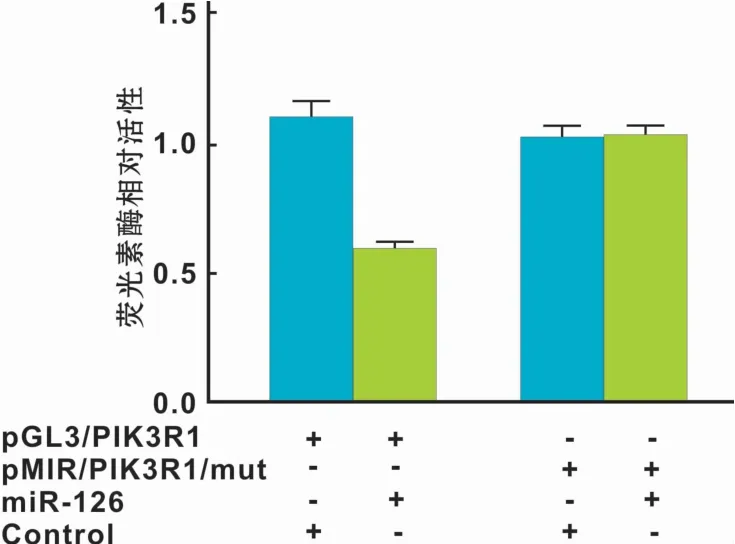
图7 双荧光素酶报告基因实验Fig 7 Dual luciferase reporter experiment
3 讨 论
MicroRNA是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子。第一个miRNA是在20世纪90年代初发现的。然而,直到21世纪初,miRNA才被认为是具有独特调节功能的一类物质。其自身通常不参与编码合成mRNA,而是在转录后水平参与靶基因调控过程,其作用遍及生命体的发生、生长、发育、分化和死亡的各个过程。如杨倩娟等[9]发现miR-20可参与人炎症牙周膜干细胞成骨分化过程。其他研究也发现细胞在发生病理过程中其miRNAs表达也发生不同变化[10]。2009年的一项研究探讨了miR-205的表达水平对乳腺癌转移的影响[11]。一项针对小细胞肺癌样本的研究发现,miR-324a的水平可作为预测患者预后生存的指标[12]。近年来的研究发现miRNAs与口腔鳞癌的发生发展以及预后也有着紧密的关联。Shin等[13]证实miR-181a在口腔鳞癌细胞中的表达量降低,而提高miR-181a的表达含量可以抑制其靶基因K-ras的表达从而抑制了鳞癌细胞的增殖能力。近年的一项纳入了29例口腔鳞癌患者与7例健康对照者进行分析,通过检测鳞癌细胞和正常口腔黏膜细胞的基因谱发现在口腔鳞癌肿瘤组织中有12个microRNAs上调及11 microRNA下调[14]。这些异常表达的microRNA可能与细胞增殖分化、凋亡、血管形成、肿瘤浸润及转移等多种功能相关。
MiR-126最初被发现在内皮细胞中表达,在血管新生中发挥着重要的作用[15]。最近的多项研究发现miR-126与肿瘤细胞的增殖与侵袭能力有关。如miR-126可通过RhoA/ROCK信号通路抑制结肠癌细胞的增殖和侵袭[16]。MiR-126还可靶向作用于PIK3R2介导的PI3K/Akt通过调节胆囊癌细胞的生物学功能[17]。然而,对于miR-126与口腔鳞癌的关系研究较少。Yang等[18]发现miR-126可以靶向于EGFL7来抑制口腔鳞癌细胞的细胞周期,此外,过表达miR-126可以抑制血管内皮生长因子(VEGF)和成纤维细胞生长因子(bFGF)的表达。本次研究通过生物信息学软件预测miR-126可能的作用靶基因,并采用双荧光素酶报告基因实验等方法进一步验证了miR-126与靶基因PIK3R1存在相关关系,证明了miR-126对于口腔鳞癌细胞生物学功能调节的可能作用机制。与此同时,采用miR-126的模拟物以及抑制物进行细胞转染,一系列的体外实验也均证实在口腔鳞癌细胞中改变miR-126的表达对于其生物学功能有着显著的调节作用。
综上所述,该研究发现口腔鳞癌细胞中,miR-126的表达水平显著降低,同时改变miR-126的表达水平可以调节口腔鳞癌细胞的增殖和迁移能力,此外,miR-126可作用于PIK3R1发挥其调节作用;因此miR-126可能作为一个潜在的治疗靶点,对于口腔鳞癌的治疗提供新的思路。
