千果榄仁及小叶榄仁核型分析
2019-10-15辛培尧尹亚梅杨自云邓莉兰
余 潇,辛培尧,尹亚梅,杨自云,邓莉兰
(1.西南林业大学园林学院,云南 昆明 650224; 2.国家林业局西南风景园林工程研究中心,云南 昆明 650224; 3.西南林业大学林学院,云南 昆明 650224; 4.西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
千果榄仁(Terminaliamyriocarpa)和小叶榄仁(Terminalianeotaliala)均为使君子科(Combretaceae)诃子属(Terminalia)植物。千果榄仁在我国主要分布于广西(龙津)、云南(中部至南部)和西藏(墨脱),是我国二级重点保护野生植物,按IUCN地方濒危等级标准评价属于“濒危种(EN)”[1]。小叶榄仁原产非洲的马达加斯加,我国的云南、广西、广东、福建、台湾等热带地区已有栽培。对榄仁属植物的染色体核型的研究目前尚处于空白状态,开展其研究一方面可为2种植物的育种研究提供参考,另一方面也可为属间和种间的进化关系以及生物的系统发育研究提供参考[2]。
1 材料和方法
1.1 材料
本实验所需千果榄仁种子来自于云南省镇沅县境内的哀牢山国家级自然保护区及瑞丽市境内的铜璧关自然保护区,小叶榄仁种子来自于云南省镇沅县。种子采收去除杂质后在西南林业大学园林学院云南省园林植物与观赏园艺重点实验室进行育苗。
1.2 方法
染色体制片技术采用李懋学等[3-4]提出的方法。
1.2.1 取样 待千果榄仁和小叶榄仁幼根长至1~1.5 cm时,于9∶00—10∶00时进行取材,选择生长健壮的白色根尖。
1.2.2 预处理 千果榄仁预处理:预处理试剂为饱和对二氯苯溶液,将根尖浸泡在饱和对二氯苯溶液,置于4 ℃冰箱中1.5 h。 小叶榄仁预处理:预处理试剂为饱和对二氯苯溶液,将根尖浸泡在饱和对二氯苯溶液,置于4 ℃冰箱中1 h。
1.2.3 固定 千果榄仁固定:将经过预处理后的根尖取出转入卡诺氏固定液(无水乙醇∶冰醋酸=3∶1,现配),放入4 ℃冰箱中固定45 min。小叶榄仁固定:将经过预处理后的根尖取出转入卡诺氏固定液(无水乙醇∶冰醋酸=3∶1,现配),放入4 ℃冰箱中固定30 min。
1.2.4 解离 千果榄仁解离:取出固定好的根尖,放入蒸馏水中浸泡10 min,解离液用1 mol·L-1盐酸和45%醋酸按1∶1比例在60 ℃水浴锅中预热6 min,将根尖放入解离液中解离15 min,取出用蒸馏水多次冲洗[5-9],洗除材料残留的解离液。小叶榄仁解离:取出固定好的根尖,放入蒸馏水中浸泡10 min,解离液用1 N盐酸在60 ℃水浴锅中预热6 min,将根尖放入解离液中解离10 min,取出用蒸馏水多次冲洗,洗除材料残留的解离液。
1.2.5 染色制片 将解离好的根尖置于洁净的载玻片中央,用刀片切下0.1 cm左右的呈透明状的根尖,滴加1~2滴醋酸地衣红染液进行染色2 min左右,用滤纸吸取多余染液,迅速盖上盖玻片,然后小木棍轻轻敲打盖玻片,使细胞分散和展开[5]。
1.2.6 镜检 用日本OlympusBX51显微镜进行观察,选取50个细胞染色体分散均匀、分裂相较好、染色体完整、着丝点及轮廓清晰、各条染色体处于同一平面的中期细胞,并进行显微照相测量及统计。
本实验染色体核型分析采用Levana等[10-11]标准划分,核型类型根据Stebbins[12]的研究依据划分,植物染色体标准化分析采用李懋学等[13]方法。使用OPTPRO2008数码显微镜图像分析处理系统中的测量工具测量染色体长度。
2 结果与分析
通过对千果榄仁和小叶榄仁染色体数目进行观察和统计,确定两者的染色体数目均为24条,未发现非整倍性变异,因此可以确定千果榄仁和小叶榄仁体细胞染色体数目为2n=2x=24,基数为x=12的二倍体(表1、图1、图2)。
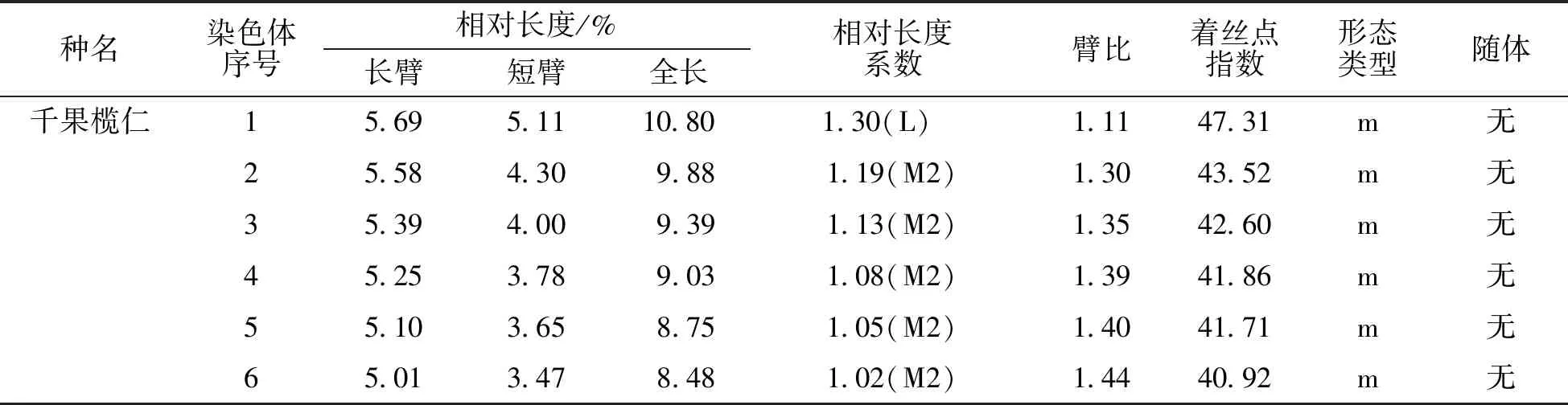
表1 千果榄仁和小叶榄仁染色体参数
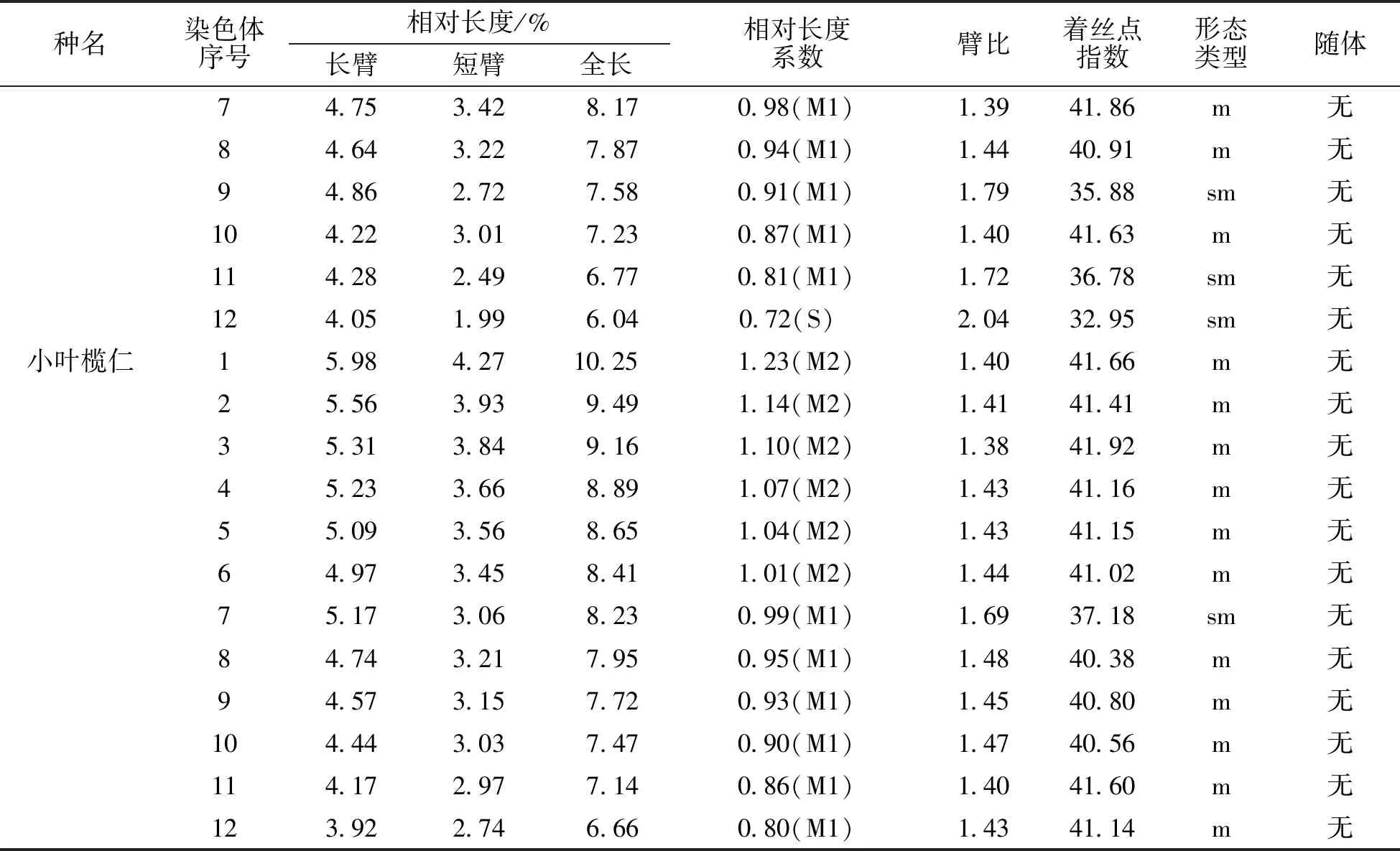
表1(续)
*:表中染色体相对长度系数(I、R、L)根据染色体长度/全组染色体平均长度的比值判断,其标准为:I、R、L<0.76,短染色体(S);0.76
千果榄仁的染色体相对长度范围在6.04~10.80 μm,全组染色体平均相对长度为8.3325 μm。最长染色体与最短染色体之比是1.79∶1,染色体相对长度系数范围为0.72~1.30,按Kuo等[14]的方法,1号为长染色体(L),2~6号为中长染色体(M2),7~11号为中短染色体(M1),12号为短染色体(S),故千果榄仁的相对长度组成为2n=2L+10M2+10M1+2S。着丝点位置与臂比值方面,臂比范围在1.11~2.04,平均臂比为1.48,着丝点指数范围在32.95%~47.31%,9号、11号、12号染色体的臂比为近中部着丝点染色体(sm),臂比值变化范围为1.72~2.04,其余为中部着丝点染色体(m),臂比值变化范围为1.11~1.44,都在1.01~1.70的范围内,所以千果榄仁的核型公式为2n=2x=24=18m+6sm,未发现具有随体染色体。千果榄仁染色体组染色体总长为99.99 μm,长臂总长为58.82 μm,根据Arano[15]的计算方法,核型不对称系数(AS.K%)为58.83%。千果榄仁的臂比值除12号染色体在2~4范围内,占染色体总数的8.33%,其余均小于2,核型属于“2A”型。根据千果榄仁染色体的长短和形态特征进行同源染色体配对,得到染色体核型图(图1)。根据表1中所列各染色体的相对长度平均值,用Excel 2007制作绘制核型模式图(图2)。
小叶榄仁的染色体相对长度范围在6.66~10.25 μm,全组染色体平均相对长度为8.335 μm。最长染色体与最短染色体之比是1.54∶1,染色体相对长度系数范围为0.80~1.23,按Kuo等[14]的方法,1~6号为中长染色体(M2),7~12号为中短染色体(M1),故小叶榄仁的相对长度组成为2n=12M2+12M1。着丝点位置与臂比值方面,臂比范围在1.38~1.69,平均臂比为1.45,着丝点指数范围在37.18%~41.92%,除7号为近中部着丝点染色体(sm),臂比值为1.69,其余均为中部着丝点染色体(m),臂比值变化范围为1.38~1.48,都在1.01~1.70的范围内,所以小叶榄仁的核型公式为2n=2x=24=22m+2sm,未发现具有随体染色体。小叶榄仁染色体组染色体总长为100.02 μm,长臂总长为59.15 μm,根据Arano[16]的计算方法,核型不对称系数(AS.K%)为59.14%。小叶榄仁的所有染色体臂比值均小于2的,核型属于“1A”型。根据小叶榄仁染色体的长短和形态特征进行同源染色体配对,得到染色体核型图(图1)。根据表1中所列各染色体的相对长度平均值,用Excel 2007制作绘制核型模式图(图2)。
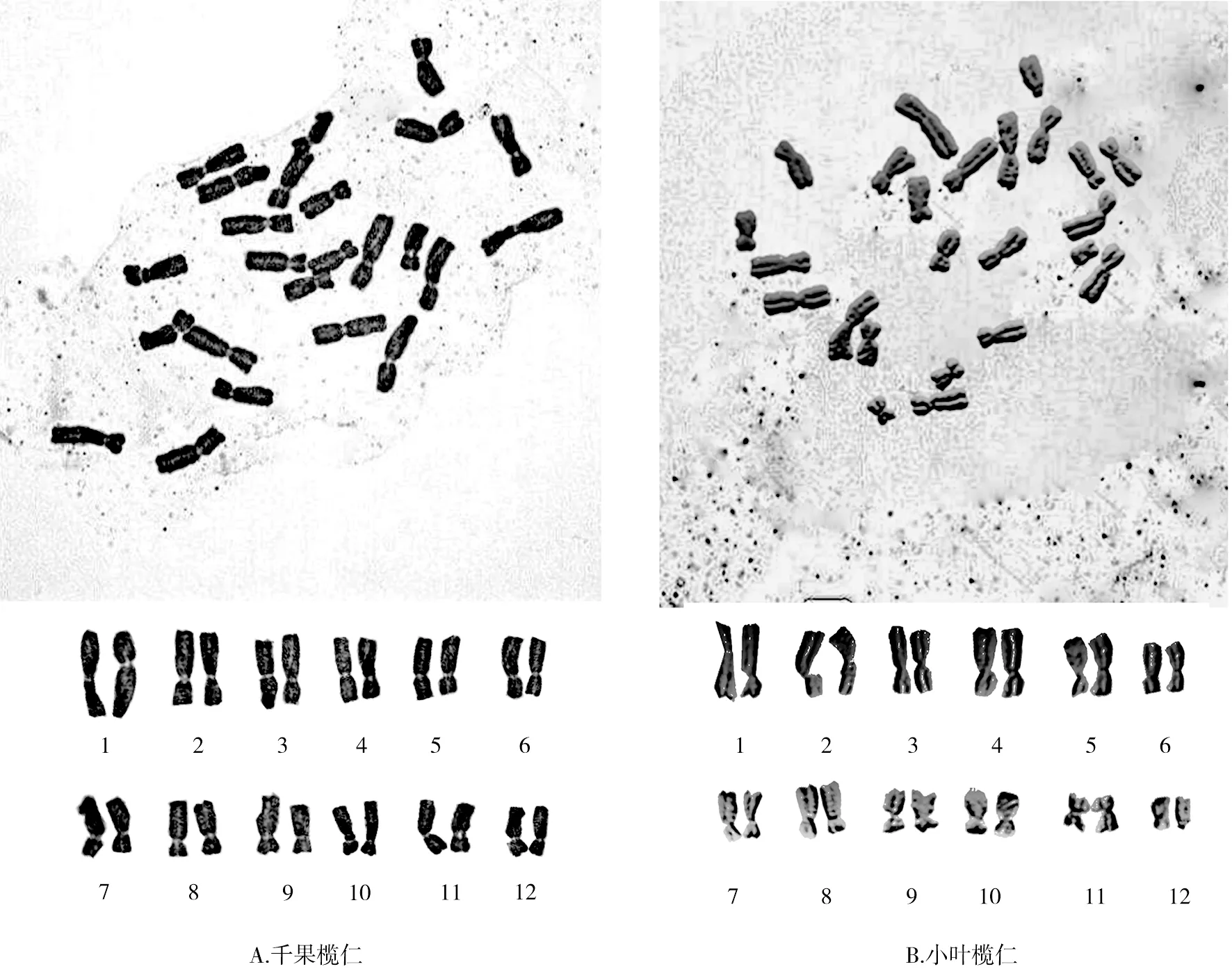
图1 千果榄仁和小叶榄仁中期染色体形态及其核型图
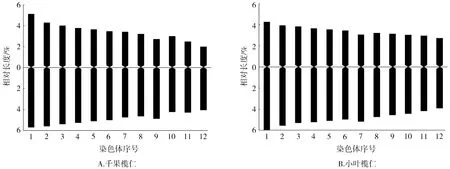
图2 千果榄仁和小叶榄仁核型模式图
3 结论与讨论
关于千果榄仁根尖细胞(RTC)进行染色体试验观察,关键是要获得分散较好的中期细胞。本试验在根尖预处理过程中对饱和对二氯苯、秋水仙素、8-羟基奎啉溶液的预处理效果做了比较,发现使用饱和对二氯苯预处理千果榄仁根尖,获得了分散良好、完整的中期染色体分裂相,效果好于其它2种预处理液。究其原因,主要是因为对二氯苯作用于大染色体的植物比处理小染色体植物的分裂相效果更好[8]。秋水仙素的预处理效果常受其浓度及处理温度的影响。而在解离过程中,解离时间也是能否获得满意的分裂相的关键之一,对于千果榄仁根尖细胞的处理时间应控制在6 min左右,具体的准确时间还需要根据试验条件微调,解离时间如果过短,细胞壁没有被打破,导致无法观察;解离时间如果过长,则会导致细胞过于松散甚至破碎,从而导致染色体过于分散无法确定这些染色体是否属于同一细胞。
在千果榄仁的核型分析中,没有发现随体染色体,其原因可能是在预处理过程中次缢痕区或者是核仁组织区的染色体高度浓缩导致与长短臂粘合而导致次缢痕消失[16],从而导致在试验中没有发现染色体随体,也有可能是由于千果榄仁染色体根本就没有带随体的特征。千果榄仁染色体有无随体的问题还有待进一步观察研究。
