HMGN5基因敲除对人膀胱上皮癌细胞顺铂化疗敏感性的影响
2019-10-15周剑文罗广承王新君颜志坚
周剑文,罗广承,王新君,颜志坚
0 引言
尿路上皮癌(UBC)目前发病率已居于泌尿生殖道恶性肿瘤第2位,其中超过30%在首次诊断时已进入晚期,总体临床预后仍较差[1]。对于尿路上皮癌晚期仍主要采用以顺铂(CDDP)为基础的化疗方案,但总体反应率仍不足50%,而这可能与CDDP抵抗现象发生有关[2],但目前为止,医学界对于UBC患者CDDP抵抗形成机制尚未完全阐明。高迁移率族核小体结合域5(HMGN5),也称为NBP-45、GARP45或NSBP1,是2001年国外学者鉴定所得HMGN蛋白质家族的最新成员[3]。近年来研究证实,HMGN5在各种人类肿瘤中呈过度表达,具有明显致癌作用[4]。但该基因对癌细胞化疗敏感性影响仍存在争议。已有研究显示,HMGN5基因敲除可通过调节E-Cad和VEGF表达,干扰人UBC 5637细胞活性和侵袭性;而肌动蛋白和转录因子与CDDP抵抗发生有关;同时抑制VEGF-C表达亦能够逆转UBC细胞对顺铂的抵抗效应[5-6]。本研究通过观察HMGN5基因敲除对人膀胱上皮癌细胞CDDP化疗敏感性的影响,旨在探索其具体作用机制,寻找潜在治疗靶点,现报道如下。
1 材料和方法
1.1 细胞培养方法 人UBC 5637、Um-UC-3及T24细胞系均由长沙赢润生物技术有限公司提供;细胞保存于RPMI 1640中,在恒温(37 ℃)、5%CO2培养箱,同时添加胎牛血清。
1.2 转染及给药方法 转染方法:长沙赢润生物技术有限公司合成HMGN5(5′-GTT-GTT-GAA-GAC-TAC-AAT-3′)最有效shRNA序列,并将其克隆到pYr-LVsh载体形成针对HMGN5慢病毒载体;将UBC细胞接种于6孔板(5×104个细胞/孔)至细胞充分融合,再采用重组慢病毒感染细胞(50倍),感染时间为24 h;继续以RPMI-1640培养基和普氏霉素(1 μg/ml)替换培养基,以筛选阳性稳定转染子;实验中使用空白对照(未感染对照)证明未感染对照与shcontrol慢病毒转染细胞间无显著差异。
给药方法:CDDP在无菌血清中梯度稀释为0、1、2、4、8及16 μg/ml浓度,PI3K信号激活剂和胰岛素样生长因子-1由PeproTech提供并溶解于二甲基亚砜;使用配置好梯度浓度CDDP加入UBC细胞或感染慢病毒细胞,实施72 h剂量依赖性细胞增殖试验,同时添加IGF-1(50 ng/ml)。
1.3 Western blot试验 UBC细胞加入CDDP(6 μg/ml)处理,加或不加IGF-1(50 ng/ml),采用溶解缓冲液溶解,参考文献方法完成Western blot检测;其中抗HMGN5抗体由Abcam提供(1∶1 000),抗AKT抗体、磷酸化(P)-AKT抗体、Slug抗体、E-Cad抗体、VEGF-C抗体、细胞色素C抗体、裂解半胱天冬酶-3、裂解PARP及β-actin均由Cell Signaling Technology提供。
1.4 细胞增殖试验 采用MTT试验评估CDDP处理后细胞增殖水平;将细胞接种于96孔板(4×103个细胞/孔)上并采用梯度浓度CDDP处理;24 h后将MTT(5 mg/ml)在37 ℃添加至细胞处理4 h;继续采用DMSO溶解活细胞形成紫蓝色甲瓒晶体,490 nm波长下测量吸光度。
1.5 菌落形成试验 转染72 h后,细胞以400个/孔密度接种至6孔板;RPMI-1640培养基中加入CDDP(6 μg/ml),加或不加IGF-1(50 ng/ml),每隔3 d换液,连续2周;200倍光镜下计数菌落(≥50个菌落),室温以纯甲醇固定15 min,采用0.005%龙胆紫染色20 min。
1.6 细胞侵袭试验 采用Transwell试验评估细胞侵袭情况。每个Transwell插入物(孔径8 μm)上部铺有基底胶,接种含不同HMGN5表达水平膀胱癌5 637细胞(1×105个);细胞在37 ℃温度下培养于血清游离RPMI 1 640培养基,采用CDDP(6 μg/ml)和IGF 1(50 ng/ml)处理;培养24 h,细胞迁移后采用棉签去除上腔黏附细胞,室温下加入4%多聚甲醛固定表面细胞30 min,并继续采用0.1%结晶紫染色20 min,采用200倍共焦显微镜计数。
1.7 细胞凋亡试验 采用膜联蛋白V-荧光素异硫氰酸盐法检测细胞凋亡状态,试剂盒由南京科根生物技术有限公司提供;感染、CDDP(6 μg/ml)及IGF-1(50 ng/ml)处理24 h后,收集细胞以膜联蛋白V和碘化丙烷暗室标记。采用BD流式细胞检测细胞凋亡,并采用BD-Facsdiva 6.1.3软件分析。
1.8 Hoechst 33342染色 转染后24孔板上培养细胞,采用相同方法加CDDP和IGF-1(PI3K/Akt信号激活剂)处理,并继续添加Hoechst 33342(1 μg/ml);37 ℃下染色20~30 min;以冰PBS洗涤细胞2次,200倍荧光显微镜下观察;凋亡细胞中可见浓稠荧光;凋亡细胞比例计算:5个随机视野中凋亡细胞数/5个随机视野中总细胞数。
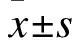
2 结果
2.1 HMGN55蛋白对UBC细胞CDDP敏感性的影响 Western blot试验检测UBC细胞株5637、t24及UM-UC-3中HMGN5蛋白表达,其中5637细胞系HMGN5蛋白水平最高,而UM-UC-3细胞中最低(P<0.05),见图1A。采用细胞增殖MTT试验检测以上3种细胞系对于CDDP敏感性,其中5637细胞系对CDPP敏感性显著高于其他2种(P<0.05),且UM-UC-3细胞系敏感性最高,见图1B。UBC细胞系HMGN5敲除后P-Akt表达显著下降(P<0.05),见图1C。

图1 HMGN5蛋白对UBC细胞CDDP敏感性的影响
2.2 CDDP 剂量依赖性影响UBC细胞HMGN5表达 Western blot试验结果中,CDDP对于HMGN5蛋白表达影响具有剂量依赖性方式;同时CDDP处理后P-Akt活性亦随之降低(P<0.05),CDDP处理还可下调VEGF-C和SLUG表达,上调E-Cad表达(P<0.05);此外,CDDP处理后细胞色素C、裂解半胱天冬酶-3及裂解半胱天冬酶表达均呈剂量依赖性上调(P<0.05),见图2。
2.3 HMGN5基因敲除可增强5637细胞对CDDP治疗敏感性 不同浓度(1~16 μg/ml)CDDP孵育24 h后,与阴性对照细胞相比,HMGN5基因敲除后5637细胞活力显著下降(P<0.05),见图3A。菌落形成分析结果提示,与单层培养14 d阴性对照细胞相比,HMGN5基因敲除后5637细胞形成菌落明显减少(P<0.05),而添加IGF-1后可在一定程度上增加菌落数(P<0.05),见图3B、3C。HMGN5基因敲除后采用CDDP处理24 h,5637细胞基质凝胶穿过数量显著下降(P<0.05),见图3D。流式细胞术结果显示,5637细胞HMGN5基因敲除后早期凋亡率显著提高,而加入IGF-1可逆转这一过程(P<0.05),见图3E。Hoechst 33342染色法结果显示,与阴性对照组和IGF-1治疗组相比,HMGN5敲除组凋亡核百分比显著升高(P<0.05),见图3F。Western blot试验结果显示,与对照组相比,HMGN5基因敲除显著下调P-AKT和VEGF-C表达,上调E-Cad、细胞色素C、裂解半胱天冬酶-3、裂解PARP表达(P<0.05),而添加IGF-1可逆转以上蛋白质表达变化(P<0.05),见图3G。

图2 CDDP剂量依赖性影响UBC细胞HMGN5表达

图3 HMGN5基因敲除影响5637细胞对CDDP治疗的敏感性
3 讨 论
HMGN5是HMGN蛋白质家族的最新成员,已有研究显示,HMGN5具有致癌效应,但其在化疗敏感性调节中作用仍未完全阐明[7]。既往报道认为,HMGN5可通过调节E-Cad和VEGF表达,加快UBC病情进展,而这可能与与肿瘤细胞对CDDP敏感性有关[8]。
本研究结果显示,HMGN5能够有效调节UBC细胞中P-Akt表达;同时HMGN5表达与UBC细胞对于顺铂敏感性呈负相关。以上均提示HMGN5基因可能是CDDP化疗潜在治疗靶点,这与CDDP可剂量依赖性下调HMGN5基因表达有关。此外,研究显示,HMGN5基因敲除可降低5637细胞系存活率、集落形成及侵袭水平,但CD-DP治疗后细胞凋亡量升高[9]。IGF-1是PI3K/Akt信号激活剂,其能够逆转5637细胞系因HMGN5基因敲除引起的改变[10];随着HMGN5基因表达水平降低,P-AKT、SLUG、E-Cad及VEGF-C表达同时受到抑制,而HMGN5基因敲除后细胞色素C、裂解半胱天冬酶3及裂解多聚ADP核糖聚合酶表达增加[11]。
国外学者报道显示,骨肉瘤细胞系中,HMGN5均上调PI3KP85α和P-AKT表达,并可刺激肿瘤细胞恶性潜能[12-13]。本研究结果中,UBC 5637、T24及UM-UC-3细胞系敲除HMGN5基因后,P-Akt表达随之降低,而Akt表达并未见明显改变,说明HMGN5基因可能具有PI3K/AKT信号正调节效应,笔者认为可能机制为HMGN5具有蛋白激酶效应,可刺激Akt磷酸化,但HMGN5可能会放大PI3K催化亚单位转录水平[14],故这一作用仍有待进一步探讨。此外,PI3K/Akt信号还能够调节EMT进展和VEGF-C表达,基于以上推测HMGN5能够通过PI3K/Akt信号通路对E-Cad和VEGF水平进行调节。
化疗是实体瘤临床综合治疗重要组成部分,其疗效与肿瘤细胞对化疗药物敏感性密切相关[15]。但目前有关HMGN5在调节化疗敏感性方面研究争议较大。部分学者研究显示,抑制HMGN5基因可有效提高恶性脑膜瘤细胞对替莫唑胺诱导细胞毒性敏感性[16];而在骨肉瘤细胞系中敲除HMGN5基因可通过激活凋亡信号通路增强阿霉素诱导细胞损伤敏感性[17]。但另一项研究显示,HMGN5表达水平与前列腺癌细胞系对吉西他滨化疗敏感性呈正相关,故高表达HMGN5基因可能提高化疗效果[18]。MTT试验结果显示,与HMGN5基因表达水平较高的细胞相比,表达水平较低的UBC细胞对于CDDP治疗敏感性更高;同时HMGN5基因敲除可显著降低5637细胞系在CDDP治疗过程中增殖、菌落形成及侵袭作用,故HMGN5基因表达较高的UBC细胞HMGN基因缺失可能提高肿瘤细胞对于CDDP治疗敏感性。
已有研究显示,PI3K/Akt信号通路异常激活在CDDP抵抗中发挥着关键作用,抑制PI3K/Akt信号通路可增强CDPP治疗作用[19];同时EMT及其活化剂过度表达与CDDP抵抗性呈正相关。此外,血管内皮生长因子C已参与到CDDP敏感性调节环节[20]。本次研究采用Western blot检测HMGN5基因敲除后5637细胞系,可见P-Akt、SLUG、E-Cad及VEGF-C蛋白水平受到显著抑制,提示PI3k/Akt信号传导、EMT及淋巴管生成参与到这一过程中。国外学者报道显示,细胞凋亡激活是CDDP发挥抗肿瘤效应的主要机制[21]。本研究采用流式细胞术和Hoechst 33342染色,结果显示,5637细胞系敲除HMGN5细胞凋亡水平显著增强。
既往有报道显示,CDDP可影响HMGN5基因表达及影响其下游信号分子[22]。针对这一现象,笔者认为HMGN5可能是CDDP治疗相关分子靶点,故CDDP可直接抑制UBC细胞系中HMGN5表达;而另一种可能是CDDP可直接杀伤UBC细胞,从而导致HMGN5表达量减少。但这一机制仍不明确,尚需更深入研究证实。
综上所述,HMGN5可能是顺铂治疗的潜在靶点,抑制HMGN5基因有助于增加UBC细胞化疗敏感性,这一作用主要通过干扰PI3K/Akt信号通路实现。
